RESUMO
O edema pulmonar é uma condição bastante prevalente, sobretudo no contexto de terapia intensiva, ocasionado por diferentes origens e decorrente de mecanismos diversos. Por vezes, os exames de imagem, em particular a tomografia computadorizada, são utilizados na investigação diagnóstica desses pacientes, podendo auxiliar, inclusive, na elucidação etiológica. Portanto, é essencial que os radiologistas entendam a natureza dinâmica das alterações associadas ao edema pulmonar e sejam capazes de reconhecer pistas diagnósticas que indiquem possíveis etiologias, além de compreender os mecanismos subjacentes. Este ensaio ilustrado oferece uma revisão concisa da fisiopatologia do edema pulmonar e destaca seus principais achados em imagens, enfocando as características clínicas que ajudam a refinar o diagnóstico etiológico.
Palavras-chave:
Diagnóstico por imagem; Radiologia do tórax; Edema pulmonar.
ABSTRACT
Pulmonary edema is a very prevalent condition, especially in the intensive care setting, and can have different origins and be caused by different mechanisms. Imaging tests, particularly computed tomography, are sometimes used in the diagnostic investigation of these patients, and may even help to elucidate the etiology. Therefore, it is essential that radiologists understand the dynamic nature of the changes associated with pulmonary edema and be able to recognize diagnostic clues that indicate possible etiologies, in addition to understanding the underlying mechanisms. This illustrated essay provides a concise review of the pathophysiology of pulmonary edema and highlights its main imaging findings, focusing on the clinical features that help to refine the etiological diagnosis.
Keywords:
Diagnostic imaging; Chest radiology; Pulmonary edema.
INTRODUÇÃO
O edema pulmonar pode ser conceituado como acúmulo anormal do fluido no meio extravascular, no interior do interstício pulmonar e dos alvéolos(1). Trata-se do resultado do desbalanço das forças de Starling sem a completa correção pelas respostas fisiológicas(1,2) – aumento da capacidade linfática; diminuição da pressão oncótica intersticial pela membrana alveolocapilar semipermeável (Figura 1).
O desbalanço das forças de Starling
(2) explica a origem dos três principais mecanismos de formação do edema pulmonar, que ajudam na compreensão dos diferentes achados na imagem torácica (Tabela 1). Primeiramente, o aumento da pressão hidrostática
(1) que, por consequência, leva ao desbalanço das pressões quando a pressão hidrostática excede a oncótica e o líquido se acumula no interstício pulmonar, podendo atingir até os alvéolos. Já o mecanismo por alteração da permeabilidade
(1) ocorre quando um processo inflamatório significativo gera dano ao endotélio capilar e ao epitélio alveolar. Por fim, tem- se também o mecanismo misto
(1), que envolve tanto o aumento da pressão hidrostática quanto a alteração da permeabilidade
(1).
EDEMA PULMONAR POR DESBALANÇO DAS PRESSÕESO edema pulmonar associado a alteração da pressão hidrostática mais frequentemente decorre do seu aumento e tem como causas principais a insuficiência cardíaca
(2–5) e a sobrecarga hídrica
(1). Ressalta-se, porém, que também existem os casos de edema por pressão negativa, em que a pressão vascular está normal, mas há maior redução da pressão alveolar, gerando um diferencial pressórico com migração de fluidos para o espaço alveolar. Os achados de imagem que corroboram esse mecanismo são
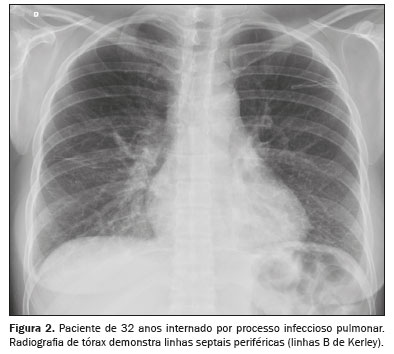
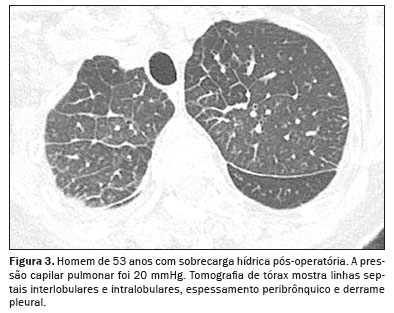
(1,6): ingurgitamento do pedículo vascular, com aumento da porção superior do mediastino – acima do arco aórtico; cefalização vascular, com redistribuição do sangue para os lobos superiores; ingurgitamento do feixe broncovascular causado pelo aumento da espessura do interstício ao redor das paredes de um brônquio ou bronquíolo, que na tomografia mostra-se similar ao espessamento da parede do brônquio, sem redução luminal; linhas septais
(3), que traduzem a congestão e o ingurgitamento venolinfático nos septos interlobulares e correspondem às linhas B de Kerley vistas na radiografia do tórax (Figuras 2 e 3); aumento de densidade ou opacidades em vidro fosco e, mais comumente, derrame pleural e sinais de cardiomegalia
(2,3).
EDEMA AGUDO DE PULMÃONos casos de aumento rápido da pressão pulmonar pode haver extravasamento de líquido dos vasos para o espaço alveolar, o que tende a ocorrer mais nas porções medulares dos pulmões, onde a pressão é maior, gerando o aspecto clássico de opacidades em vidro fosco e consolidações em asa de morcego
(1), no qual a periferia não é acometida (Figura 4).
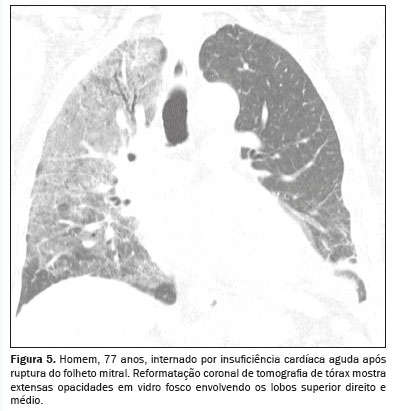
Há, também, outra forma atípica relacionada ao aumento da pressão hidrostática: o edema pulmonar assimétrico que ocorre em consequência de insuficiência mitral aguda
(3), que determina elevação súbita da pressão atrial esquerda para 10–15 mmHg
(1), com jato de regurgitação mais frequentemente direcionando para o óstio da veia pulmonar superior direita, determinando edema unilateral, que costuma acometer o lobo superior do pulmão direito
(1) (Figura 5).
EDEMA PULMONAR POR PRESSÃO NEGATIVA (PÓS-OBSTRUTIVO)Esta complicação ocorre após obstrução súbita das vias aéreas superiores, em casos de laringoespasmo, epiglotite, estrangulamento, extubação recente ou crises convulsivas. O paciente realiza inspirações forçadas, gera pressões intratorácicas anormalmente negativas (chegando a –50 a –100 cmH
2O), aumentando o retorno venoso ao coração direito e elevando a pressão hidrostática nos capilares pulmonares, favorecendo o extravasamento de líquido para o interstício, os alvéolos e a formação do edema. Na tomografia, observam-se opacidades em vidro fosco e/ou consolidações, predominantemente nas regiões centrais dos pulmões, com ausência de derrame pleural ou espessamento septal liso fora das áreas acometidas (Figura 6). Conforme descrito por Cascade et al.
(4), ocorre rápida resolução após a desobstrução das vias aéreas e suporte ventilatório adequado.
EDEMA PULMONAR POR ALTERAÇÃO DA PERMEABILIDADE VASCULAROs edemas por alteração da permeabilidade vascular decorrem de alterações da permeabilidade da membrana alveolocapilar, podendo ou não haver dano ao epitélio alveolar
(1–3.
A principal entidade clínica associada a este padrão histológico é a síndrome do dano alveolar difuso
(2,5), que altera a permeabilidade vascular causando dano direto ao alvéolo. Outras etiologias também devem ser consideradas, contudo, sem o dano alveolar significativo, como o edema por altitude
(1).
SÍNDOME DO DANO ALVEOLAR DIFUSOA síndrome do dano alveolar difuso reflete bem a alteração do balanço bioquímico com excesso de citocinas e interleucinas, as quais geram alteração da permeabilidade da membrana plasmática do endotélio vascular, com dano direto à membrana por meio das células inflamatórias
(1,2). Os achados na imagem mais clássicos na fase aguda incluem opacidades em vidro fosco e consolidações classicamente com gradiente gravitacional
(1), notando-se opacidades mais densas nas regiões pendentes (Figura 7). Nos casos que evoluem com fibrose, é comum que isso ocorra nas zonas mais anteriores/não pendentes por meio de mecanismo de barotrauma/volutrauma.
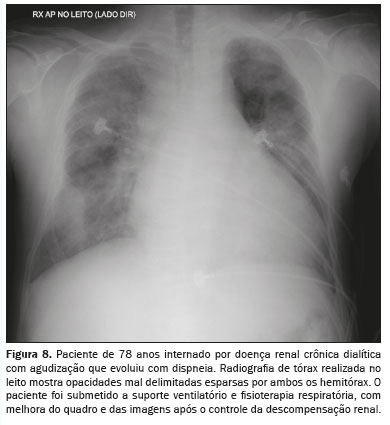
EDEMA PULMONAR URÊMICOO edema pulmonar de origem urêmica é o resultado de alterações das forças de Starling intravasculares pulmonares decorrentes do aumento na permeabilidade da membrana capilar pulmonar, em consequência do alto teor de proteína no fluido do edema pulmonar. Na imagem (Figura 8), muito frequentemente, se observam sinais de congestão pulmonar esparsas de aspecto que pode se assemelhar ao edema em asa de morcego
(7,8), citado anteriormente.
EDEMA PULMONAR POR MECANISMO MISTOO edema pulmonar por mecanismo misto envolve tanto alterações da pressão hidrostática como da permeabilidade vascular
(1,2), em que temos como principais representantes edema pulmonar neurogênico, por reperfusão, após transplante pulmonar, por reexpansão e pós-pneumonectomia
(1,2).
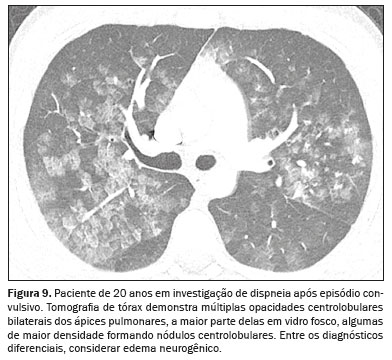
EDEMA PULMONAR NEUROGÊNICOEsta condição exige correlação com a história clínica, pois manifesta-se como desconforto respiratório agudo secundário a lesões neurológicas graves
(9), como trauma craniano, hemorragia subaracnóidea e crises convulsivas
(1,9). Acredita-se que envolvam disfunção autonômica com vasoconstrição sistêmica e liberação de mediadores inflamatórios, causando hipertensão pulmonar e aumento da permeabilidade capilar
(1). Radiologicamente, observam-se consolidações bilaterais predominantes nos ápices e com padrão heterogêneo. Com o tratamento adequado da causa neurológica, os achados torácicos geralmente se resolvem em até 48 horas
(1) (Figura 9).
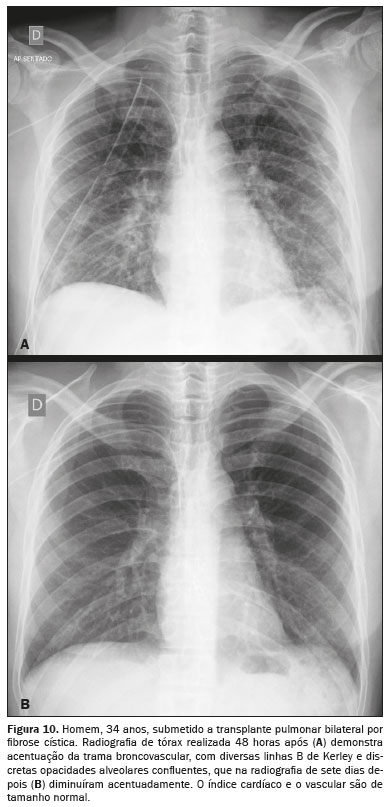
EDEMA PULMONAR PÓS-TRANSPLANTE PULMONARO edema pulmonar após transplante pulmonar envolve o mecanismo de permeabilidade, em razão do processo de hipóxia do pulmão doador, que gera isquemia e perda de surfactante, além da interrupção da drenagem linfática e denervação de origem cirúrgica
(1). Como achados de imagem mais característicos, observam-se opacidades em vidro fosco peri-hilares, espessamento do interstício peribrônquico, hiperdensidades alveolares no lobos inferiores
(1,2), esses achados no contexto de transplante pulmonar após 24 horas até 7 dias
(1) (Figura 10).
EDEMA PULMONAR PÓS-AFOGAMENTOOutra etiologia incomum é o edema pulmonar após episódio de inalação ou aspiração de água nas últimas 24 horas. Há dois mecanismos: primeiramente, edema de pressão negativa pelo espasmo da laringe e, depois, edema de permeabilidade pelo dano alveolar desencadeado pela água aspirada em contato com os alvéolos. Os achados de imagem são superponíveis às outras causas de edema não cardiogênico, geralmente sem cardiomegalia ou derrame pleural, sendo a história de afogamento fundamental
(1) (Figuras 11 e 12).
EDEMA PULMONAR POR REEXPANSÃOEsta entidade se dá associada a história de reexpansão após toracocentese. O edema pulmonar, por mecanismo misto, ocorre após 48 horas, com resolução em até 7 dias do procedimento
(1). As manifestações radiológicas típicas incluem opacidades em vidro fosco peri-hilares e pequenas consolidações centrais no lado drenado e reexpandido, além de espessamento peribrônquico. Frequentemente observam-se áreas de opacidade em vidro fosco e até consolidação
(10,11). O espessamento dos feixes broncovasculares e o espessamento septal interlobular também são achados comuns
(1) (Figura 13).
EDEMA PULMONAR DE ALTITUDEA história epidemiológica tem papel muito importante no diagnóstico, pois está relacionada diretamente a exposição a baixa concentração de oxigênio acima dos 3.000 metros após três dias
(1). Enquadra-se como mecanismo misto em razão da descarga simpática transitória causando vasoconstrição pulmonar, que ocasiona desbalanço pressórico e alteração do potencial transmembrana
(1) (Figura 14).
ULTRASSONOGRAFIA PULMONARA ultrassonografia pulmonar, exame não invasivo e livre de radiação, é especialmente útil em unidades de terapia intensiva por diferenciar rapidamente os tipos de edema pulmonar. A presença de linhas B – artefatos de reverberação originados da linha pleural hiperecogênica – permite estimar semiquantitativamente o conteúdo de água extravascular pulmonar, variando de normal a edema grave
(12,13). Anormalidades bilaterais na linha pleural, como espessamento, irregularidade ou fragmentação, sugerem edema não cardiogênico
(14). A elastografia por ondas de superfície pode avaliar as propriedades elásticas do tecido pulmonar, contribuindo para a caracterização do edema
(13).
CONCLUSÃOO edema pulmonar reflete o extravasamento de líquido para o interstício e para os espaços alveolares, com diversos mecanismos subjacentes. A imagem, aliada à história clínica, pode levar ao diagnóstico de casos desafiadores, além de permitir acompanhamento oportuno desses pacientes. Dessa forma, os radiologistas devem compreender os mecanismos formadores e os principais aspectos de imagem envolvidos.
REFERÊNCIAS1. Gluecker T, Capasso P, Schnyder P, et al. Clinical and radiologic features of pulmonary edema. Radiographics. 1999;19:1507–33.
2. Barile M. Pulmonary edema: a pictorial review of imaging manifestations and current understanding of mechanisms of disease. Eur J Radiol Open. 2020;7:100274.
3. Swensen SJ, Aughenbaugh GL, Douglas WW, et al. High-resolution CT of the lungs: findings in various pulmonary diseases. AJR Am J Roentgenol. 1992;158:971–9.
4. Cascade PN, Alexander GD, Mackie DS. Negative-pressure pulmonary edema after endotracheal intubation. Radiology. 1993;186:671–5.
5. Malek R, Soufi S. Pulmonary edema. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan.
6. Assaad S, Kratzert WB, Shelley B, et al. Assessment of pulmonary edema: principles and practice. J Cardiothorac Vasc Anesth. 2018;32:901–14.
7. Rackow E, Fein IA, Sprung C, et al. Uremic pulmonary edema. Am J Med. 1978;64:1084–8.
8. Hublitz UF, Shapiro JH. Atypical pulmonary patterns of congestive failure in chronic lung disease. The influence of pre-existing disease on the appearance and distribution of pulmonary edema. Radiology. 1969;93:995–1006.
9. Al-Dhahir MA, Das JM, Hall WA, et al. Neurogenic pulmonary edema. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan.
10. Baik JH, Ahn MI, Park YH, et al. High-resolution CT findings of re-expansion pulmonary edema. Korean J Radiol. 2010;11:164–8.
11. Corcoran JP, Psallidas I, Barker G, et al. Reexpansion pulmonary edema following local anesthetic thoracoscopy: correlation and evolution of radiographic and ultrasonographic findings. Chest. 2014;146:e34–e37.
12. Picano E, Pellikka PA. Ultrasound of extravascular lung water: a new standard for pulmonary congestion. Eur Heart J. 2016;37:2097–104.
13. Wiley BM, Zhou B, Pandompatam G, et al. Lung ultrasound surface wave elastography for assessing patients with pulmonary edema. IEEE Trans Biomed Eng. 2021;68:3417–23.
14. Heldeweg MLA, Smit MR, Kramer-Elliott SR, et al. Lung ultrasound signs to diagnose and discriminate interstitial syndromes in ICU patients: a diagnostic accuracy study in two cohorts. Crit Care Med. 2022;50:1607–17.
1. Hospital Israelita Albert Einstein, São Paulo, SP, Brasil
a.
https://orcid.org/0009-0005-6659-0730 b.
http://orcid.org/0000-0002-0233-0041 c.
https://orcid.org/0009-0006-5958-8461 d.
https://orcid.org/0009-0003-3567-6633 e.
https://orcid.org/0000-0002-6152-3556 f.
https://orcid.org/0000-0002-8571-5667 g.
https://orcid.org/0000-0003-4277-9131 h.
https://orcid.org/0000-0003-3748-5649 i.
https://orcid.org/0000-0002-4193-7647Correspondência: Dr. Matheus Marcelino Dias
Hospital Israelita Albert Einstein
Avenida Albert Einstein, 627, Jardim Leonor
São Paulo, SP, Brasil, 05652-900
E-mail:
dr.matheusmdias@gmail.com
Received in
December 1 2024.
Accepted em
May 30 2025.
Publish in
September 22 2025.

 |
|