Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 2 - Mar. / Abr. of 2010
Vol. 43 nº 2 - Mar. / Abr. of 2010
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Hélio Sebastião Amâncio de Camargo Júnior, Márcia Martos Amâncio de Camargo, Sandra Regina Campos Teixeira, Juliana Azevedo, Maurício de Souza Arruda |
|
|
Descritores: Biópsia mamária, Biópsia vácuo-assistida, Mamotomia, Mamografia, Microcalcificações, Vacora |
|
|
Resumo:
INTRODUÇÃO A biópsia vácuo-assistida é uma forma de se obter tecido mamário para análise histológica em procedimento percutâneo (não cirúrgico), sendo por isso considerada minimamente invasiva. Ela pode ser realizada mediante orientação mamográfica (no caso requer o uso do recurso da estereotaxia), ultrassonográfica ou por ressonância magnética. Essa é a forma de biópsia percutânea que obtém a maior quantidade de tecido(1). Estudos demonstraram que com essa obtenção de maior quantidade de tecido a taxa de subestimativa no diagnóstico das microcalcificações mamárias é menor que a da biópsia de fragmento estereotáxica, diminuindo, assim, a necessidade de biópsias cirúrgicas(2,3). A desvantagem da biópsia vácuo-assistida é seu custo, consideravelmente maior que o da biópsia de fragmento. Inicialmente, só havia um representante no Brasil de dispositivos de biópsia vácuo-assistida, e o nome mais comumente dado ao procedimento, mamotomia, é uma referência ao nome comercial desse produto. Hoje há outros produtos de biópsia vácuo-assistida disponíveis no Brasil. Um deles é um aparelho portátil (Figura 1) que dispensa o uso de cabos e centrais geradoras de vácuo. Esse sistema tem custo consideravelmente menor (cerca de quatro vezes), e por isso pode ser uma alternativa vantajosa para a realidade do nosso meio. Sua desvantagem potencial está na necessidade de retirada e reintrodução da sonda a cada colheita, que poderia aumentar o tempo do procedimento e diminuir a sua precisão. Além disso, pode-se questionar se o vácuo produzido pelo sistema portátil tem uma força de pressão suficiente para produzir fragmentos de qualidade diagnóstica.
Este estudo foi desenhado com o objetivo de testar o desempenho desse equipamento na biópsia de microcalcificações, quanto à sua capacidade de obter amostras de tecido adequadas para análise histopatológica e quanto a possíveis inconvenientes trazidos pela necessidade de reintrodução da sonda a cada colheita.
MATERIAIS E MÉTODOS Foram realizadas 35 biópsias vácuo-assistidas em pacientes portadoras de microcalcificações, no período de janeiro de 2008 a outubro de 2008, utilizando o dispositivo Vacora® (Bard Biopsy Systems; Temple, AZ, EUA). A média de idade das pacientes foi de 54 anos. Foram incluídas pacientes consecutivas encaminhadas para biópsia percutânea de microcalcificações classificadas como BI-RADS® 4 ou 5. O critério de exclusão seria de pacientes com alergia ao anestésico ou incapacitadas de permanecer imóveis durante o tempo de exame. Não houve pacientes excluídas do grupo. Todas as biópsias foram realizadas por um de dois médicos, um especialista em radiodiagnóstico e mastologia, além de habilitação em mamografia, e outro com habilitação em ultrassonografia e mamografia, ambos com mais de sete anos de experiência em radiologia mamária. Em todos os casos foi utilizada orientação estereotáxica com sistema dedicado Giotto (IMF; Bolonha, Itália), no qual a paciente fica em decúbito ventral horizontal e a mama é abordada através de uma abertura na maca (Figura 2). Foi usada anestesia local com lidocaína, sem vasoconstritor junto à pele, e com vasoconstritor nos planos profundos. Foram obtidos em média 12 fragmentos em cada ciclo de colheita.
Foi utilizada a técnica convencional do dispositivo: a cânula é sempre posicionada no mesmo ponto central em todas as colheitas. Este ponto é determinado pela estereotaxia. Realizam-se, então, sucessivas colheitas em orientações radiais com 30 graus de diferença, até completar a circunferência em torno da cânula. O dispositivo é retirado para remoção do fragmento após cada colheita, e reintroduzido na mesma posição. A mudança de orientação da janela de colheita da cânula é selecionada no próprio dispositivo (Figura 3). Não há, no sistema testado, dispositivo para aspiração do hematoma pós-coleta.
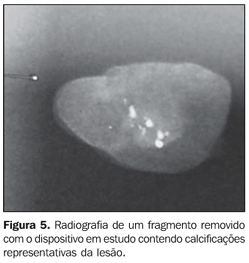
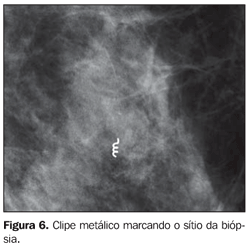
Foram testados os seguintes parâmetros: adequação da amostra, número de ciclos de colheita e dificuldade técnica na introdução repetida da cânula. Os fragmentos retirados (Figura 4) foram radiografados (Figura 5). Na presença de calcificações representativas, foi colocado um clipe metálico marcando o local da biópsia (Figura 6), exceto nos casos em que havia lesões residuais muito evidentes que pudessem ser usadas como marcador biológico no caso de necessidade de reintervenção. Na ausência de calcificações representativas, o procedimento foi repetido até que elas fossem obtidas.
Foram consideradas calcificações representativas quando pelo menos cinco calcificações agrupadas eram retiradas, e essas eram algumas das mais suspeitas para malignidade. Após o término do procedimento, realizava-se mamografia em duas incidências da mama que sofreu a intervenção para confirmar a retirada das calcificações e o posicionamento do clipe. Nos casos de diagnóstico benigno, foi recomendado acompanhamento radiológico semestral.
RESULTADOS Todas as biópsias obtiveram fragmentos contendo calcificações representativas da lesão radiológica. O anatomopatológico revelou: achados benignos em 23 casos (hiperplasia típica em 5 casos, calcificações psamomatosas em 6 casos, adenose simples em 1 caso, calcificações distróficas em 2 casos e calcificações benignas não especificadas no laudo anatomopatológico em 3 casos); carcinoma ductal in situ em 8 casos, sendo de alto grau em 4 deles; carcinoma ductal invasivo em 2 casos, ambos de alto grau; e lesão de alto risco (hiperplasia ductal atípica) em 2 casos. Entre os 8 casos de carcinoma ductal in situ, a cirurgia definitiva mostrou carcinoma ductal invasivo em 1 caso. Nos 2 casos de lesão de alto risco, a paciente foi submetida a biópsia cirúrgica e o diagnóstico foi confirmado. Foi necessário realizar dois ciclos de colheitas em 6 casos e um ciclo nos outros 29 casos. Não houve dificuldade técnica na reintrodução múltipla da sonda, pois ficou constatado que os guias da estereotaxia dirigem a sonda exatamente onde está o orifício feito anteriormente, uma vez que a paciente permanece com a mama fixada durante todo o procedimento. Houve remoção completa das lesões em 8 casos e amostragem parcial em 27. Foi utilizado um clipe marcador em 31 casos. Não houve erros na colocação do clipe em nenhum dos casos. Não houve complicações graves. Ocorreram hematomas em 15 casos (43%), revelando-se volumosos em 3 deles (9%). Não houve necessidade de drenagem dos hematomas. O tempo médio despendido em cada ciclo de colheitas foi de oito minutos. Relativamente à dor, o procedimento foi bem tolerado em todas as pacientes. Ocasionalmente, queixa de dor durante o procedimento precisou de reforço anestésico no local em questão. O dispositivo testado não permite aplicação de anestésico diretamente pela cânula de biópsia. Assim, quando necessário, o reforço anestésico foi aplicado por uma agulha colocada ao lado da cânula, ou, retirando-se a cânula, no próprio trajeto da biópsia.
DISCUSSÃO Este estudo teve o objetivo de testar o desempenho de um dispositivo portátil de biópsia vácuo-assistida e encontrou resultados semelhantes aos obtidos com aparelhos não portáteis. Ao se escolher um método de biópsia para uma determinada lesão mamária, o paradigma deve ser o uso do método menos invasivo e mais barato que forneça material suficiente para análise(4). No caso de microcalcificações, a biópsia vácuo-assistida é menos invasiva que uma cirurgia e apresenta taxa de subestimação da lesão menor que a biópsia de fragmento simples (isto é, não vácuo-assistida)(1,5–7). Um problema relacionado à biópsia vácuo-assistida é o seu custo, não somente de implantação e aquisição do dispositivo de biópsia vácuo-assistida, como dos insumos descartáveis. O custo de se realizar biópsias de lesões encontradas em programas de rastreamento pode representar até um terço dos custos do programa(8). O uso racional dos recursos pode proporcionar economia e permitir a aplicação desses recursos em outras situações de saúde, por exemplo, proporcionar o rastreamento a um número maior de mulheres(9). O sistema testado apresenta um custo de implantação consideravelmente menor, embora o custo dos insumos descartáveis seja semelhante aos outros sistemas(10). Não houve dificuldades na reintrodução da cânula para colheitas adicionais. Entre os vários dispositivos para biópsia vácuo-assistida existentes há sistemas que trabalham com introdução única da cânula de colheita e sistemas que trabalham com múltiplas introduções. Nos primeiros, há um compartimento na porção posterior das cânulas para onde o fragmento colhido é automaticamente enviado e que permite a sua remoção sem retirar a sonda da mama da paciente. No dispositivo testado, a sonda deve ser removida da paciente para recuperação do fragmento colhido e reintroduzida para colheita de novo fragmento. Isso trazia a preocupação de que o sistema pudesse causar mais trauma à mama, fazendo novos trajetos, ou diminuir a precisão da colheita, por deslocamento da lesão alvo com as movimentações da sonda, mas isso não foi observado. O tempo médio despendido em cada ciclo de colheitas foi de oito minutos. Parte desse tempo é gasta com as reintroduções da cânula. Essa maior demora na colheita pode potencialmente limitar a precisão do método, no caso de movimentação da paciente. A adequação das amostras sugere que não houve limitação na precisão das colheitas. Vale lembrar que todas as biópsias deste estudo foram feitas em mesa dedicada, na qual a imobilização da paciente tende a ser mais eficiente. Hipoteticamente, quando esse procedimento é realizado com a paciente sentada, há maior chance de movimentação da paciente, pois a retração do seu tronco não é dificultada pela força da gravidade, como ocorre na mesa dedicada. De fato, notamos que, quando fazemos biópsias estereotáxicas com a paciente sentada, não é raro a paciente se movimentar durante o procedimento (o que se constata ao perceber que o orifício de entrada da agulha de biópsia deixa de ficar alinhado com a direção do guia de biópsia). Fica a pergunta: em biópsias realizadas com a paciente sentada, a maior demora em se realizar o ciclo de colheitas com o dispositivo portátil objeto desse estudo poderia interferir com a precisão da amostragem? Uma limitação deste trabalho é que o número baixo de casos não permite comparar a taxa de complicações (entre as quais a principal é a ocorrência de hematomas) com outros métodos de biópsia vácuo-assistida. Uma vez que o dispositivo testado não possui recurso para lavagem e aspiração de hematomas após a colheita das amostras, hipoteticamente ele poderia resultar em um número maior de hematomas. Um estudo avaliou essa questão e observou que, com o dispositivo estudado, houve maior incidência de dor e menor incidência de hematomas precoces e tardios, em comparação a um sistema não portátil de biópsia vácuo-assistida(11). Outra limitação do presente trabalho, também relacionada ao baixo número de casos, é não ter comparado a taxa de subestimação das biópsias com dispositivos não portáteis. Concluindo, o dispositivo portátil de biópsia vácuo-assistida testado obteve amostras adequadas em todos os casos e se apresenta como uma alternativa de menor custo para a realização dessas biópsias. Este é o primeiro teste com o dispositivo em nosso meio e o resultado é compatível com outros estudos da literatura que mostraram seu bom desempenho(12,13).
REFERÊNCIAS 1. Burbank F, Parker SH, Fogarty TJ. Stereotactic breast biopsy: improved tissue harvesting with the Mammotome. Am Surg. 1996;62:738–44. [ ] 2. Liberman L, Gougoutas CA, Zakowski MF, et al. Calcifications highly suggestive of malignancy: comparison of breast biopsy methods. AJR Am J Roentgenol. 2001;177:165–72. [ ] 3. Liberman L, Smolkin JH, Dershaw DD, et al. Calcification retrieval at stereotactic, 11-gauge, directional, vacuum-assisted breast biopsy. Radiology. 1998;208:251–60. [ ] 4. Camargo Jr HSA. Diagnóstico por imagem da mama. Uma abordagem integrada. Rio de Janeiro: Revinter; 2008. [ ] 5. Fahrbach K, Sledge I, Cella C, et al. A comparison of the accuracy of two minimally invasive breast biopsy methods: a systematic literature review and meta-analysis. Arch Gynecol Obstet. 2006;274:63–73. [ ] 6. Hoorntje LE, Peeters PH, Mali WP, et al. Vacuum-assisted breast biopsy: a critical review. Eur J Cancer. 2003;39:1676–83. [ ] 7. Plantade R, Hammou JC, Fighiera M, et al. Underestimation of breast carcinoma with 11-gauge stereotactically guided directional vacuum-assisted biopsy. J Radiol. 2004;85(4 Pt 1):391–401. [ ] 8. Lindfors KK, Rosenquist CJ. The cost-effectiveness of mammographic screening strategies. JAMA. 1995;274:881–4. [ ] 9. Camargo Jr HSA, Camargo MMA. Reflexões sobre os custos dos programas de rastreamento do câncer de mama. Diagn tratamento. 2003;8:193–6. [ ] 10. Pistolese CA, Ciarrapico AM, Della Gatta F, et al. Cost-effectiveness analysis of two vacuum-assisted breast biopsy systems: Mammotome and Vacora. Radiol Med. 2009;114:743–56. [ ] 11. Salem C, Sakr R, Chopier J, et al. Pain and complications of directional vacuum-assisted stereotactic biopsy: comparison of the Mammotome and Vacora techniques. Eur J Radiol. 2009;72: 295–9. [ ] 12. Ghate SV, Rosen EL, Soo MS, et al. MRI-guided vacuum-assisted breast biopsy with a handheld portable biopsy system. AJR Am J Roentgenol. 2006;186:1733–6. [ ] 13. Hauth EA, Jaeger HJ, Lubnau J, et al. MR-guided vacuum-assisted breast biopsy with a handheld biopsy system: clinical experience and results in postinterventional MR mammography after 24 h. Eur Radiol. 2008;18:168–76. [ ]
Recebido para publicação em 20/10/2009
* Trabalho realizado no CDE Diagnóstico por Imagem, Campinas, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554