Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 4 - Jul. / Ago. of 2020
Vol. 53 nº 4 - Jul. / Ago. of 2020
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Vitor Faeda Dalto1,a; Rodrigo Luppino Assad1,b; Mario Müller Lorenzato2,c; Michel Daoud Crema3,d; Paulo Louzada-Junior1,e; Marcello Henrique Nogueira-Barbosa1,f |
|
|
Descritores: Sacroiliite; Articulação sacroilíaca; Ressonância magnética; Espondiloartropatias; Relação sinal/ruído. |
|
|
Resumo: INTRODUÇÃO
O diagnóstico precoce é fundamental para o tratamento das espondiloartrites axiais(1), sendo a ressonância magnética (RM) é o método de imagem recomendado por ser capaz de identificar achados correspondentes à fase de inflamação ativa, antes do aparecimento dos achados radiográficos(1,2). A inflamação ativa pode ser identificada nas imagens de RM, pela presença de sinal de edema ósseo subcondral, visto nas sequências sensíveis a líquido ou pelo realce do tecido ósseo após contraste(2). Anteriormente, o grupo de estudos da Assessment of SpondyloArthritis International Society (ASAS) recomendava preferencialmente sequências short tau inversion recovery (STIR) para identificação do edema ósseo representando a inflamação ativa do tecido subcondral(3). Mais recentemente, o grupo ASAS passou a recomendar para essa finalidade o uso de sequências sensíveis a líquido ponderadas em T2, tais como a sequência STIR ou a sequência T2 com supressão de gordura (T2 fatsat)(4). Recentemente, em 2017, dois grupos diferentes de pesquisadores compararam a sequência STIR com outras sequências sensíveis a líquido no que diz respeito à detecção de inflamação ativa da sacroiliite e não encontraram superioridade da sequência STIR em relação às sequências spectral attenuated inversion recovery (SPAIR) T2 e Dixon, respectivamente(5,6). A relação sinal/ruído (RSR) é um importante parâmetro na avaliação objetiva da qualidade da imagem em RM(7), sendo um dos parâmetros utilizados no programa de acreditação de RM do American College of Radiology (ACR)(8). A RSR corresponde à medida da razão entre o sinal puro proveniente do tecido estudado, que é o sinal que se deseja detectar de fato, em relação ao ruído de fundo. Quanto mais alta for a RSR, menor é o efeito do ruído de fundo sobre a detecção ou medição do sinal. Uma RSR baixa resulta em uma imagem com aspecto granulado e que se sobrepõe ao sinal original, dificultando sua análise. Não encontramos estudos comparando a RSR da sequência STIR com a sequência SPAIR T2 na avaliação das articulações sacroilíacas para a magnitude de campo magnético 1,5 T. Dessa forma, nosso objetivo foi avaliar a RSR na região das sacroilíacas e comparar o desempenho diagnóstico das sequências SPAIR e STIR na avaliação de sacroiliite inflamatória em atividade. MATERIAIS E MÉTODOS O projeto foi aprovado pelo comitê de ética em pesquisa do hospital (CAAE: 30607314.9.0000.5440). Realizamos um estudo retrospectivo transversal, no qual foram incluídos pacientes consecutivos, atendidos em nossa instituição, para realização de RM das articulações sacroilíacas, no período de 2012 a 2014. Foram selecionados pacientes com idade de 18 a 65 anos, com suspeita clínica de espondiloartrite. Ao todo, foram incluídos 69 pacientes, que tiveram suas imagens avaliadas segundo os critérios da ASAS para o diagnóstico de espondiloartrites axiais, sendo realizado o cálculo de sensibilidade e especificidade. As imagens foram anonimizadas e avaliadas no software Horos v2.1.1 (The Horos Project – open source medical viewer) para realização do cálculo do sinal ruído. O cálculo de estimativa amostral indicou que seriam necessários pelo menos 30 exames para realização da avaliação do RSR com poder estatístico adequado. Foram então selecionados 60 pacientes, dos quais 10 tinham field of view sem a presença de espaço aéreo necessário para realização da leitura, sendo excluídos da avaliação. Totalizaram, ao final, 50 pacientes participantes da avaliação de sinal ruído. Todos os exames de RM foram realizados em aparelho de 1.5 T (Achieva; Philips Medical Systems, Best, Holanda), usando bobina de coluna de 17 canais, com os pacientes posicionados em decúbito dorsal. O protocolo para avaliação de sacroiliite utilizado inclui as seguintes sequências: coronal ponderada em T1, coronais STIR e SPAIR T2 e coronal T1 com saturação de gordura pós-contraste (T1 SPIR Gd+). Os parâmetros de aquisição das sequências são apresentados na Tabela 1. No total, foram necessários, em média, 22 a 25 minutos por paciente para a aquisição de todas as imagens. As imagens adquiridas são semelhantes ao ilustrado na Figura 1. 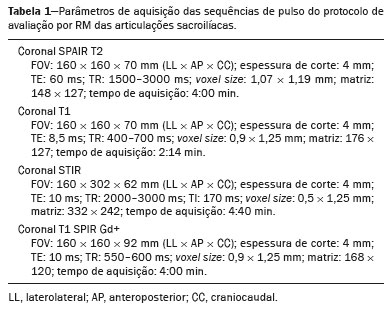  Figura 1. Paciente do sexo masculino, 42 anos, com diagnóstico de espondilite anquilosante. Imagens de RM no plano coronal oblíquo, sequências SPAIR T2 (a), STIR (b), ponderada em T1 sem supressão de gordura (c) e SPIR T1 Gd+ (d). As setas brancas indicam áreas de edema ósseo subcondral em ambas as articulações sacroilíacas envolvendo as porções ilíacas e sacrais. As cabeças de setas brancas indicam realce intra-articular na sequência SPIR T1 Gd+. As setas pretas indicam áreas de erosão na margem ilíaca da sacroilíaca esquerda. O cálculo da RSR foi realizado pelo método recomendado pelo ACR(8). A RSR é obtida fazendo-se a divisão da média de sinal de uma região de interesse (ROI) relativa ao “sinal” (“ROI sinal”) pelo desvio-padrão obtido em outra ROI relativa ao ruído (“ROI ruído”), posicionada no ar (local sem sinal). O método do ACR preconiza a utilização de uma ROI de pelo menos 50 pixels, posicionada no tecido de interesse para mensuração do “sinal”. Como para a avaliação das espondiloartrites o radiologista observa as alterações na medular óssea subcondral, foi optado pelo posicionamento da “ROI sinal” na medular óssea. Como padrão de referência para avaliação medular óssea subcondral, optamos por posicionar a ROI de sinal na região central do sacro. A colocação da ROI de sinal no osso subcondral da articulação sacroilíaca estaria sujeita a variações patológicas (pacientes doentes ou sadios), o que não é o escopo desse estudo, que é focado no sinal/ruído das sequências, independentemente da presença ou não de doença. Para a obtenção do ruído de fundo, o ACR sugere a criação de uma ROI no espaço aéreo externo e ao redor do paciente, em área livre de artefatos. Foi selecionada uma ROI no ar de cada sequência desses 50 pacientes, com no mínimo 300 pixels, sendo coletada do desvio-padrão da ROI pelo software Horos (Figura 2). 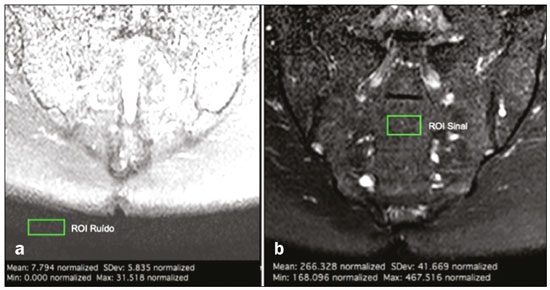 Figura 2. Obtenção dos dados de sinal e de ruído no programa Horos, para a mensuração da RSR. a: Imagem mostrando a coleta do ruído de fundo com ROI posicionada no ar. b: Imagem demonstrando o posicionamento da “ROI sinal” com a coleta da média de sinal da medular óssea. A RSR foi obtida pela divisão da média de sinal da “ROI sinal” pelo desvio-padrão da “ROI ruído”. Foi realizada essa medida para as três sequências de RM (SPAIR, STIR e SPIR T1 Gd+) dos 50 pacientes separadamente e, posteriormente, colocadas em uma tabela para avaliação estatística. Dois radiologistas especialistas em radiologia musculoesquelética – L1 e L2 –, com experiência de 15 anos e 4 anos na avaliação de imagens de RM do sistema musculoesquelético, respectivamente, avaliaram cada sequência e classificaram o exame como positivo ou negativo para sacroiliite, de acordo com os critérios diagnósticos do grupo ASAS(2). São considerados exames positivos para sacroiliite inflamatória, segundo a ASAS, os que apresentam edema ósseo subcondral em duas imagens consecutivas ou em dois sítios diferentes das articulações sacroilíacas. O desempenho diagnóstico foi realizado utilizando os resultados da leitura das imagens da sequência T1 SPIR Gd+ como referência. A leitura da positividade ou não da atividade inflamatória na sequência T1 SPIR Gd+ foi realizada em concordância entre os dois leitores (L1 e L2), com um terceiro radiologista sênior, com experiência 14 anos em interpretação de RM do sistema musculoesquelético, para a decisão final em casos discordantes. Avaliação estatística Para avaliação da RSR, foi realizada a correlação entre as sequências por meio do teste t-pareado, identificando-se as diferenças das RSRs de cada sequência de cada paciente, como variáveis dependentes. Foram realizadas as medidas de sensibilidade e especificidade de cada leitor para as duas sequências e comparadas com o padrão ouro (pós-contraste). Foi utilizado teste de kappa para concordância interobservador. Valor de p < 0,05 foi considerado estatisticamente significante. RESULTADOS A avaliação da qualidade das imagens de RM pela mensuração da RSR mostrou média de RSR de 72,8 para a sequência T1 SPIR Gd+. As sequências SPAIR T2 e STIR tiveram médias da RSR de 37,6 e 14,1, respectivamente. A distribuição dos valores pode ser vista na Figura 3. 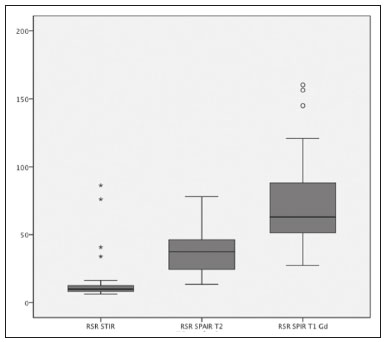 Figura 3. Boxplot representando a distribuição dos valores encontrados para a RSR das sequências STIR, SPAIR T2 e T1 SPIR Gd+. Nota-se um alto valor de sinal para as imagens T1 SPIR Gd+ e uma média de RSR maior para as sequências SPAIR, quando comparadas às sequências STIR. A avaliação comparativa das médias das medidas de RSR entre as sequências, realizadas de forma pareada, paciente por paciente, pelo teste t-pareado, revelou uma diferença de 58,7 (intervalo de confiança 95% [IC 95%]: 68,0–49,4) entre T1 SPIR Gd+ e STIR, com RSR da sequência T1 SPIR Gd+ sendo significativamente maior (p < 0,000). Comparando-se o sinal da sequência SPAIR e T1 SPIR Gd+, encontramos uma diferença das médias de 35,2 (IC 95%: 42,4–28,1), sendo a média da RSR significativamente maior para a sequência T1 SPIR Gd+ (p < 0,000). A diferença da média das RSRs entre as sequências STIR e SPAIR T2 foi de 23,4 (IC 95%: 17,2–29,6), sendo a média da RSR significativamente maior para a sequência SPAIR (p < 0,000). Os resultados do desempenho diagnóstico das sequências SPAIR e STIR são resumidos na Tabela 2. 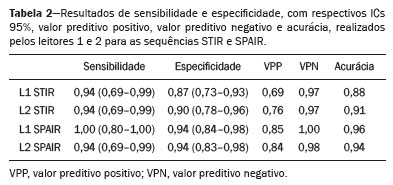 DISCUSSÃO Este estudo identificou diferença estatisticamente significante na RSR entre as sequências STIR e SPAIR, em detrimento da sequência STIR. A sequência com maior RSR foi a sequência SPIR T1, seguida da sequência SPAIR, e por fim, a sequência STIR, que apresentou menor RSR. Quanto ao desempenho diagnóstico, obtido pela avaliação qualitativa, as sequências STIR e SPAIR não apresentaram diferença significativa em relação a sensibilidade, especificidade, acurácia, valor preditivo negativo e valor preditivo positivo quando utilizadas para o diagnóstico da sacroiliite inflamatória em atividade, ao serem aplicados os critérios de diagnóstico do grupo ASAS e utilizando a sequência SPIR T1 após contraste como padrão de referência. Literatura recente registrou que as sequências STIR e SPAIR T2 se mostraram comparáveis pelo escore Spondylo-Arthritis Research Consortium of Canadá (SPARCC)(5,9). Nossos resultados são concordantes, entretanto, utilizamos método diferenciado do estudo de Dalto et al.(5), fazendo a comparação em relação à RSR com método quantitativo e acrescentando a análise qualitativa do desempenho diagnóstico. No referido estudo(5), o desempenho diagnóstico foi calculado com base em uma extrapolação do escore SPARCC, ao passo que no nosso estudo foi calculado diretamente usando os critérios do grupo ASAS para inflamação ativa. O estudo de Dalto et al.(5) também usou a avaliação interobservador entre especialistas em radiologia e reumatologia, enquanto no nosso estudo incluímos apenas observadores radiologistas musculoesqueléticos. Greese et al. realizaram estudo comparando a sequência T2 fat suppression turbo spin eco com a sequência proton density-STIR em aparelho de 3,0 T e encontraram melhor RSR e melhor desempenho na identificação do edema ósseo para a sequência T2 fat suppression, em detrimento da sequência proton density-STIR(10). Nossos resultados são semelhantes aos de Greese et al. quanto à RSR, porém, enquanto esses autores estudaram a RSR das sacroilíacas em imagens de 3,0 T, o nosso estudo fez avaliação em imagens de equipamento de 1,5 T. O estudo de Greese et al.(10) apresentou valores médios das mensurações de RSR semelhantes aos encontrados no nosso estudo. A identificação de artrite nas sacroilíacas é de grande importância para o diagnóstico das espondiloartrites axiais. Diferentes achados podem ser relevantes na avaliação das articulações sacroilíacas, como entesite, sinovite, capsulite e erosões(11). A sequência STIR é um dos possíveis métodos, dentre outros, para supressão de gordura, que possibilita identificar edema ósseo(12,13). Atualmente, estão disponíveis diversas técnicas de saturação de gordura para RM. As diferentes técnicas são baseadas na frequência de precessão na nuvem eletrônica dos prótons de hidrogênio, que é diferente na água e na gordura. Essa diferença possibilita a criação de técnicas baseadas no desvio químico. Para a saturação de gordura, existem no mercado técnicas baseadas no desvio químico (chemical shift selective saturation, excitação de água e técnicas Dixon), técnicas baseadas na inversão (STIR) e técnicas híbridas (SPAIR e SPIR)(14,15). Desde a primeira descrição da sequência STIR por Bydder et al.(16), esta técnica vem sendo amplamente utilizada. STIR é pouco sensível a heterogeneidade de campo e apresenta boa saturação de gordura, mesmo fora da região central do campo magnético. Também apresenta saturação satisfatória de gordura, mesmo na presença de implantes metálicos. Como desvantagem, a sequência STIR apresenta menor RSR. Esta desvantagem poderia ser melhorada com encurtamento do tempo de eco, porém, esta manobra também resulta na redução da ponderação da imagem em T2(14). As sequências hibridas, como SPAIR, combinam um pulso de inversão-recuperação com um pulso de radiofrequência adiabático. As sequências SPAIR são relativamente pouco sensíveis a heterogeneidade de campo e de modo geral tendem a apresentar melhor RSR quando comparadas com as sequências STIR(14). Já a técnica Dixon apresenta baixa sensibilidade a heterogeneidade de campo e ótima RSR, mesmo em áreas de implantes metálicos, sendo mais pronunciadas essas vantagens nas técnicas de “três pontos”(17). A avaliação da qualidade de imagem realizada no presente estudo também confirmou os achados a respeito da maior RSR da sequência SPAIR quando comparada com a sequência STIR. Neste estudo, a sequência SPAIR apresentou média de RSR 2,66 vezes maior que a RSR de STIR, para um mesmo tempo médio de exame. Essa pode ser considerada a maior vantagem da sequência SPAIR e um dos motivos para sua utilização. Mesmo ao utilizar tempos de exame semelhantes, espessura de corte e parâmetros de ponderação T2 parecidos, encontramos uma maior RSR na sequência SPAIR. Esta sequência possui mais opções no que diz respeito a modificações de espessura, ponderação T2, matriz, sem prejudicar substancialmente a qualidade de imagem, já que possui maior RSR(7). Nosso estudo apresenta limitações, podendo-se citar, inicialmente, o fato de ser retrospectivo. Outra limitação é termos utilizado a sequência T1 com supressão de gordura após contraste como padrão de referência para calcular o desempenho diagnóstico das sequências STIR e SPAIR T2. A biópsia do tecido subcondral seria, provavelmente, o padrão de referência ideal, mas esta comparação seria antiética por submeter os pacientes a um procedimento invasivo para fins de validar um conceito de comparação entre sequências de RM. Dessa forma, decidimos utilizar o padrão de referência que tem sido mais usado na literatura na avaliação de inflamação ativa das sacroilíacas(5,18,19). Nossos resultados reforçam a literatura recente, sugerindo que não há superioridade da sequência STIR em relação a outras sequências sensíveis a líquido, para a avaliação do edema ósseo subcondral das sacroilíacas, em pacientes com espondiloartrites(5,6,10). Não identificamos diferença de desempenho diagnóstico de inflamação ativa do tecido ósseo subcondral das sacroilíacas entre as sequências STIR e SPAIR T2. Adicionalmente, nossos resultados indicam a sequência SPAIR com melhor RSR em relação à sequência STIR, em imagens de RM de 1,5 T, o que sugere que a sequência SPAIR T2 possa ser utilizada como boa opção na avaliação da sacroiliite inflamatória, inclusive com alguma vantagem em relação à sequência STIR. REFERÊNCIAS 1. Chary-Valckenaere I, d’Agostino MA, Loeuille D. Role for imaging studies in ankylosing spondylitis. Joint Bone Spine. 2011;78:138–43. 2. Rudwaleit M, Jurik AG, Hermann KGA, et al. Defining active sacroiliitis on magnetic resonance imaging (MRI) for classification of axial spondyloarthritis: a consensual approach by the ASAS/OMERACT MRI group. Ann Rheum Dis. 2009;68:1520–7. 3. Sieper J, Rudwaleit M, Baraliakos X, et al. The Assessment of SpondyloArthritis International Society (ASAS) handbook: a guide to assess spondyloarthritis. Ann Rheum Dis. 2009;68 Suppl 2:ii1–44. 4. Lambert RGW, Bakker PAC, van der Heijde D, et al. Defining active sacroiliitis on MRI for classification of axial spondyloarthritis: update by the ASAS MRI working group. Ann Rheum Dis. 2016;75:1958–63. 5. Dalto VF, Assad RL, Crema MD, et al. MRI assessment of bone marrow oedema in the sacroiliac joints of patients with spondyloarthritis: is the SPAIR T2w technique comparable to STIR? Eur Radiol. 2017;27:3669–76. 6. Özgen A. The value of the T2-weighted multipoint Dixon sequence in MRI of sacroiliac joints for the diagnosis of active and chronic sacroiliitis. AJR Am J Roentgenol. 2017;208:603–8. 7. Goerner FL, Clarke GD. Measuring signal-to-noise ratio in partially parallel imaging MRI. Med Phys. 2011;38:5049–57. 8. American College of Radiology. Magnetic resonance imaging (MRI) quality control manual: 2004. Reston, VA: American College of Radiology; 2004. 9. Boy FN, Kayhan A, Karakas HM, et al. The role of multi-parametric MR imaging in the detection of early inflammatory sacroiliitis according to ASAS criteria. Eur J Radiol. 2014;83:989–96. 10. Greese J, Diekhoff T, Sieper J, et al. Detection of sacroiliitis by short-tau inversion recovery and T2-weighted turbo spin echo sequences: results from the SIMACT study. J Rheumatol. 2019;46:376–83. 11. Castro Jr MR, Mitraud SAV, Francisco MC, et al. Spondyloarthropathy: diagnostic imaging criteria for the detection of sacroiliitis. Radiol Bras. 2017;50:258–62. 12. Navallas M, Ares J, Beltrán B, et al. Sacroiliitis associated with axial spondyloarthropathy: new concepts and latest trends. Radiographics. 2013;33:933–56. 13. Rudwaleit M, van der Heijde D, Landewé R, et al. The development of Assessment of SpondyloArthritis International Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis. 2009;68:777–83. 14. Del Grande F, Santini F, Herzka DA, et al. Fat-suppression techniques for 3-T MR imaging of the musculoskeletal system. Radiographics. 2014;34:217–33. 15. Pezeshk P, Alian A, Chhabra A. Role of chemical shift and Dixon based techniques in musculoskeletal MR imaging. Eur J Radiol. 2017;94:93–100. 16. Bydder GM, Pennock JM, Steiner RE, et al. The short TI inversion recovery sequence—an approach to MR imaging of the abdomen. Magn Reson Imaging. 1985;3:251–4. 17. Yu H, Reeder SB, Shimakawa A, et al. Field map estimation with a region growing scheme for iterative 3-point water-fat decomposition. Magn Reson Med. 2005;54:1032–9. 18. Bozgeyik Z, Ozgocmen S, Kocakoc E. Role of diffusion-weighted MRI in the detection of early active sacroiliitis. AJR Am J Roentgenol. 2008;191:980–6. 19. Madsen KB, Egund N, Jurik AG.. Grading of inflammatory disease activity in the sacroiliac joints with magnetic resonance imaging: comparison between short-tau inversion recovery and gadolinium contrast-enhanced sequences. J Rheumatol. 2010;37:393–400. 1. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Ribeirão Preto, SP, Brasil 2. Radiologia Especializada de Ribeirão Preto, Ribeirão Preto, SP, Brasil 3. Institut National du Sport, de l’Expertise et de la Performance (INSEP), Paris, França a. https://orcid.org/0000-0003-4921-183X b. https://orcid.org/0000-0002-8430-8357 c. https://orcid.org/0000-0003-1551-7734 d. https://orcid.org/0000-0001-8582-0793 e. https://orcid.org/0000-0003-2585-3870 f. https://orcid.org/0000-0002-7436-5315 Correspondência: Dr. Marcello H. Nogueira-Barbosa Departamento de Imagens Médicas, Hematologia e Oncologia Clínica – FMRP-USP Avenida Bandeirantes, 3900, Campus Universitário, Monte Alegre Ribeirão Preto, SP, Brasil, 14048-900 E-mail: marcello@fmrp.usp.br Recebido para publicação em 9/6/2019 Aceito, após revisão, em 24/10/2019 Data de publicação: 15/06/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554