Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 52 nº 3 - Maio / Jun. of 2019
Vol. 52 nº 3 - Maio / Jun. of 2019
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Tiago Kojun Tibana1; Rômulo Florêncio Tristão Santos2; Adalberto Arão Filho3; Bernardo Bacelar4; Leticia de Assis Martins5; Rafael Oliveira de Souza6; Edson Marchiori7; Thiago Franchi Nunes8 |
|
|
Descritores: Segunda neoplasia primária/etiologia; Biópsia por agulha/métodos; Tomografia por emissão de pósitrons/métodos; Tomografia computadorizada/métodos; Fluordesoxiglicose F18. |
|
|
Resumo: INTRODUÇÃO
Múltiplos tumores primários podem ser definidos como mais do que uma lesão, histologicamente diferente, sincrônica ou metacrônica em um mesmo indivíduo(1). São incomuns, porém, a incidência e prevalência vêm aumentando progressivamente, devido em grande parte ao aumento da expectativa de vida da população e aos avanços em técnicas diagnósticas(2). Do ponto de vista diagnóstico, é essencial o reconhecimento e confirmação precoces, para que se alcance o tratamento ideal. Portanto, os radiologistas devem estar familiarizados com os diferentes padrões de apresentação em paciente com múltiplos tumores primários(2). As modalidades convencionais por imagem, incluindo ultrassonografia (US), tomografia computadorizada (TC) e ressonância magnética (RM), têm limitações na detecção de tumores múltiplos, devido aos seus padrões de imagem regionais. Nos últimos anos, a tomografia por emissão de pósitrons com 18F-fluordesoxiglicose (18F-FDG PET/TC) emergiu como uma modalidade de imagem promissora na avaliação de tumores malignos(3). Além disso, estudos indicam que a introdução de imagens de 8F-FDG PET/TC para avaliar tumores malignos resulta em maior detecção de múltiplos tumores primários(4,5). O advento da radiologia intervencionista tornou possível avanços notáveis no diagnóstico e tratamento de diversas situações. Com a contínua evolução nos métodos de imagem e a necessidade de buscar tratamentos cada vez mais eficazes e menos agressivos, vem crescendo na oncologia a representatividade dos procedimentos intervencionistas guiados por imagem(6). O objetivo deste trabalho foi avaliar os achados de imagem da 8F-FDG PET/TC e TC em pacientes portadores de tumores primários adicionais, correlacionando com o método realizado para elucidação do diagnóstico e relatórios anatomopatológicos. MATERIAIS E MÉTODOS De janeiro de 2016 a janeiro de 2018 foram avaliados, retrospectivamente, os exames de imagem de dois serviços de imagem e radiologia intervencionista, sendo um hospital público e uma clínica privada. Os dados clínicos foram obtidos de prontuários médicos e contato telefônico com médicos assistentes, pacientes e familiares. Selecionamos os pacientes que apresentaram tumores primários sincrônicos ou metacrônicos comprovados histologicamente e realizaram TC e/ou PET/TC para fins diagnósticos ou de seguimento. Os critérios de inclusão foram a presença de pelo menos duas neoplasias, confirmadas por exame histopatológico, com histopatologia distinta nos diferentes locais. Usamos o intervalo de seis meses para diferenciar as neoplasias sincrônicas das metacrônicas, critério utilizado por vários autores(7-9). Foram excluídos deste estudo os pacientes sem confirmação diagnóstica e os com suspeita de que a lesão adicional fosse uma metástase da primeira. A amostra final totalizou 11 pacientes (8 do sexo masculino e 3 do sexo feminino). Foram registrados os tumores primários previamente conhecidos e a suspeita do novo sitio primário, bem como suas histologias. Os procedimentos percutâneos guiados por TC são técnicas seguras e já bem estabelecidas. As biópsias direcionadas por estudos funcionais, como a PET/TC, têm sido amplamente estudadas na literatura. Analisamos o procedimento realizado pela radiologia intervencionista em cada caso, para elucidação diagnóstica e desfecho ou tratamento realizado. Os exames foram realizados em aparelhos multidetectores de 128 canais GE Discovery 610 (General Electric; Milwaukee, WI, EUA), com aquisições após jejum de pelo menos seis horas. Os pacientes receberam uma solução intravenosa de 18F-FDG, com atividade entre 3,7 e 5,2 MBq/kg (0,10 a 0,14 mCi/kg). As imagens tomográficas foram adquiridas após 60 a 120 minutos. As técnicas de pós-processamento foram realizadas com reconstruções multiplanares e projeção de intensidade máxima. Um radiologista com sete anos de experiência em diagnóstico por imagem abdominal, um médico nuclear com dez anos de experiência em exames de PET/TC e dois residentes de radiologia analisaram os estudos por imagem, verificando a quantidade e localização das lesões. Foram também analisados registros clínicos, relatórios anatomopatológicos e desfecho. Idade do paciente no momento do diagnóstico de cada tumor, sexo, tumor sincrônico ou metacrônico, local de origem, método de diagnóstico, histologia e regime de tratamento foram registrados. Todos os dados foram tabulados e analisados em programa MS Excel. RESULTADOS A idade dos pacientes variou de 52 a 80 anos. Lesões sugestivas de novos tumores primários foram encontradas em 11 pacientes, sendo em 10 deles uma única nova lesão e em 1 caso dois novos tumores. Os locais comprovados da lesão primária adicional foram pulmão (4 lesões), rim (3 lesões), próstata (2 lesões), jejuno (2 lesões), mama (1 lesão). Em todos os pacientes, a histologia e a imuno-histoquímica mostraram que as novas lesões eram claramente uma malignidade primária diferente, mas não metástases da lesão primária conhecida. Em um paciente com neoplasia de pênis conhecida, a TC mostrou duas novas lesões, sendo um carcinoma renal de células claras e um adenocarcinoma de jejuno (Figura 1). Biópsia percutânea única ou múltipla, guiada por US ou TC, foi realizada em 10 pacientes, e 1 paciente foi submetido somente a procedimento cirúrgico para fins diagnósticos e terapêuticos. Dos 12 novos tumores encontrados, 6 foram sincrônicos e 6 foram metacrônicos. Das malignidades suspeitadas ou já conhecidas, 2 eram hepatocarcinomas, 3 adenocarcinomas pulmonares (Figura 2) - 2 deles com metástases para mediastino, adrenal e hepática (Figura 3) -, 1 timoma, 1 carcinoma renal de células claras com metástase para adrenal ipsilateral, 1 carcinoma espinocelular de pênis, 1 carcinoma ductal invasivo de mama (Figura 4), 1 adenocarcinoma de próstata e 1 carcinoma espinocelular de esôfago (Tabela 1). 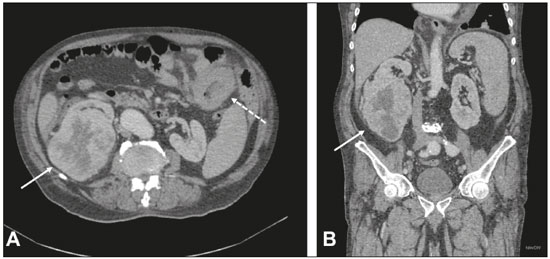 Figura 1. Paciente masculino, 60 anos, em reestadiamento de carcinoma espinocelular de pênis previamente ressecado. TC axial (A) e coronal (B) mostrando múltiplos nódulos pulmonares, massa no rim direito (setas), lesão no jejuno (seta tracejada) e linfonodomegalias inguinais à direita. Biópsia percutânea confirmou adenocarcinoma primário de jejuno com metástases pulmonares e inguinais e carcinoma de células claras do rim direito. 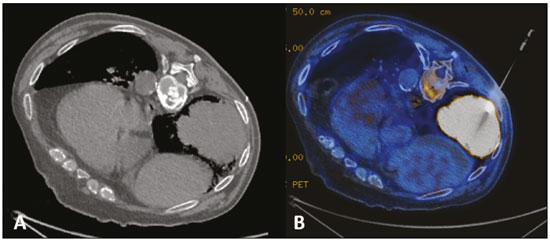 Figura 2. Paciente masculino, 56 anos. A: TC axial mostrando lesão volumosa localizada no lobo inferior do pulmão esquerdo. B: Biópsia guiada por 18F-FDG PET/TC identificou lesão com captação homogênea, sem áreas de necrose, e o anatomopatológico demonstrou tratar-se de adenocarcinoma. 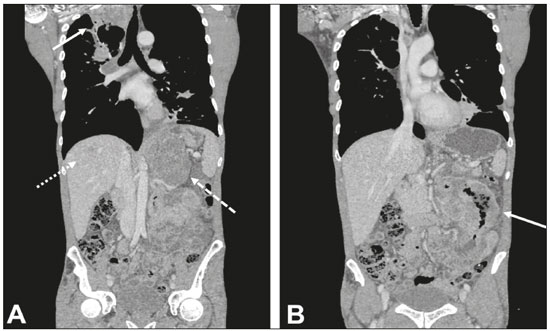 Figura 3. Paciente masculino, 62 anos, com quadro de hemoptise, emagrecimento e dor abdominal. A: TC demonstrando lesão pulmonar escavada (seta), massa adrenal direita (seta tracejada) e nódulo hepático (seta pontilhada). B: Espessamento circunferencial assimétrico do jejuno (seta). Relatório anatomopatológico após biópsia percutânea confirmou tratar-se de adenocarcinoma de jejuno e carcinoma espinocelular pulmonar com metástases adrenal e hepática. 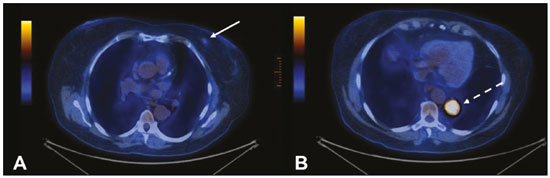 Figura 4. Paciente feminino, 71 anos, em investigação de tosse crônica. A,B: 18F-FDG PET/TC demonstrou alteração focal na mama esquerda (seta em A), confirmada como nódulo espiculado ao ultrassom, e lesão hipercaptante no lobo inferior do pulmão esquerdo (seta tracejada em B). Biópsia percutânea confirmou carcinoma ductal invasivo na mama esquerda e adenocarcinoma primário de pulmão.  O manejo dos casos variou de quimioterapia isolada (3 casos), quimioterapia e ressecção cirúrgica (1 caso), quimioterapia e radioterapia com ressecção cirúrgica (1 caso), hormonioterapia com ressecção cirúrgica (1 caso), ablação de hepatocarcinoma e ressecção cirúrgica (1 caso), transplante associado a quimioterapia e radioterapia (1 caso). Somente um paciente evoluiu para óbito, três meses após o diagnóstico das novas lesões. Dois pacientes foram transferidos a outros centros para acompanhamento e tratamento, dos quais um foi submetido a ressecção cirúrgica antes da transferência (Tabela 1). DISCUSSÃO Múltiplos tumores primários podem ser definidos como mais do que uma lesão sincrônica ou metacrônica em um mesmo indivíduo. Devem ser histologicamente diferentes, envolver órgãos distintos, além de lesões metastáticas deverem ser excluídas. Tumores sincrônicos correspondem a um outro sítio tumoral, diagnosticados com intervalo de até seis meses, em pacientes que já apresentavam uma lesão primária, e metacrônicos quando diagnosticados com intervalo superior a seis meses(1). Pacientes portadores de neoplasias têm risco 20% maior de desenvolver uma nova lesão primária em comparação à população em geral(10). Aproximadamente um terço dos pacientes com idade maior que 60 anos pode ter o diagnóstico de uma outra lesão primária. Os fatores de risco mais comuns incluem hereditariedade, hábitos de vida, fatores hormonais, ambientais e tratamento anterior de neoplasia primária(11). Alguns tipos de neoplasias tendem a se agrupar por conta de fatores de risco compartilhados, como tabagismo nos cânceres do pulmão e cabeça e pescoço, fatores dietéticos ou endócrinos em cânceres ginecológicos, luz ultravioleta em melanoma e câncer de pele e agentes virais em câncer cervical e anogenital. As malignidades primárias adicionais subsequentes também podem estar associadas a tratamento potencialmente cancerígeno da lesão inicial, como quimioterapia, radioterapia ou ambos. Além disso, fatores de risco genéticos, como as mutações BRCA1 ou BRCA2, demonstraram predispor a múltiplas malignidades, como câncer de mama e ovário(12). Condições genéticas podem desencadear as síndromes hereditárias de câncer, que se caracterizam pela maior prevalência de neoplasias em indivíduos de uma mesma família(13) e alto risco de desenvolvimento de tumores em idade precoce, bem como múltiplos primários síncrônicos ou metacrônicos(14). O conhecimento dessas síndromes é importante, uma vez que o diagnóstico inicial de uma neoplasia "chave" pode desencadear a investigação de possível contexto sindrômico e descobrimento de outras lesões. Como exemplo, podemos citar o diagnóstico de hemangioblastoma do sistema nervoso central como início de rastreio para síndrome de von Hippel-Lindau(15), hamartoma pulmonar em contexto da tríade de Carney(16), pacientes jovens com carcinoma medular da tireoide em neoplasias endócrinas múltiplas(17). Em outros tumores mais comuns, como carcinomas endometriais, colorretais e neoplasias sebáceas de pele, pode ser solicitado estudo imuno-histoquímico de lesões para avaliação de instabilidade de microssatélite (DNA mismatch repair) e possível associação com síndrome de Lynch e síndrome de Muir-Torre(18). A detecção de lesões malignas inesperadas tem impacto clínico significativo não apenas em indivíduos saudáveis, mas também em pacientes com doença maligna conhecida. Em pacientes com neoplasias já diagnosticadas, os trabalhos geralmente se concentram na doença primária do paciente, e a coexistência incidental de outra lesão maligna primária pode ser perdida(19). Do ponto de vista diagnóstico, é essencial o reconhecimento e confirmação precoces, para que se alcance o tratamento ideal. Portanto, radiologistas devem estar familiarizados com os diferentes padrões de apresentação em paciente com múltiplos tumores primários(2). A PET com 18F-FDG vem sendo empregada com frequência crescente na avaliação e no gerenciamento clínico de um número cada vez maior de neoplasias(20-23). Alguns relatórios também indicam que a PET com 18F-FDG tem potencial para triagem do câncer e pode detectar novos tumores malignos em uma pequena fração de indivíduos assintomáticos(24,25). A PET/TC combinada é uma modalidade de imagem híbrida promissora que está sendo utilizada de forma mais rotineira em diversas situações clínicas(26-29) e que permite a fusão precisa de imagens PET metabólicas com imagens de TC de alta qualidade, numa aquisição que vai do vértex à raiz das coxas(19). A FDG é um análogo da glicose marcada com o flúor-18, radioisótopo emissor de pósitrons, que permite o estudo do metabolismo da glicose, pela sua maior captação em tecidos com maior atividade glicolítica. Um amplo espectro de alterações bioquímicas está presente nas células tumorais, incluindo maiores taxas de glicólise aeróbia e anaeróbia quando comparadas com as encontradas em tecidos normais. O sítio da absorção de 18F-FDG pode ser determinado precisamente por nessas imagens, explorando as diferenças metabólicas entre células benignas e malignas(19,21,30). Biópsias guiadas por TC têm sido amplamente utilizadas como procedimento efetivo e seguro para confirmação diagnóstica em diversos contextos clínicos. A biópsia guiada por PET/TC, que combina informações anatômicas obtidas da TC e metabólicas obtidas da PET com 18F-FDG, é um procedimento que pode otimizar o rendimento diagnóstico de intervenções guiadas por imagens, uma vez que lesões que apresentem captação de 18F-FDG, mas sem anomalia anatômica correspondente, podem ser acessíveis a intervenções percutâneas(31). Apesar de estudos não demonstrarem diferenças significativas na capacidade de se obter uma amostra de diagnóstico ou nas taxas de complicações entre PET/TC e TC, acreditamos que é um método especialmente importante nos casos em que focos ávidos de 18F-FDG não mostram lesões correspondentes na TC(31). A biópsia percutânea guiada por imagem é uma técnica bem estabelecida e segura e desempenha papel crucial no gerenciamento de pacientes oncológicos. Melhorias nos projetos de agulhas, desenvolvimento de novas técnicas de biópsia e avanços contínuos em tecnologia de orientação de imagem melhoraram a segurança e a eficácia dos procedimentos. As lesões antes consideradas relativamente inacessíveis, agora podem ser acessadas com segurança(32). Algumas das vantagens desses métodos incluem a possibilidade de realização de procedimentos complexos com incisões de pequena extensão, a diminuição da probabilidade de infecções, o rápido restabelecimento do paciente e a redução do tempo de internação, tratando-se de técnicas minimamente invasivas, seguras e altamente eficazes(6). CONCLUSÃO A 18F-FDG PET/TC pode ser utilizada como ferramenta adicional aos métodos de imagem convencionais como a TC(30), e quando associada aos procedimentos minimamente invasivos da radiologia intervencionista, pode ser útil na identificação das malignidades primárias adicionais. O reconhecimento e diagnóstico precoces são essenciais, uma vez que o manejo do paciente é frequentemente alterado se essas informações estão disponíveis. Trabalhos mostram que, embora os falso-positivos possam ocorrer, a prevalência de verdadeiro-positivos é substancial(19). As lesões adicionais frequentemente identificadas estão muitas vezes em fase inicial e, portanto, têm excelente probabilidade de serem curadas se tratadas prontamente e agressivamente(19). As biópsias guiadas por 18F-FDG PET/TC podem ajudar em situações difíceis, especialmente quando é importante saber qual parte do tumor está ativa ou qual lesão está ativa em pacientes com lesões múltiplas e disseminadas(33). REFERÊNCIAS 1. Shah SA, Riaz U, Zahoor I, et al. Carcinoma multiplex. J Coll Physicians Surg Pak. 2013;23:290-2. 2. Testori A, Cioffi U, De Simone M, et al. Multiple primary synchronous malignant tumors. BMC Res Notes. 2015;8:730. 3. Barber TW, Duong CP, Leong T, et al. 18F-FDG PET/CT has a high impact on patient management and provides powerful prognostic stratification in the primary staging of esophageal cancer: a prospective study with mature survival data. J Nucl Med. 2012;53:864-71. 4. Agress H Jr, Cooper BZ. Detection of clinically unexpected malignant and premalignant tumors with whole-body FDG PET: histopathologic comparison. Radiology. 2004;230:417-22. 5. Hiraoka A, Hirooka M, Ochi H, et al. Importance of screening for synchronous malignant neoplasms in patients with hepatocellular carcinoma: impact of FDG PET/CT. Liver Int. 2013;33:1085-91. 6. O'Brien B, van der Putten W. Quantification of risk-benefit in interventional radiology. Radiat Prot Dosimetry. 2008;129:59-62. 7. Suzuki T, Takahashi H, Yao K, et al. Multiple primary malignancies in the head and neck: a clinical review of 121 patients. Acta Otolaryngol Suppl. 2002;(547):88-92. 8. Morris LGT, Sikora AG, Patel SG, et al. Second primary cancers after an index head and neck cancer: subsite-specific trends in the era of human papillomavirus-associated oropharyngeal cancer. J Clin Oncol. 2011;29:739-46. 9. Cheng HY, Chu CH, Chang WH, et al. Clinical analysis of multiple primary malignancies in the digestive system: a hospital-based study. World J Gastroenterol. 2005;11:4215-9. 10. Luciani A, Balducci L. Multiple primary malignancies. Semin Oncol. 2004;31:264-73. 11. Soerjomataram I, Coebergh JW. Epidemiology of multiple primary cancers. Methods Mol Biol. 2009;471:85-105. 12. Wooster R, Weber BL. Breast and ovarian cancer. N Engl J Med. 2003;348: 2339-47. 13. Dantas ELR, Lima Sá FH, Carvalho SMF, et al. Genética do câncer hereditário. Rev Bras Cancerol. 2009;55:263-9. 14. Rahner N, Steinke V. Hereditary cancer syndromes. Dtsch Arztebl Int. 2008;105:706-14. 15. Ortiz-Velázquez RI, Santos-Franco JA, Caldas JGMP, et al. Hemangioblastomas aparentemente esporádicos e doença de von Hippel-Lindau não suspeita. Arq Bras Neurocir. 2008;27:67-73. 16. Fiala L, Kocáková I, Simunek R, et al. Carney triad. Rozhl Chir. 2017;96:267-72. 17. Maia AL, Siqueira DR, Kulcsar MA, et al. Diagnosis, treatment, and follow-up of medullary thyroid carcinoma: recommendations by the Thyroid Department of the Brazilian Society of Endocrinology and Metabolism. Arq Bras Endocrinol Metabol. 2014;58:667-700. 18. Kacerovská D, Kazakov DV, Cerná K, et al. Muir-Torre syndrome-a phenotypic variant of Lynch syndrome. Cesk Patol. 2010;46:86-94. 19. Ishimori T, Patel PV, Wahl RL. Detection of unexpected additional primary malignancies with PET/CT. J Nucl Med. 2005;46:752-7. 20. Coleman RE. PET in lung cancer. J Nucl Med. 1999;40:814-20. 21. Delbeke D. Oncological applications of FDG PET imaging: brain tumors, colorectal cancer, lymphoma and melanoma. J Nucl Med. 1999;40:591-603. 22. Delbeke D. Oncological applications of FDG PET imaging. J Nucl Med. 1999;40:1706-15. 23. Gambhir SS, Czernin J, Schwimmer J, et al. A tabulated summary of the FDG PET literature. J Nucl Med. 2001;42(5 Suppl):1S-93S. 24. Yasuda S, Ide M, Fujii H, et al. Application of positron emission tomography imaging to cancer screening. Br J Cancer. 2000;83:1607-11. 25. Shen YY, Su CT, Chen GJ, et al. The value of 18F-fluorodeoxyglucose positron emission tomography with the additional help of tumor markers in cancer screening. Neoplasma. 2003;50:217-21. 26. Meirelles GSP, Capobianco J, Oliveira MAC. Pitfalls and artifacts in the interpretation of oncologic PET/CT of the chest. Radiol Bras. 2017;50:55-9. 27. Farias LPG, Padilha IG, Lemos MLR, et al. Pulmonary cryptococcosis mimicking neoplasm in terms of uptake PET/CT. Radiol Bras. 2018;51:63-4. 28. Prado Júnior LM, Marino FM, Barra R, et al. One-year experience with 68Ga-PSMA PET/CT: applications and results in biochemical recurrence of prostate cancer. Radiol Bras. 2018;51:151-5. 29. Bitencourt AGV, Andrade WP, Cunha RR, et al. Detection of distant metastases in patients with locally advanced breast cancer: role of 18F-fluorodeoxyglucose positron emission tomography/computed tomography and conventional imaging with computed tomography scans. Radiol Bras. 2017;50:211-5. 30. Soares Junior J, Fonseca RP, Cerci JJ, et al. Recommendations on the use of 18F-FDG PET/CT in Oncology. Consensus between the Brazilian Society of Cancerology and the Brazilian Society of Biology, Nuclear Medicine and Molecular Imaging. Radiol Bras. 2010;43:255-9. 31. Cerci JJ, Tabacchi E, Bogoni M, et al. Comparison of CT and PET/CT for biopsy guidance in oncological patients. Eur J Nucl Med Mol Imaging. 2017;44:1269-74. 32. Gupta S, Madoff DC. Image-guided percutaneous needle biopsy in cancer diagnosis and staging. Tech Vasc Interv Radiol. 2007;10:88-101. 33. Govindarajan MJ, Nagaraj KR, Kallur KG, et al. PET/CT guidance for percutaneous fine needle aspiration cytology/biopsy. Indian J Radiol Imaging. 2009;19:208-9. 1. Hospital Universitário Maria Aparecida Pedrossian da Universidade Federal de Mato Grosso do Sul (HUMAP-UFMS), Campo Grande, MS, Brasil; https://orcid.org/0000-0001-5930-1383 2. Hospital Universitário Maria Aparecida Pedrossian da Universidade Federal de Mato Grosso do Sul (HUMAP-UFMS), Campo Grande, MS, Brasil; https://orcid.org/0000-0002-8679-7369 3. MS Diagnósticos Médicos, Campo Grande, MS, Brasil; https://orcid.org/0000-0002-4799-2700 4. Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil; https://orcid.org/0000-0002-4258-2198 5. MS Diagnósticos Médicos, Campo Grande, MS, Brasil; https://orcid.org/0000-0002-5475-8787 6. Instituto de Tratamento do Câncer (ITC), Campo Grande, MS, Brasil; https://orcid.org/0000-0002-5948-2185 7. Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil; https://orcid.org/0000-0001-8797-7380 8. Hospital Universitário Maria Aparecida Pedrossian da Universidade Federal de Mato Grosso do Sul (HUMAP-UFMS), Campo Grande, MS, Brasil; https://orcid.org/0000-0003-0006-3725 Correspondência: Dr Thiago Franchi Nunes Avenida Senador Filinto Müller, 355, Vila Ipiranga Campo Grande, MS, Brasil, 79080-190 E-mail: thiagofranchinunes@gmail.com Recebido para publicação em 14/February/2018 Aceito, após revisão, em 25/May/2018 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554