Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 49 nº 2 - Mar. / Abr. of 2016
Vol. 49 nº 2 - Mar. / Abr. of 2016
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Tarcísio Passos Ribeiro de Campos1; Carla Flavia de Lima2; Ethel Mizrahy Cuperschmid3 |
|
|
Descritores: Braquiterapia de mama; Balão; Reforço de dose; Radioterapia adjuvante; 99mTc; 192Ir; Método Monte Carlo. |
|
|
Resumo: INTRODUÇÃO
O câncer de mama respondeu por 521.000 óbitos em 2012(1). No Brasil, o câncer de mama teve sua incidência significativamente aumentada na última década, levando ao aumento de óbitos. Esta doença é consequência de fatores genéticos associados a fatores socioambientais e hábitos de vida(2). A causa pode estar associada a agentes carcinogênicos como químicos e radiação ionizante, infecções de parasitas e vírus, e também a mutações genéticas inerentes, alterações hormonais, de metabolismo e condições imunológicas deficientes, que favorecem a carcinogênese(3,4). O tratamento envolve procedimento cirúrgico, radioterapia locorregional, quimioterapia e hormonioterapia para controle sistêmico(5,6). As margens de ressecção cirúrgica são definidas por uma margem abrangente das possíveis infiltrações de células neoplásicas. A cirurgia pode ser conservadora ou não(7). A cirurgia não conservadora envolve a adenomastectomia subcutânea ou mastectomia subcutânea, permitindo a preservação da pele e do complexo aréolo-papilar. A mastectomia simples ou total, por sua vez, também envolve a retirada da mama com pele e complexo aréolopapilar. A cirurgia radical modificada envolve a mastectomia com preservação parcial de músculos peitorais com linfadenectomia axilar, ou radical com retirada completa dos músculos peitorais com linfadenectomia axilar. A cirurgia conservadora implica a exérese do tumor sem margem (tumorectomia) ou com margem (setorectomia ou ressecção segmentar). Os tumores inferiores a 2,0 cm e margens cirúrgicas livres de comprometimento podem ser tratados pela ressecção segmentar seguida de radioterapia complementar. No entanto, para tumores menores do que 4 cm e margens de ressecção livres, a conduta conservadora com radioterapia pode apresentar até 10% de recidiva local(8-10), com dano psicológico e repercussão negativa no prognóstico oncológico. A recidiva local depende do grau de agressividade e diâmetro tumoral e do comprometimento microscópico das margens. Nas cirurgias conservadoras recomenda-se radioterapia complementar e reforço radioterápico, denominado boost, na área tumoral(8,11,12). Após cirurgia conservadora, é proposta a irradiação mamária, independentemente do tipo histológico, da idade, de quimioterapia e/ou hormonioterapia e mesmo com margens cirúrgicas livres de comprometimento neoplásico(7). O reforço da dose na área é indicado a pacientes com menos de 50 anos, com mais de 25% de carcinoma ductal in situ na peça cirúrgica, na presença de margens exíguas inferiores a 1 cm, comprometidas ou não, e em tumores com alta agressividade local(8-10). Com relação aos carcinomas ductais in situ, se a opção for cirurgia conservadora, a radioterapia pósoperatória é necessária(8,10). Terapia conservadora é considerada padrão para estágios iniciais (I e II). Uma meta-análise produzida por um grupo colaborativo de tentativas clínicas de estágios iniciais revelou a necessidade de radioterapia depois de tumorectomia, mostrando que a irradiação reduziu a taxa de recidiva local a 5 anos de 26% para 7% (EBCTCG)(13). A meta-análise também sugeriu que um óbito poderia ser poupado para cada quatro recidivas locais(14-16). A radioterapia tem evoluído no sentido de oferecer menor morbidade e maior eficácia no controle local. Para tal, podese agregar ao arsenal a radioterapia parcial, a intraoperatória, a técnica de balão e a de intensidade modulada. Braquiterapia HDR-192Ir por balão é frequentemente aplicada na radioterapia parcial, realizada pelo dispositivo MammoSite® Radiation Therapy System. O MammoSite é um cateter acoplado a um balão inflável com diâmetro de 4 a 6 cm, com fonte de 192Ir centrada proporcionando, por exemplo, 34 Gy, em duas frações diárias de 3,4 Gy, durante cinco dias consecutivos(17,18). O balão pode ser inserido na cavidade cirúrgica durante ou pós-procedimento conservador. São apresentados dois tamanhos de balões inflados com solução salina em diâmetros de 4-5 cm e 5-6 cm. Atenção deve ser dada à adaptação da cavidade cirúrgica ao balão e à distância deste à superfície da pele, assegurando adequada cobertura, homogeneidade de dose e baixo risco de complicações(18). A técnica de implante intersticial temporário com balão preenchido com 99mTc, provido de geradores de 99Mo/99mTc, foi proposta pelo grupo de pesquisa Núcleo de Radiações Ionizantes (NRI), da Universidade Federal de Minas Gerais. Esta técnica se justifica pela disponibilidade de 99mTc na forma solúvel provida de geradores de 2,0 Ci, por exemplo. A eluição pode gerar 2,0 a 3,0 mL de solução aquosa de pertecnetato de sódio [Na(TcO4)-] com atividade suficiente para tratamento. Além disso, há a possibilidade de aplicações sucessivas fracionadas até atingir as doses preconizadas de referência. Este procedimento pode ser acoplado ao ato cirúrgico conservador e a exposição pode ocorrer no pós-operatório, antes da radioterapia. Os estudos com balão-99mTc se somam às investigações de braquiterapia no NRI utilizando sementes radioativas de 166Ho(19-24). A simulação tridimensional do transporte de partículas nucleares visa a eliminar as deficiências do planejamento bidimensional por método analítico em meio homogêneo, sendo uma importante ferramenta para a melhoria da qualidade dos procedimentos radioterápicos em oncologia(25-27). Métodos computacionais têm sido de elevada relevância para avaliação dosimétrica utilizando modelos heterogêneos(26,27). O Siscodes (sistema computacional para dosimetria por nêutrons e fótons por métodos estocásticos) é uma ferramenta para construção de modelos computacionais e simulação em radioterapia via códigos estocásticos, como o MCNP(27-29). Esse sistema permite a conversão de imagens tomográficas em modelo de voxels. Tendo à sua disposição um banco de dados de composição química de tecidos e de dados nucleares, o Siscodes permite a associação de dados nucleares e químicos aos voxels do modelo, pela seleção do tecido de cada voxel, bem como o posicionamento de fontes de braquiterapia e teleterapia. O sistema usa o MCNP para a simulação do transporte de partículas nucleares no modelo. Os dados dosimétricos são extraídos e apresentados na forma de distribuições espaciais de doses e histogramas dose versus volume(27). A intercomparação dosimétrica é possível em condições similares de exposição. O presente artigo busca, mediante o uso de métodos computacionais, a obtenção de tais condições para que possam ser comparados e analisados dois protocolos: um pré-clínico, ausente de experimentação clínica, com um utilizado na prática clínica, condições estas não reproduzidas em situações clínicas reais. É apresentada a intercomparação dosimétrica de implantes temporários de mama pelo método de braquiterapia de balão HDR-192Ir e de balão com 99mTc, simulados em condições similares, gerando distribuições espaciais de taxa de dose normalizadas pela atividade da fonte e dose acumulada em pontos de referência equivalentes. A hipótese é que ambos os protocolos produzem dosimetria equivalente em condições pré-estabelecidas de atividade e exposição. MATERIAIS E MÉTODOS Protocolo com balão HDR-192Ir Foi simulado um aplicador tipo MammoSite e cateter centrado, localizado no quadrante superior externo da mama. O balão com 4 cm de diâmetro com salina, e um segmento linear cilíndrico metálico de 5 mm de comprimento e 1 mm de diâmetro, de 192Ir centralizado, com direção (1,0,0), foram considerados. Protocolo com balão-99mTc Foi realizada a simulação do implante com balão contendo solução de 99mTc. A fonte foi definida como uma esfera de 1,6 cm de diâmetro, com centros coincidentes dos balões localizados a 3,0 cm da pele. As emissões foram consideradas uniformemente distribuídas por todo o volume do balão. Fontes radioativas As características de emissões nucleares dos nuclídeos 192Ir e 99mTc das energias e percentuais de emissões foram adotadas de acordo com o Evaluated Nuclear Structure Data Files do Medical Internal Radiation Dose(30-32). Simulador Por meio de ressonância magnética (RM) (fase de estudo morfológico), foram selecionadas 23 imagens sequenciais, de 146 cortes com espessura de 4 mm da mama de paciente jovem. As imagens foram digitalizadas e concatenadas para formação de modelo de voxel de graus de cinza. Pelo Siscodes(27-29), foi criado o modelo de voxel da mama discretizado em 2 × 2 × 2 mm3. A identificação de estruturas anatômicas em cada um dos 23 planos selecionados foi elaborada, criando uma estrutura tridimensional de voxels. De cada plano de corte de imagem de graus de cinza, foi criada uma matriz bidimensional que, quando concatenada, formou o modelo tridimensional de voxel. A cada elemento cúbico da matriz foi associado um voxel, volumetricamente equivalente a um tecido identificado por uma cor específica. A densidade e composição química dos tecidos seguiram a ICRU-44(33). Códigos computacionais O Siscodes foi empregado para gerar um arquivo com todas as informações do modelo computacional, em um formato aceito pelo MCNP5 (versão 5.2). Foi avaliada a deposição de energia nos voxels, em MeV.g-1 por transição (t). Foi feita a transformação de unidades de deposição de energia (MeV.g-1.t-1) em taxa de dose absorvida por atividade presente no balão (99mTc) ou do segmento de fonte (192Ir) (cGy.h-1.mCi-1), por meio do fator de conversão de 2133,86. Após simulações, os resultados foram incorporados ao Siscodes e geradas as distribuições espaciais de dose. A atividade inicial das sementes foi calculada para gerar a dose preconizada no leito tumoral. Incertezas As incertezas computacionais foram analisadas para cada voxel pelo MCNP5, mantidas dependentes do número de partículas executadas. As incertezas foram inferiores a 5% no tecido mamário e reduzidas nos voxels mais próximos da fonte emissora. RESULTADOS O modelo foi produzido mediante 23 cortes de RM da glândula mamária. Uma matriz de 21 × 60 × 23 elementos, totalizando 28.980 elementos cúbicos ou voxels, foi gerada. O modelo de voxel de tecidos permitiu a confecção de uma estrutura tridimensional da mama. A composição química dos tecidos está reproduzida na Tabela 1. 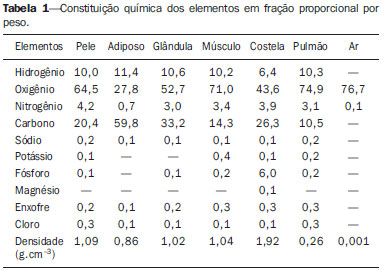 Nas Figuras 1 e 2 estão representados os resultados das simulações dos protocolos de implantes temporários com balão intersticial com 99mTc e com segmento de 192Ir, reproduzindo o booster de braquiterapia por balão. 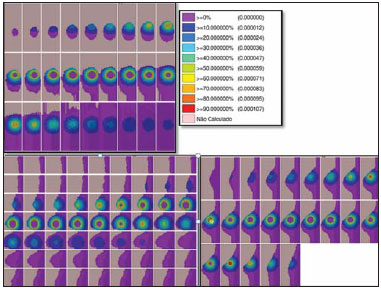 Figura 1. Distribuição espacial de taxa de dose normalizada em função da atividade, apresentada em seções laterais, sagitais e axiais, induzidas por técnica de braquiterapia por balão de 192Ir. 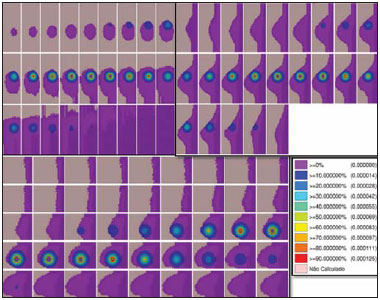 Figura 2. Distribuição espacial de taxa de dose normalizada em função da atividade, apresentada em seções laterais, sagitais e axiais, induzidas por balão considerando fonte distribuída homogênea de 99mTc. Implante temporário de balão HDR-192Ir A Figura 1 ilustra a distribuição espacial de dose normalizada em função da atividade total do 192Ir. São apresentadas seções laterais, sagitais e axiais concatenadas que tiveram doses superiores a 10%. A dose foi induzida pela fonte discreta de 192Ir, inserida no balão intracavitário. Nas condições da simulação impostas, a máxima taxa de dose normalizada pela atividade injetada atingiu 0,499 cGy.h-1.mCi-1. De acordo com a distribuição de doses da Figura 1, pode-se predizer a dose afastada da superfície do balão. Implante temporário de balão-99mTc A Figura 2 ilustra a distribuição espacial de dose normalizada em função da atividade total presente em balão de 99mTc. São apresentadas as seções laterais, sagitais e axiais que tiveram valores de dose superiores a 10%. A dose foi induzida por uma fonte distribuída, homogênea, da solução aquosa de Na(TcO4)-. O balão foi simulado com diâmetro de 16 mm. Neste caso, a máxima taxa de dose normalizada pela atividade injetada foi 0,428 cGy.h-1.mCi-1. A Tabela 2 apresenta os valores dosimétricos para as simulações dos dois protocolos. A taxa de dose máxima (TDM) foi multiplicada pelo fator percentual de dose (FD) referente ao ponto de referência (PR), isto é, a 8-10 mm de distância da superfície do balão; posteriormente, pela atividade total da fonte e pelo fator de acumulação (FA) de tempo de exposição (T), produzindo assim a dose acumulada em PR. Definindo-se o número de frações (FR), obteve-se, então, a dose acumulada do protocolo em PR. Para o balão-99mTc foram considerados 1 Ci de Na(TcO4)- e PR a 8-10 mm de distância da superfície do balão, presente na faixa de 25% da TDM. Para T de 24 h, o FA foi 0,812. Por sua vez, foram considerados 10 Ci de 192Ir, no mesmo PR, e dessa maneira o FD foi 30% da TDM para o balão HDR-192Ir. Um T de 0,4 h produziu FA de 0,4. Nestas condições, as doses acumuladas em PR foram 10,14 Gy para os protocolos por balão-99mTc e 5,14 Gy para fração única de balão HDR-192Ir, que em duas seções produzirá equivalente dose de 10,28 Gy. DISCUSSÃO Foi demonstrado que um boost de 10 Gy efetivos, complementar a teleterapia, pode ser produzido em ambos os protocolos, nas posições tomadas como referência. Não houve diferenças estatísticas entre as doses acumuladas para os balões de 99mTc e 192Ir, considerando a variação de 5% assumida na simulação. Neste caso, balões de 99mTc e 192Ir, nas condições preconizadas de atividade e exposição, produzem doses absorvidas equivalentes, nas condições propostas. A intercomparação dosimétrica entre as técnicas diferencia-se pela distribuição espacial da fonte e pelo diâmetro dos balões. A presente condição simulada se refere a tumores clínicos em estadiamento inicial, localizados in situ, ressectados. Assim, o volume parcial do tumor ressectado é preenchido pelo balão, podendo este ser inflado, ocupando a cavidade e expandindo o tecido adjacente. A dose no leito do tumor, neste caso, foi representada pela dose nos voxels da periferia do balão. O implante de balão-99mTc pode ser recomendado para tumores em estadiamento T1 e T2 com margem de 1 cm, em cavidade usual pós-lumpectomia(7-12). A atenuação da radiação em função da distância radial é superior para 99mTc do que para 192Ir, por este ter emissões de baixas energias comparadas com 192Ir(30,32). Consequentemente, o perfil de dose radial se tornará mais restrito junto à cavidade tumoral, como observado na Figura 2 (99mTc), em comparação com a Figura 1 (192Ir). Desta forma, é de se esperar que pulmão e coração recebam menor dose com balão-99mTc do que com 192Ir, produzindo menores efeitos deletérios nestes órgãos sadios. Junto ao leito tumoral, a distribuição espacial de dose em balão HDR-192Ir revela uma máxima taxa de dose por unidade de atividade equivalente à braquiterapia intersticial com balão-Tc99m. As máximas taxas de dose por unidade de atividade são equiparáveis, entretanto, como o HDR mantém a atividade de 192Ir 3,5 a 5 vezes maior que a de 99mTc, a taxa de dose crescerá na mesma proporção. Assim, a 8 mm do balão, a taxa de dose para 1,0 Ci de 99mTc será de 1,07 Gy.h-1, atingindo 0,13 Gy.h-1 em 18 horas, enquanto para a fonte de 10,0 Ci 192Ir esta se manterá praticamente constante no período de 25 minutos, igual a 12,83 Gy.h-1, isto é, 12 vezes superior à taxa de dose inicial do 99mTc. Entretanto, a menor taxa poderá reduzir os efeitos deletérios em tecidos sadios, pela possibilidade de proporcionar melhor o reparo dos danos subletais inerente das células normais. Geradores de 99Mo/99mTc são distribuídos usualmente com 2,0 Ci. Desta forma, pode-se considerar que a técnica de implante de balão-99mTc pode ser estabelecida de forma imediata sem custos adicionais, mantendo o suporte de centros de medicina nuclear. Os procedimentos de segurança radiológica necessários para uso de fontes de alta atividade 192Ir, isto é, 7-10 Ci, com meia-vida de 73,8 dias, devem ser maiores do que para geradores de 99mTc. Pode-se então esperar maior complexidade na gerência de 192Ir, considerando a necessidade de aquisição, transporte e substituição da fonte radioativa cilíndrica de três em três meses, nos centros que oferecem a braquiterapia HDR, principalmente pela necessidade de importação e emprego de equipes especializadas na troca das fontes nos aparelhos de pós-carregamento. Um usual protocolo de radioterapia convencional envolve a aplicação de 25 seções de 1,8 a 2,0 Gy diários, com dois campos paralelos opostos de 6 MV, por exemplo, 5 dias por semana, por um mês e meio a dois meses, com doses acumuladas de 50 Gy cobrindo o tecido glandular mamário(5). Em caso de reforço, na braquiterapia HDR-192Ir, a exposição pode se resumir a seções de 20 a 25 minutos, enquanto para o balão-99mTc a exposição deve atingir 24 horas. O desconforto para a paciente será maior quanto maior o tempo de exposição. Uma dose de reforço de 10 Gy no leito do tumor pela técnica de balão-99mTc requer 24 horas de exposição, sendo plausível o desconforto que possa gerar. Entretanto, a técnica poderá ser aplicada pós-cirurgia em uma única fração, em que o balão pode ser implantado logo após a excisão local e a exposição ocorra no período de repouso. Caso a atividade injetada seja duplicada, o tempo de exposição será reduzido pela metade, ou mesmo um protocolo multifracionado pode ser implementado com exposições de 4-6 horas-dia, 3 a 4 dias, em que o líquido radioativo pode ser substituído por água nos períodos entre exposições e a solução radioativa injetada com atividade constante a cada aplicação. A dose prescrita no leito do tumor deve ser definida previamente, para que a atividade e a exposição sejam estabelecidas. A braquiterapia com balão HDR-192Ir já se revelou ser um método seguro e eficaz, em estudos bem estabelecidos na Europa e nos Estados Unidos, com longo tempo de seguimento, com baixas taxas de recorrência local(13-17). Entretanto, a aplicação é limitada em razão da complexidade do procedimento HDR-192Ir, de meia-vida de 73,8 dias. Além disso, há contraindicações: uma distância insuficiente entre tumor e pele e uma cavidade extensa são duas situações clínicas que podem interferir no planejamento dosimétrico(34). Este é contraindicado quando a cavidade do tumor está em uma área de tecido insuficiente para ser coberta(35). Condições cirúrgicas anatômicas não desejadas e condições histológicas não elegíveis também podem desqualificar a aplicação da técnica de balão(17). Com um balão de menor diâmetro e um nuclídeo que proporciona maior atenuação de dose em função radial, situações clínicas inelegíveis por anatomia inapropriada ou comprometidas em cirurgias que apresentem reduzida massa tecidual de encobrimento podem se tornar menos relevantes. Em geral, a técnica balão-Tc99m é acessível, de menor período para curva de aprendizado, de dosimetria de menor complexidade, de alta disponibilidade, considerando os geradores 99Mo/99mTc nos centros de medicina nuclear no País. CONCLUSÃO Implantes temporários com balão-99mTc podem se tornar atrativos na radioterapia adjuvante do câncer de mama. Esta técnica fornece adequada dose de reforço, distribuição espacial de dose contida no entorno do leito do tumor, e se justifica pela disponibilidade e viabilidade econômica. Agradecimentos Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq-REBRAT/SUS), à Fundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig) e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), pela concessão de bolsas de mestrado e doutorado e apoio financeiro às pesquisas no grupo NRI/UFMG. REFERÊNCIAS 1. IARC. Estimated cancer incidence, mortality and prevalence worldwide in 2012. International Agency for Research on Cancer, World Health Organization. [cited 2014 June 12]. Available from: globocan.iarc.fr. 2. Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Estatísticas do câncer: vigilância do câncer e fatores de risco. [cited 2014 June 12]. Available from: http://www.inca.gov.br. 3. GodinhoI ER, Koch HA. Rastreamento do câncer de mama: aspectos relacionados ao médico. Radiol Bras. 2004;37:91-9. 4. Roychoudhuri R, Evans H, Robinson D, et al. Radiation-induced malignancies following radiotherapy for breast cancer. Br J Cancer. 2004;91:868-72. 5. Purdy JA. Three dimensional physics and treatment planning. In: Perez CA, Brady LW, editors. Principles and practice of radiation oncology. 3rd ed. Philadelphia, PA: Lippincott-Raven; 1998. p. 343-70. 6. Emami B, Graham MV, Michalski JM, et al. Three dimensional conformal radiation therapy: clinical aspects. In: Perez CA, Brady LW, editors. Principles and practice of radiation oncology. 3rd ed. Philadelphia, PA: Lippincott-Raven; 1998. p. 371-86. 7. Tiezzi DG. Cirurgia conservadora no câncer de mama. Rev Bras Ginecol Obstet. 2007;29:428-34. 8. Fisher B, Costantino J, Redmond C, et al. Lumpectomy compared with lumpectomy and radiation therapy for the treatment of intraductal breast cancer. N Engl J Med. 1993;328:1581-6. 9. Glinski B, Zabek M, Mitus M. Brachytherapy boost in women with early stage breast cancer treated with breast conserving therapy. Rep Pract Oncol Radiother. 2007;12:47-51. 10. Barroso ACSD, Barbosa EM, Gebrim LH, et al. Diagnóstico e tratamento do câncer de mama. In: Projeto Diretrizes. Brasília, DF: Associação Médica Brasileira, Conselho Federal de Medicina; 2001. [cited 2014 June 12]. Available from: www.projetodiretrizes.org.br/projeto_diretrizes/024.pdf. 11. Schwartz GF, Solin LJ, Olivotto IA, et al. The consensus conference on the treatment of in situ ductal carcinoma of the breast. Breast J. 2000;6:4-13. 12. Veronesi U, Salvadori B, Luini A, et al. Breast conservation is a safe method in patients with small cancer of the breast. Long-term results three randomized trials on 1973 patients. Eur J Cancer. 1995;31A:1567-9. 13. EBCTCG (Early Breast Cancer Trialists' Collaborative Group), McGale P, Taylor C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8135 women in 22 randomised trials. Lancet. 2014;383:2127-35. 14. Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trial. Lancet. 2005;366:2087-106. 15. Early Breast Cancer Trialists' Collaborative Group (EBCTCG), Darby S, McGale P, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet. 2011;378:1707-16. 16. Early Breast Cancer Trialists' Collaborative Group (EBCTCG). EBCTCG Secretariat. Clinical Trial Service Unit (CTSU). Richard Doll Building. Oxford OX3 7LF. UK. 2014. 17. Dickler A, Kirk MC, Chu J, et al. The MammoSite breast brachytherapy applicator: a review of technique and outcomes. Brachytherapy. 2005;4:130-6. 18. Douglas A. Accelerated partial breast irradiation: a change in treatment paradigm for early stage breast cancer. J Surg Oncol. 2003;84:185-91. 19. Valente ES, Campos TPR. Gamma spectrometry and chemical characterization of ceramic seeds with samarium-153 and holmium-166 for brachytherapy proposal. Appl Radiat Isot. 2010;68:2157-62. 20. Valente ES, Cuperschmid EM, Campos TPR. Evaluation of HeLa cell lineage response to beta radiation from holmium-166 embedded in ceramic seeds. Braz Arch Biol Technol. 2011;54:957-64. 21. Nogueira LB, Campos TPR. Nuclear characterization and investigation of radioactive bioglass seed surfaces for brachytherapy via scanning electron microscopy. J Sol-Gel Sci Technol. 2011;58:251-8. 22. Nogueira LB, Campos TPR. Radiological response of ceramics and polymeric devices for breast brachytherapy. Int J Appl Radiat Isot. 2012;70:663-9. 23. Nogueira LB, Silva HLL, Campos TPR. Experimental dosimetry in conformal breast teletherapy compared with the planning system. Appl Radiat Isot. 2015;97:93-100. 24. Campos TPR, Andrade JPL, Costa IT, et al. A radioactive seed implant on a rabbit's liver following a voxel model representation for dosimetric proposals. In: 2005 International Atlantic Conference - INAC 2005. Santos, SP; 2005. 25. MCNP5. Monte Carlo Team. MCNP - A General Monte Carlo N-Particle Transport Code, Version 5. Volume I: Overview and theory. Los Alamos: Los Alamos National Laboratory; 2003. 26. Kalos MH, Whitlock PA. Monte Carlo methods. Vol. I: basics. New York: Wiley; 1986. 27. Campos TPR. Computational simulations in medical radiation: a new approach to improve therapy. [cited 2016 Jan 15]. Available from: http://www.sbmac.org.br/bol/boletim_2002/campos-4emc.pdf. 28. Trindade BM, Campos TPR. Stochastic method-based computational system for neutron/photon dosimetry applied to radiotherapy and radiology. Radiol Bras. 2011;44:109-16. 29. Trindade BM, Christóvão MT, Trindade DFM, et al. Comparative dosimetry of prostate brachytherapy with I-125 and Pd-103 seeds via SISCODES/MCNP. Radiol Bras. 2012;45:267-72. 30. International Atomic Energy Agency. Nuclear Data Services. Medical Application and Nuclear Data Section - MIRD. [cited 2015 Jan 15]. Available from: http://www.nndc.bnl.gov/mird/. 31. ENDF/BVI Decay Data. Evaluated Nuclear Data File (ENDF) ENDF/B-VII.1 Nuclear Data for Science and Technology: Cross Sections, Covariances, Fission Product Yields and Decay Data, released December 22, 2011. [cited 2013 Nov 15]. Available from: http://t2.lanl.gov/data/decayd.html. 32. Korea Atomic Energy Research Institute. Electron and photon attenuation. [cited 2012 Nov 19]. Available from: http://atom.kaeri.re.kr:8080/ex.html. 33. International Commission on Radiation Units and Measurements. ICRU Report 44. Tissue substitutes in radiation dosimetry and measurement. Bethesda, MD: ICRU; 1989. 34. Tuschy B, Berlit S, Romero S, et al. Clinical aspects of intraoperative radiotherapy in early breast cancer: short-term complications after IORT in women treated with low energy x-rays. Radiat Oncol. 2013;8:95. 35. Ravi A, Lee S, Karsif K, et al. MammoSite multilumen catheter: dosimetry considerations. J Cancer Res Ther. 2011;7:64-8. 1. Pós-Doutor, Professor do Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 2. Médica Nuclear, Doutoranda do Programa de Pós-Graduação em Ciências e Técnicas Nucleares, Núcleo de Radiações Ionizantes (NRI) da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 3. Doutora, Centro de Memória da Medicina, Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil Endereço para correspondência: Dr. Tarcísio Passos Ribeiro de Campos Departamento de Engenharia Nuclear, Universidade Federal de Minas Gerais Avenida Antônio Carlos, 6627, Campus UFMG, PCA 1 - Anexo Engenharia Belo Horizonte, MG, Brasil, 31270-910 E-mail: tprcampos@pq.cnpq.br Recebido para publicação em 27/1/2015. Aceito, após revisão, em 26/5/2015. Trabalho realizado no Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554
