Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 3 - Maio / Jun. of 2014
Vol. 47 nº 3 - Maio / Jun. of 2014
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Elen Freitas de Cerqueira Cunha1; Manoel de Souza Rocha2; Fábio Payão Pereira3; Roberto Blasbalg4; Ronaldo Hueb Baroni4 |
|
|
Descritores: Pancreatite; Pseudocisto; Necrose pancreática delimitada. |
|
|
Resumo: INTRODUÇÃO
A pancreatite aguda é uma condição inflamatória causada por ativação intracelular e extravasamento inapropriado de enzimas proteolíticas que provocam destruição do parênquima pancreático e dos tecidos peripancreáticos. Litíase biliar e alcoolismo são os fatores etiológicos mais comuns e respondem por cerca de 80% dos casos em adultos. Causas menos comuns incluem hipertrigliceridemia, hipercalcemia, drogas, doenças autoimunes, parasitoses, dentre outras(1). Relativamente comum, a pancreatite aguda é uma das condições mais frequentes para indicação de exames por imagem no ambiente de emergência. No Brasil, de acordo com o Datasus, no período de julho de 2010 a julho de 2011 houve 25.660 internações, com um gasto anual de R$ 17.493.378,92 e mortalidade de 5,9%(2). A maioria dos pacientes com pancreatite aguda tem uma forma leve da doença, que é autolimitada e tem boa evolução com tratamento conservador. Entretanto, cerca de 20-30% dos casos evoluem para formas graves, com significativa morbimortalidade(1). O objetivo deste trabalho é descrever os conceitos radiológicos atuais na avaliação por imagem da pancreatite aguda, com ênfase na definição da condição atualmente reconhecida como "necrose pancreática delimitada", com a finalidade de uniformizar a linguagem entre os especialistas envolvidos no diagnóstico e tratamento desses pacientes. NOVOS CONCEITOS NA CLASSIFICAÇÃO DA PANCREATITE AGUDA A classificação de Atlanta para pancreatite aguda foi proposta em 1992(3) e consistiu em uma tentativa de padronizar a classificação da gravidade da pancreatite aguda e de suas complicações. Teve importante papel neste contexto, mas ao longo do tempo tornou-se evidente a necessidade de uma revisão que contemplasse os progressos no entendimento da doença, incluindo a conceituação dos acúmulos líquidos complexos que podem se desenvolver a partir do processo de necrose pancreática(4-8). Recentemente, o Acute Pancreatitis Classification Working Group (APCWG) revisou esta classificação(9) e estabeleceu novos conceitos relativos ao diagnóstico, fases de evolução da doença, e à luz desta nova abordagem redefiniu a classificação radiológica, introduzindo novos conceitos referentes às complicações locais da pancreatite aguda. Diagnóstico De acordo com o APCWG, a atual definição do diagnóstico de pancreatite aguda requer dois de três critérios seguintes(9): dor abdominal fortemente sugestiva de pancreatite aguda; elevação dos níveis séricos de amilase em pelo menos três vezes o valor normal; achados característicos nos exames de imagem. Evolução temporal Com relação à evolução temporal, consideram-se atualmente duas fases no curso da pancreatite aguda(9): uma fase precoce, durante a qual a gravidade da doença está relacionada à resposta inflamatória sistêmica e à falência orgânica, e uma fase tardia, período em que a doença pode evoluir para resolução (pancreatite intersticial edematosa), estabilização ou apresentar uma evolução prolongada, relacionada ao processo de necrose (pancreatite necrosante). Definição de gravidade e tratamento A importância da definição da gravidade da pancreatite aguda está diretamente relacionada à instituição da conduta terapêutica. Os pacientes com pancreatite aguda leve respondem bem ao tratamento conservador, enquanto os pacientes com pancreatite necrosante apresentam disfunção orgânica, necessitam de tratamento intensivo e frequentemente demandam intervenções terapêuticas, tendo um prognóstico mais reservado(1,10). Na primeira fase da pancreatite aguda, a avaliação da gravidade é definida sobretudo por critérios clinicolaboratoriais. Na segunda fase da pancreatite aguda, a necessidade de tratamento é baseada na evolução clínica e o tipo de tratamento é definido pelas alterações morfológicas identificadas nos exames de imagem. Dessa forma, essa revisão enfatiza o uso dos critérios de tomografia computadorizada (TC) contrastada para definição da conduta terapêutica na segunda fase da doença, já que as alterações morfológicas podem guiar o tratamento. A TC é considerada padrão ouro na avaliação por imagem da pancreatite aguda, por ser o método, além de eficaz, mais rápido e disponível(7,9,11,12). A ressonância magnética (RM) tem valores diagnóstico e prognóstico comparáveis aos da TC(13), mas apresenta algumas desvantagens no cenário clínico. Os exames são comparativamente mais longos, necessitam de maior colaboração do paciente (imobilidade por longo período e apneia) e tem custo mais elevado. No entanto, a RM é superior à TC na caracterização dos acúmulos líquidos pancreáticos/peripancreáticos e é uma alternativa à TC, em casos de contraindicação ao uso de meio de contraste iodado, além de não utilizar radiação ionizante(14-16). Ainda, a sequência de colangiopancreatografia por RM tem alta sensibilidade para detecção de coledocolitíase, ajudando na seleção de pacientes que possam necessitar de colangiopancreatografia endoscópica(10,17). A ultrassonografia tem importante papel na avaliação do trato biliar, mas frequentemente é limitada na visualização do colédoco distal (por causa do gás intestinal) e na avaliação pancreática. AVALIAÇÃO DA PANCREATITE AGUDA POR IMAGEM Protocolo da TC A TC deve ser realizada em 48-72 horas após o início do quadro clínico, já que a necrose, em geral, se estabelece em 24-48 horas(18). A avaliação por imagem é recomendada para confirmar o diagnóstico clínico, determinar a etiologia, excluir outras causas de dor associadas à elevação de amilase/lipase e determinar a gravidade e a extensão da pancreatite aguda. A avaliação por imagem é necessária nos casos graves ou duvidosos, podendo ser dispensada nos casos leves com apresentação clínica clássica(19,20). O protocolo utilizado no setor de TC do Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo inclui a realização do exame em aparelho com múltiplos detectores (64 canais) e administração de água por via oral (600 ml) e meio de contraste iodado venoso não iônico (1,5 ml/kg), com aquisições pré e pós-contraste nas fases arterial parenquimatosa (40 segundos do início da administração do meio de contraste) e venosa (70 segundos do início da administração do meio de contraste), com velocidade de injeção de 4 ml/s e reconstruções de 2,5 mm. Os protocolos dos exames de controle são individualizados de acordo com a evolução clínica. Pancreatite aguda intersticial edematosa (Figuras 1 e 2) 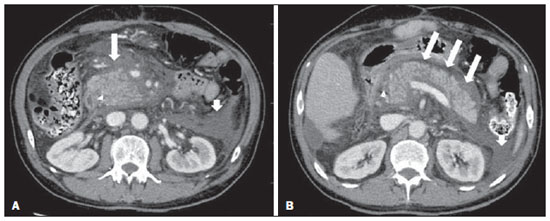 Figura 1. Pancreatite aguda edematosa. A,B: Imagens axiais de TC pós-contraste fase venosa mostram aumento pancreático difuso, densificação dos planos adiposos peripancreáticos (setas longas) e acúmulos líquidos agudos no espaço pararrenal anterior esquerdo e na goteira paracólica esquerda (setas curtas), sem áreas de necrose parenquimatosa. 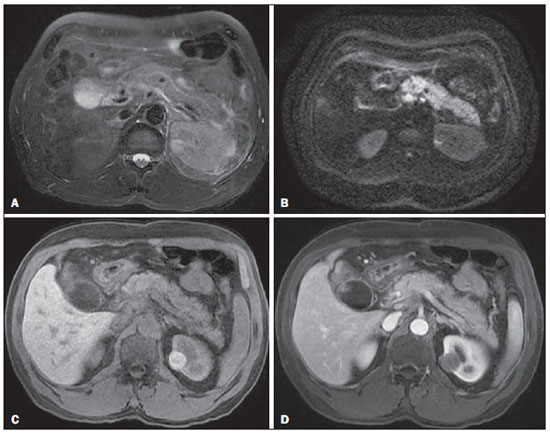 Figura 2. RM na pancreatite aguda edematosa. A: Imagem axial de RM fast-spin echo ponderada em T2 com supressão de gordura mostra aumento pancreático difuso com elevação do sinal em T2, perda do padrão glandular habitual e líquido peripancreático. B: Imagem axial de RM ecoplanar ponderada em difusão mostra restrição à difusão das moléculas de água difusamente em todo o parênquima pancreático. C,D: Imagens axiais de RM gradiente eco ponderada em T1 com supressão de gordura pré-contraste (C) e pós-contraste (D) mostram discreto hipossinal T1 do parênquima pancreático e realce preservado, sem áreas de necrose. A TC pode ser completamente normal ou evidenciar aumento pancreático difuso ou localizado, com perda do padrão glandular habitual, mas com realce normal do parênquima. Frequentemente, os tecidos peripancreáticos/retroperitoneais mostram alterações inflamatórias discretas caracterizadas por densificação de gordura e quantidades variáveis de líquido peripancreático. A pancreatite intersticial edematosa responde por 80% dos casos de pancreatite aguda(1,10). A realização da TC em uma fase precoce pode demonstrar heterogeneidade do parênquima pancreático, que não pode ser definitivamente classificada em pancreatite edematosa ou necrosante. Nesse contexto, deve-se classificar o caso como indeterminado e a realização de um exame de controle em 5-7 dias pode definir a classificação do caso(5,9,11,12,21). Pancreatite aguda necrosante (Figuras 3 e 4) 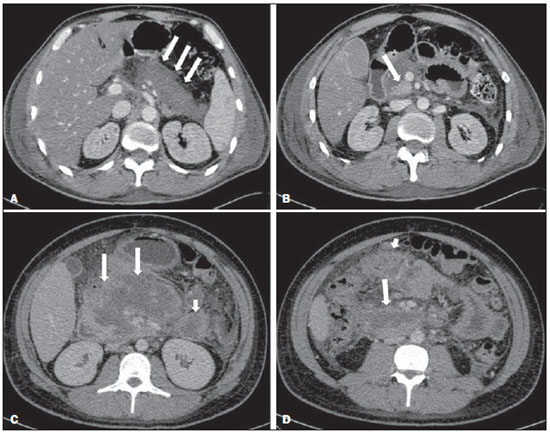 Figura 3. Pancreatite aguda necrosante. A,B: Imagens axiais de TC pós-contraste fase venosa. Pancreatite aguda necrosante em homem de 52 anos. Hipocontrastação difusa do colo, corpo e cauda pancreáticos (setas em A), compatível com extensa área de necrose, identificando-se pequena área de parênquima preservado no processo uncinado (seta em B). C,D: Imagens axiais de TC pós-contraste fase venosa. Pancreatite aguda necrosante em mulher de 35 anos. Extensas áreas de necrose parenquimatosa pancreática (setas longas), associadas a áreas de esteatonecrose no espaço pararrenal anterior esquerdo e no mesocólon transverso (setas curtas). 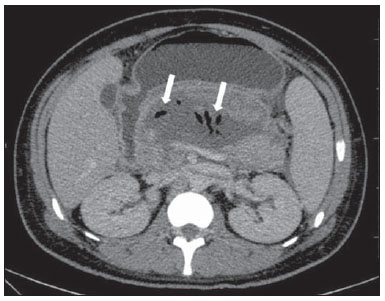 Figura 4. Pancreatite aguda necrosante infectada em homem de 35 anos. Imagem axial de TC pós-contraste fase venosa mostra área liquefeita no corpo pancreático, compatível com área de necrose, com gás em seu interior (setas) que não delineia nível hidroaéreo, mas se localiza em meio ao líquido, indicando a presença de conteúdo líquido espesso/pus. O gás neste contexto traduz a presença de infecção. Pode ser dividida em necrose do parênquima pancreático usualmente concomitante com necrose dos tecidos peripancreáticos ou necrose restrita aos tecidos peripancreáticos. Cada uma dessas condições pode ou não estar associada a complicações infecciosas locais. Ocorre em 20-30% dos pacientes e é caracterizada por um curso prolongado, com alta incidência de complicações locais e alta taxa de mortalidade(1,10). A necrose parenquimatosa é definida como áreas que não apresentam realce pelo meio de contraste, podendo ser utilizada uma quantificação em termos de percentual de parênquima acometido em menos de 30%, entre 30% e 50% e acima de 50%(22). A necrose da gordura peripancreática (esteatonecrose) se manifesta por densificação e heterogeneidade dos tecidos peripancreáticos. Pode ser sugerida pela presença de espessamento das goteiras paracólicas e da raiz do mesentério, densificação da gordura com envolvimento dos espaços pararrenais anteriores e, na evolução, pelo desenvolvimento de acúmulos líquidos heterogêneos contendo componentes sólidos, já que o aspecto da necrose se modifica ao longo do tempo, podendo ter inicialmente um aspecto sólido heterogêneo, evoluindo para um aspecto mais liquefeito. Deve-se destacar também que na evolução de uma pancreatite aguda é mais comum observar-se necrose gordurosa peripancreática do que necrose do parênquima pancreático; ademais, a necrose gordurosa peripancreática representa uma condição de menor morbidade do que a necrose parenquimatosa(23). A definição de infecção da necrose pancreática/peripancreática é importante pelas implicações clínicas no tratamento e prognóstico. Infecção bacteriana secundária ocorre em 40-70% dos pacientes com pancreatite necrosante e constitui o principal fator de risco de mortalidade(24). Geralmente, a infecção da necrose pancreática ocorre após a segunda semana de evolução da doença(25) e pacientes com necroses infectadas necessitam de tratamento intensivo que pode incluir antibioticoterapia e necrosectomia(26). A presença de infecção pode ser presumida na TC pela presença de gás extraluminal nas áreas acometidas pela necrose(18,27), o que não ocorre em todos os casos de necrose infectada(7,26) (ver Figura 6). A formação de fístula entre a necrose pancreática e um segmento do trato gastrintestinal consiste em outra causa de gás em meio ao pâncreas, embora vá resultar em infecção da necrose. 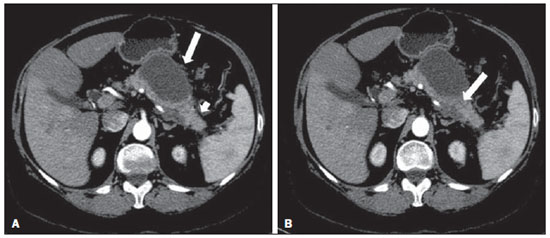 Figura 5. Síndrome da desconexão ductal. Pancreatite aguda necrosante com desconexão ductal em mulher de 61 anos. A,B: Imagens axiais de TC pós-contraste fase arterial parenquimatosa mostram área de necrose no corpo pancreático (seta longa em A) que acomete grande parte da espessura do parênquima e cauda pancreática de aspecto preservado (seta curta em A). Em B identifica-se o ducto pancreático principal desembocando na área necrosada (seta). 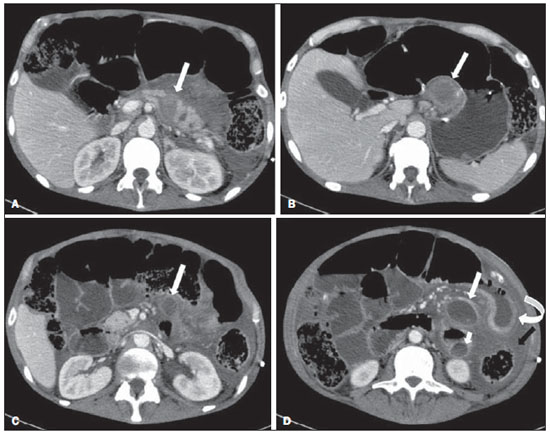 Figura 6. Acúmulos líquidos agudos em homem de 52 anos durante segunda semana de pancreatite aguda necrosante. A,B,C,D: Imagens axiais de TC pós-contraste fase venosa mostram hipocontrastação no corpo pancreático (seta em A), compatível com área de necrose, contígua a líquido hiperatenuante (provável conteúdo hemático) na retrocavidade dos epíploons (seta em B). Outros acúmulos líquidos são identificados entre alças intestinais na cavidade peritoneal (setas longas em C,D), no espaço pararrenal anterior esquerdo (seta curta em D), assim como espessamento parietal reativo de alças delgadas no flanco esquerdo (seta curva em D) e ascite (seta preta em D). Índice de gravidade por TC Foi proposto por Balthazar et al. em 1990(22), a partir da combinação do sistema original de avaliação da gravidade com TC não contrastada (pela avaliação da presença e número das coleções peripancreáticas) com o grau de necrose pancreática por TC contrastada. Teve por objetivo melhorar a detecção precoce de pacientes com as formas graves da doença e aprimorar o valor prognóstico da TC. Foi demonstrada uma correlação estatisticamente significante de morbimortalidade entre a classificação tomográfica e o estadiamento clínico(22,28,29). Índice de gravidade por TC modificado Foi proposto por Mortele et al. em 2004(30). Buscou em parte simplificar o índice original, na medida em que incluiu apenas a presença ou ausência de inflamação e coleções peripancreáticas (não sendo necessário quantificar o número de coleções) e excluiu a categoria de quantificação de necrose > 50%. Por outro lado, incorporou a avaliação das complicações extrapancreáticas na pontuação e mostrou melhor correlação com o desfecho clínico (tempo de permanência hospitalar e desenvolvimento de insuficiência orgânica) que o índice original, atribuída à inclusão das alterações extrapancreáticas no cálculo(31). Embora úteis na pesquisa clínica, os cálculos desses índices não são rotineiramente incluídos nos relatórios, sendo a avaliação da gravidade da pancreatite aguda sempre uma compilação dos achados radiológicos com dados clinicolaboratoriais(32,33). Síndrome da desconexão ductal (Figura 5) A síndrome da desconexão ductal ocorre quando uma área de necrose parenquimatosa provoca a descontinuidade do ducto pancreático principal, deixando uma porção a jusante da necrose com drenagem preservada e uma área de parênquima a montante da necrose com drenagem prejudicada. Desta forma, o parênquima pancreático a montante da área necrótica continua produzindo suco pancreático, que acaba por se acumular ou por fistulizar. Geralmente, tais acúmulos líquidos não resolvem espontaneamente, sendo necessária a drenagem cirúrgica, mais frequentemente com derivações pancreatojejunais, o que drena o acúmulo líquido e ajuda a preservar a função do parênquima pancreático situado a montante da área necrótica(34,35). COMPLICAÇÕES LOCAIS DA PANCREATITE AGUDA A principal mudança recente na avaliação radiológica da pancreatite aguda refere-se uso de termos mais apropriados na descrição das coleções líquidas e áreas de necrose que ocorrem dentro e ao redor do pâncreas. O APCWG propôs que os acúmulos líquidos pancreáticos e peripancreáticos fossem divididos em quatro categorias principais, de acordo com o tempo de instalação da doença (mais ou menos de quatro semanas) e a gravidade da pancreatite aguda. Assim, tanto a pancreatite intersticial edematosa quanto a pancreatite necrosante podem evoluir com acúmulos líquidos, que são classificados conforme segue. Acúmulos líquidos agudos peripancreáticos (Figura 6) Esses acúmulos líquidos desenvolvem-se dentro das primeiras quatro semanas após o início dos sintomas, não têm componentes sólidos e resultam de inflamação pancreática ou peripancreática sem necrose(9). Ocorrem nos espaços peripancreáticos, não têm paredes definidas e frequentemente se localizam na retrocavidade dos epíploons e nos espaços pararrenais anteriores. Esses acúmulos líquidos geralmente resultam de ruptura ductal, mas podem ser decorrentes apenas de transudação/edema, sem que haja comunicação ductal. A maioria desses acúmulos líquidos agudos permanece estéril e é reabsorvida espontaneamente dentro das primeiras semanas do episódio de pancreatite aguda(5,8,9,11,12,15). Pseudocisto (Figuras 7, 8 e 9) 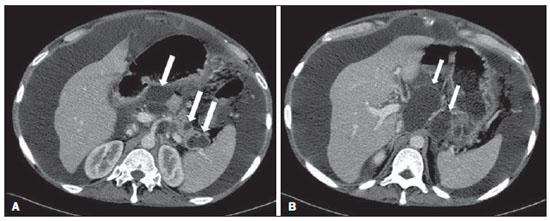 Figura 7. Pancreatite aguda edematosa com pseudocistos. A,B: Imagens axiais de TC pós-contraste fase venosa mostram alguns pseudocistos comprimindo o parênquima pancreático e outros na retrocavidade dos epíploons (setas). 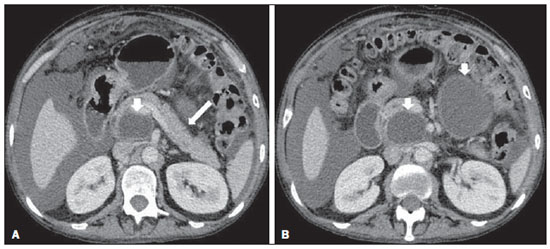 Figura 8. Pancreatite aguda edematosa com pseudocistos. A,B: Imagens axiais de TC pós-contraste fase venosa mostram realce preservado do parênquima pancreático (seta longa em A), pseudocisto posterior ao segmento cefálico, processo uncinado e no mesentério (setas curtas em A,B). 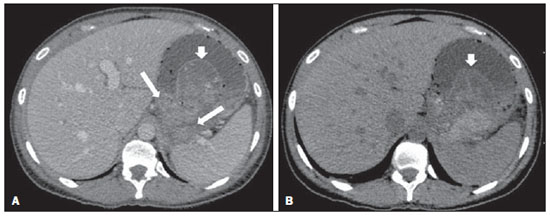 Figura 9. Complicação de pseudocisto em pancreatite aguda. A,B: Imagens axiais de TC pós-contraste fase venosa mostram alterações inflamatórias agudas na cauda pancreática (setas longas em A) e pseudocisto com conteúdo espontaneamente hiperatenuante/hemático (setas curtas em A,B) que se estende ao espaço subfrênico esquerdo e é parcialmente contido pela parede gástrica (setas curtas em A,B). É definido como um acúmulo líquido arredondado ou ovalado, circunscrito, homogêneo, com conteúdo rico em amilase, que se desenvolve tardiamente no curso da pancreatite aguda, cerca de quatro semanas após o evento inicial, sem evidência de qualquer componente sólido/necrose tecidual no seu interior. É circundado por uma cápsula de tecido de granulação e não possui revestimento epitelial, podendo ter localização intrapancreática ou extrapancreática(36). Consiste na evolução natural dos acúmulos líquidos peripancreáticos que persistem por mais de quatro semanas e ocorre em 10-20% dos pacientes(22). Na nossa experiência, adotando-se o critério da ausência de conteúdo sólido, o termo pseudocisto passa a ser utilizado na grande maioria dos casos em acúmulos líquidos circunscritos, extrapancreáticos. A visualização, em exames de diagnóstico por imagem, da parede (cápsula) do pseudocisto é variável e dependente da espessura dessa parede, porém sempre se deve observar o aspecto circunscrito para se denominar um acúmulo líquido como pseudocisto. Os pseudocistos podem regredir espontaneamente ou evoluir com complicações como sangramento (Figura 9) e infecção(18). O termo abscesso pancreático adotado na classificação de Atlanta não é mais utilizado e deve substituído por pseudocisto infectado, de acordo com o APCWG. Alterações pós-necróticas pancreáticas e peripancreáticas (Figura 10) 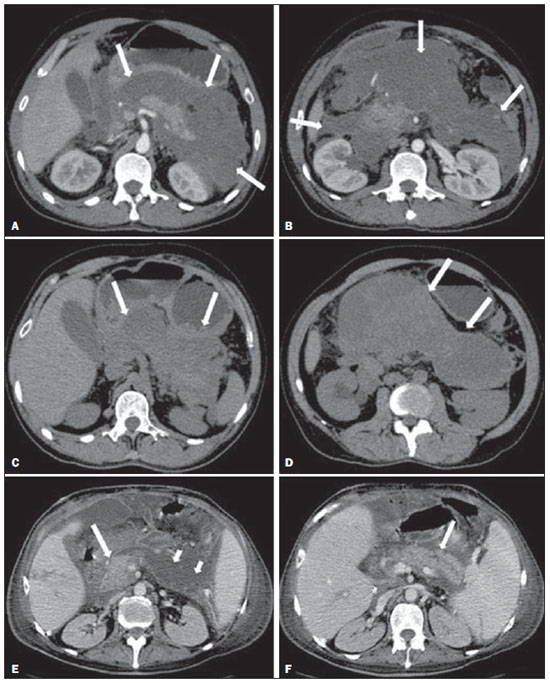 Figura 10. Alterações pós-necróticas pancreáticas e peripancreáticas. A,B: Imagens axiais de TC pós-contraste fase venosa mostram extensas áreas de esteatonecrose peripancreáticas (setas). C,D: Em TC de controle sem meio de contraste após oito semanas estas áreas tornaram-se mais bem delimitadas e com aspecto mais liquefeito, caracterizando uma alteração pós-necrótica pancreática e peripancreática (setas). D,E: Paciente de 37 anos com pancreatite aguda necrosante restrita aos tecidos peripancreáticos. Imagens axiais de TC pós-contraste fase venosa mostram realce parenquimatoso pancreático preservado (setas longas em D,E), com extensas áreas de esteatonecroses peripancreáticas (setas curtas em D). O paciente apresentava-se com quadro séptico e foi submetido à necrosectomia, sendo identificado material purulento nessas áreas. Essas alterações resultam de uma combinação de enzimas pancreáticas extravasadas, exsudatos inflamatórios, hemorragia e restos necróticos do parênquima e/ou dos tecidos peripancreáticos, incluindo áreas de necrose gordurosa (esteatonecrose). Novamente tem, inicialmente, uma aparência sólida evoluindo para um aspecto liquefeito no curso da doença, geralmente entre duas e seis semanas do quadro inicial. À medida que essas áreas de necrose se organizam, elas se tornam mais bem delimitadas por uma parede espessa de tecido de granulação, num processo similar ao desenvolvimento de um pseudocisto(5,7,9,11). Pode ser difícil distinguir essas alterações pós-necróticas dos acúmulos líquidos agudos peripancreáticos, especialmente na primeira semana de evolução da doença, mas os exames de controle em geral diferenciam as duas condições. Necrose pancreática delimitada (NPD) (walled-off pancreatic necrosis) Essa entidade morfológica distinta ocorre tardiamente no curso da pancreatite aguda necrosante (cerca de quatro semanas após o quadro inicial) e consiste em uma área circunscrita contendo líquido e restos pancreáticos necróticos que substitui parte do parênquima pancreático e surge a partir de uma área de necrose. Essa entidade não constava da classificação de Atlanta original e por isso ainda não é tão conhecida. A própria tradução do termo proposto originalmente na língua inglesa pode levar, inicialmente, a controvérsias, porém o conceito radiológico de uma alteração delimitada fica bem demonstrado no termo em inglês walled-off pancreatic necrosis, que provém da expressão wall-off - construir paredes ao redor de um local(37) (Figuras 11 e 12). 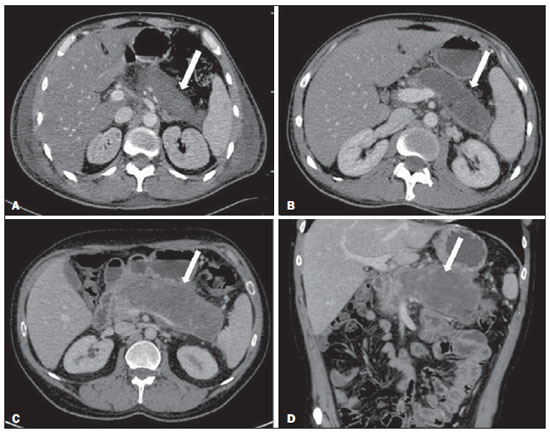 Figura 11. Necrose pancreática delimitada (walled-off pancreatic necrosis). A,B: Imagens axiais de TC pós-contraste fase venosa. Evolução de pancreatite aguda necrosante em homem de 45 anos. A: Extensa necrose do corpo e cauda pancreáticos de limites indistintos e com aspecto sólido (seta). B: Após duas semanas já pode ser identificada delimitação da área de necrose com aspecto liquefeito e com restos necróticos no seu interior (seta). C,D: Imagens axial (C) e coronal (D) de TC pós-contraste fase venosa. Homem de 42 anos com área de necrose parenquimatosa circunscrita substituindo corpo e cauda do pâncreas (setas), após três semanas da instalação do episódio de pancreatite aguda necrosante. 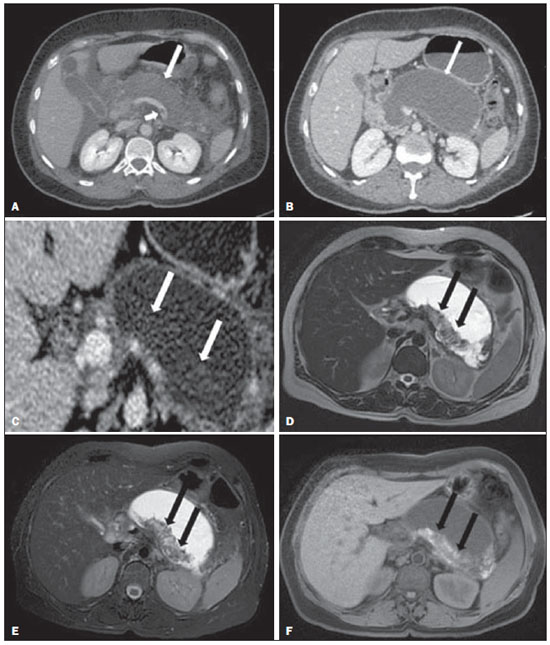 Figura 12. Necrose pancreática delimitada (walled-off pancreatic necrosis). A,B,C: Imagens axiais de TC pós-contraste fase venosa. Extensa necrose do corpo e cauda pancreáticos, com alterações inflamatórias peripancreáticas (seta longa em A). Também é identificado trombo no interior da veia esplênica (seta curta em A). Após cerca de um mês identifica-se a área de necrose pancreática delimitada (seta em B), que não deve ser confundida com um pseudocisto. Avaliando-se a mesma imagem com "janela mais fechada", é possível identificar os restos necróticos sem realce no interior desta necrose pancreática delimitada (setas em C). D,E,F: Imagens axiais de RM fast-spin-echo ponderada em T2 com (D) e sem (E) supressão de gordura e gradiente eco ponderada em T1 sem contraste (F) mostram restos necróticos do parênquima pancreático depositados na porção posterior da coleção (setas em E,F), que se apresentam com hiperintensidade de sinal em T1, indicando componente de hemorragia (setas em E). A tradução proposta neste artigo traz à literatura nacional o conceito já consolidado em artigos de revisão publicados em revistas internacionais e acreditamos que o termo necrose pancreática delimitada possa ser aplicado nos relatórios radiológicos de situações que se enquadrem na descrição acima apresentada. Não é incomum que áreas de NPD ainda sejam relatadas como pseudocistos, mas as duas entidades diferem no fato de que a NPD substitui uma porção do parênquima pancreático e apresenta conteúdo espesso (restos necróticos pancreáticos), enquanto o pseudocisto não contém restos necróticos e é formado mais comumente nos espaços peripancreáticos. A caracterização de restos necróticos na NPD nem sempre é simples à TC, mas pode ser feita analisando-se as imagens com janela adequada ("mais fechada"). A RM pode demonstrar ainda mais facilmente os restos necróticos(38) (Figura 12). A diferenciação é relevante clinicamente, uma vez que essas condições podem ter diferentes prognósticos e estratégias terapêuticas. Como já discutido, os pseudocistos têm um melhor prognóstico que as áreas de necrose pancreática, e, quando necessário, podem ser drenados por via endoscópica mais facilmente do que as NPDs(7-9,11,39). CONCLUSÃO A avaliação por imagem continua tendo papel fundamental na avaliação inicial, identificação dos casos graves, predição do prognóstico e na tomada de decisões durante o manejo terapêutico dos pacientes com pancreatite aguda. A correta diferenciação entre pancreatite edematosa e necrosante (nas suas formas pancreática ou apenas peripancreática) e a adequada caracterização dos acúmulos líquidos complexos relativos ao processo de necrose pancreática são determinantes para melhor condução dos pacientes em relação à estratificação prognóstica e à definição da melhor conduta terapêutica. A definição e a uniformização dos termos adotados na descrição das diferentes alterações que podem ocorrer na evolução das pancreatites agudas ajudam no adequado diálogo entre os diferentes especialistas envolvidos no diagnóstico e no tratamento desta relevante condição clínica. REFERÊNCIAS 1. Vege SS. Clinical manifestations and diagnosis of acute pancreatitis. UpToDate; 2011. [acessado em 20 de setembro de 2011]. Disponível em: https://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-acute-pancreatitis. 2. Brasil. Ministério da Saúde. Datasus. Informações de saúde - 2011. [acessado em 25 de setembro de 2011]. Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sih/cnv/niuf.def. 3. Bradley EL 3rd. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 through 13, 1992. Arch Surg. 1993;128:586-90. 4. Bollen TL, van Santvoort HC, Besselink MG, et al. The Atlanta classification of acute pancreatitis revisited. Br J Surg. 2008;95:6-21. 5. Sheu Y, Furlan A, Almusa O, et al. The revised Atlanta classification for acute pancreatitis: a CT imaging guide for radiologists. Emerg Radiol. 2012;19:237-43. 6. O'Connor OJ, Buckley JM, Maher MM. Imaging of the complications of acute pancreatitis. AJR Am J Roentgenol. 2011;197:W375-81. 7. Morgan DE. Imaging of acute pancreatitis and its complications. Clin Gastroenterol Hepatol. 2008;6:1077-85. 8. Brun A, Agarwal N, Pitchumoni CS. Fluid collections in and around the pancreas in acute pancreatitis. J Clin Gastroenterol. 2011;45:614-25. 9. Acute Pancreatitis Classification Working Group. Revision of the Atlanta classification of acute pancreatitis. [acessado em 20 de agosto de 2011]. Disponível em: http://www.pancreasclub.com/wp-content/uploads/2011/11/Atlanta Classification.pdf. 10. Munsell MA, Buscaglia JM. Acute pancreatitis. J Hosp Med. 2010;5:241-50. 11. Bharwani N, Patel S, Prabhudesai S, et al. Acute pancreatitis: the role of imaging in diagnosis and management. Clin Radiol. 2011;66:164-75. 12. Trout AT, Elsayes KM, Ellis JH, et al. Imaging of acute pancreatitis: prognostic value of computed tomographic findings. J Comput Assist Tomogr. 2010;34:485-95. 13. Arvanitakis M, Koustiani G, Gantzarou A, et al. Staging of severity and prognosis of acute pancreatitis by computed tomography and magnetic resonance imaging - a comparative study. Dig Liver Dis. 2007;39:473-82. 14. O'Connor OJ, McWilliams S, Maher MM. Imaging of acute pancreatitis. AJR Am J Roentgenol. 2011;197:W221-5. 15. Xiao B, Zhang XM. Magnetic resonance imaging for acute pancreatitis. World J Radiol. 2010;2:298-308. 16. Miller FH, Keppke AL, Dalal K, et al. MRI of pancreatitis and its complications: part 1, acute pancreatitis. AJR Am J Roentgenol. 2004;183:1637-44. 17. Makary MA, Duncan MD, Harmon JW, et al. The role of magnetic resonance cholangiography in the management of patients with gallstone pancreatitis. Ann Surg. 2005;241:119-24. 18. Balthazar EJ, Freeny PC, vanSonnenberg E. Imaging and intervention in acute pancreatitis. Radiology. 1994;193:297-306. 19. Working Party of the British Society of Gastroenterology; Association of Surgeons of Great Britain and Ireland; Pancreatic Society of Great Britain and Ireland; Association of Upper GI Surgeons of Great Britain and Ireland. UK guidelines for the management of acute pancreatitis. Gut. 2005;54 Suppl 3:iii1-9. 20. Stevens T, Parsi MA, Walsh RM. Acute pancreatitis: problems in adherence to guidelines. Cleve Clin J Med. 2009;76:697-704. 21. Lenhart DK, Balthazar EJ. MDCT of acute mild (nonnecrotizing) pancreatitis: abdominal complications and fate of fluid collections. AJR Am J Roentgenol. 2008;190:643-9. 22. Balthazar EJ, Robinson DL, Megibow AJ, et al. Acute pancreatitis: value of CT in establishing prognosis. Radiology. 1990;174:331-6. 23. Sakorafas GH, Tsiotos GG, Sarr MG. Extrapancreatic necrotizing pancreatitis with viable pancreas: a previously under-appreciated entity. J Am Coll Surg. 1999;188:643-8. 24. Mazaki T, Ishii Y, Takayama T. Meta-analysis of prophylactic antibiotic use in acute necrotizing pancreatitis. Br J Surg. 2006;93:674-84. 25. Fu CY, Yeh CN, Hsu JT, et al. Timing of mortality in severe acute pancreatitis: experience from 643 patients. World J Gastroenterol. 2007;13:1966-9. 26. Bhansali SK, Shah SC, Desai SB, et al. Infected necrosis complicating acute pancreatitis: experience with 131 cases. Indian J Gastroenterol. 2003;22:7-10. 27. Ranson JH, Balthazar E, Caccavale R, et al. Computed tomography and the prediction of pancreatic abscess in acute pancreatitis. Ann Surg. 1985;201:656-65. 28. Balthazar EJ, Ranson JH, Naidich DP, et al. Acute pancreatitis: prognostic value of CT. Radiology. 1985;156:767-72. 29. Balthazar EJ. Acute pancreatitis: assessment of severity with clinical and CT evaluation. Radiology. 2002;223:603-13. 30. Mortele KJ, Wiesner W, Intriere L, et al. A modified CT severity index for evaluating acute pancreatitis: improved correlation with patient outcome. AJR Am J Roentgenol. 2004;183:1261-5. 31. Mortele KJ, Ip IK, Wu BU, et al. Acute pancreatitis: imaging utilization practices in an urban teaching hospital - analysis of trends with assessment of independent predictors in correlation with patient outcomes. Radiology. 2011;258:174-81. 32. Bollen TL, Singh VK, Maurer R, et al. A comparative evaluation of radiologic and clinical scoring systems in the early prediction of severity in acute pancreatitis. Am J Gastroenterol. 2012;107:612-9. 33. Brisinda G, Vanella S, Crocco A, et al. Severe acute pancreatitis: advances and insights in assessment of severity and management. Eur J Gastroenterol Hepatol. 2011;23:541-51. 34. Sandrasegaran K, Tann M, Jennings SG, et al. Disconnection of the pancreatic duct: an important but overlooked complication of severe acute pancreatitis. Radiographics. 2007;27:1389-400. 35. Varadarajulu S, Noone TC, Tutuian R, et al. Predictors of outcome in pancreatic duct disruption managed by endoscopic transpapillary stent placement. Gastrointest Endosc. 2005;61:568-75. 36. Andrén-Sandberg A, Dervenis C. Pancreatic pseudocysts in the 21st century. Part I: classification, pathophysiology, anatomic considerations and treatment. JOP. 2004;5:8-24. 37. Cambridge Dictionaries Online. [acessado em 28 de setembro de 2011]. Disponível em: http//dictionary.cambridge.org. 38. Morgan DE, Baron TH, Smith JK, et al. Pancreatic fluid collections prior to intervention: evaluation with MR imaging compared with CT and US. Radiology. 1997;203:773-8. 39. Wysocki AP. Walled-off pancreatic necrosis: wishing our pancreatitis nomenclature was correct. World J Gastroenterol. 2010;16:4497-8. 1. Médica Radiologista do Image Memorial/DASA e Diagnoson a+ Medicina Diagnóstica, Salvador, BA, Brasil 2. Livre-docente, Professor Associado do Departamento de Radiologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil 3. Médico Radiologista do Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil 4. Doutores, Médicos Radiologistas do Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil Endereço para correspondência: Dr. Manoel de Souza Rocha Avenida Doutor Enéas de Carvalho Aguiar, 255, 3º andar, Cerqueira César São Paulo, SP, Brasil, 05403-900 E-mail: manoelrocha@usp.br Recebido para publicação em 7/9/2012. Aceito, após revisão, em 2/10/2013. Trabalho realizado no Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554