Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 1 - Jan. / Fev. of 2014
Vol. 47 nº 1 - Jan. / Fev. of 2014
|
QUAL O SEU DIAGNÓSTICO?
|
|
|
|
|
Autho(rs): Gláucia Zanetti1; Luiz Felipe Nobre2; Alexandre Dias Mançano3; Marcos Duarte Guimarães4; Bruno Hochhegger5; Dante Luiz Escuissato6; Cesar Augusto de Araujo Neto7; Arthur Soares Souza Jr.8; Edson Marchiori1 |
|
|
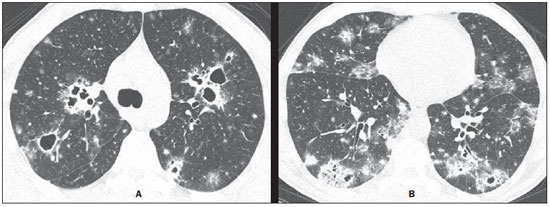
Homem, 49 anos, com história de, há 8 meses, tosse produtiva com expectoração mucopurulenta sem sangue, dispneia progressiva e astenia, com piora há 4 meses, referindo emagrecimento de 3 kg no período. Negava febre. A radiografia de tórax mostrou opacidades pulmonares com escavação. Foi realizada tomografia computadorizada (TC) de alta resolução do tórax (Figura 1). Os exames laboratoriais de rotina iniciais foram normais.
Descrição da imagem Figura 1. TC de alta resolução do tórax ao nível da carina (A) e dos lobos inferiores (B) demonstra pequenos nódulos, lesões múltiplas escavadas, de tamanho variável, em ambos os pulmões, além de consolidações periféricas multifocais e opacidades em vidro fosco predominando nos lobos inferiores. Diagnóstico: Paracoccidioidomicose pulmonar. Foi feito exame micológico de lavado broncoalveolar, com identificação do fungo na pesquisa direta e na cultura. COMENTÁRIOS A paracoccidioidomicose (PCM), também conhecida como blastomicose sul-americana, é a micose sistêmica mais comum na América Latina, sendo vista mais comumente no Brasil, Argentina, Colômbia e Venezuela. As áreas endêmicas mais afetadas do mundo estão nas regiões subtropicais do Brasil, sendo a infecção particularmente prevalente em trabalhadores rurais. Embora a maioria dos casos ocorra em países em desenvolvimento, padrões recentes de imigração e um aumento das viagens internacionais levaram a um crescente número de casos de PCM nos Estados Unidos e na Europa(1-8). A PCM é causada pelo fungo dimórfico Paracoccidioides brasiliensis. A doença é adquirida pela inalação das partículas infectadas que atingem os pulmões e causam a infecção primária. A PCM é caracterizada pelo acometimento pulmonar, linfonodal e progressão crônica de lesões mucocutâneas. Os pulmões são o principal órgão-alvo do P. brasiliensis e alterações crônicas são responsáveis pela morbidade e mortalidade associadas. A doença é geralmente assintomática, mas pode evoluir para o acometimento pulmonar grave, levando a tosse progressiva e falta de ar(1-8). A lesão inicial é semelhante à do complexo da tuberculose primária e é controlada por mecanismos naturais de defesa, ou progride para doença sintomática. Duas principais formas clínicas são reconhecidas: uma forma aguda e uma forma crônica localizada ou multifocal. A forma aguda ocorre mais comumente em pacientes jovens e envolve, principalmente, o sistema reticuloendotelial, enquanto a forma crônica é mais prevalente em homens adultos e tem uma distribuição pulmonar e mucocutânea predominante(1-8). Alterações pulmonares na radiografia de tórax de pacientes com PCM crônica são frequentemente múltiplas e inespecíficas e têm sido descritas como opacidades reticulares lineares, nódulos de tamanhos variados, opacidades mal definidas, consolidação do espaço aéreo e escavação. Em áreas endêmicas, o achado de opacidades bilaterais e simétricas nas zonas centrais dos pulmões com enfisema associado nas bases pulmonares é sugestivo da doença. Na PCM pulmonar crônica, distorção arquitetural, enfisema paracicatricial e bronquiectasias de tração são manifestações comuns de fibrose pulmonar(9,10). A TC de alta resolução é frequentemente realizada na investigação de infecções pulmonares, incluindo a PCM. Este exame pode identificar anormalidades pulmonares em pacientes com radiografias normais e é mais sensível do que as radiografias de tórax na caracterização do padrão e extensão das alterações. Os achados mais comuns na TC são opacidades em vidro fosco, consolidação, nódulos pequenos ou grandes, massas, escavação, espessamento dos septos interlobulares, enfisema e lesões fibróticas. Bandas parenquimatosas e distorção arquitetural mais frequentemente representam doença crônica. A maioria destas lesões predomina nas regiões periféricas e posteriores, envolvendo todas as regiões dos pulmões, com discreto predomínio nas zonas médias(3-8). A PCM é também uma causa importante do sinal do halo invertido na TC de alta resolução, devendo ser considerado no diagnóstico diferencial(4,11). Recentemente, formações císticas foram descritas na PCM pulmonar(12). Os achados na TC de alta resolução em pacientes com síndrome da imunodeficiência adquirida (SIDA) e PCM são semelhantes aos observados nos pacientes sem SIDA(13) . Embora o comprometimento pulmonar seja o achado mais comum na forma crônica, a PCM pode se apresentar também com alterações extrapulmonares, tais como o envolvimento da traqueia e dos linfonodos, pneumotórax e lesões ósseas. PCM traqueal e tuberculose parecem disseminar com padrões similares. Os achados da TC em pacientes com PCM traqueal são espessamento circunferencial irregular da parede da traqueia, com nódulos submucosos(8,14). Apesar de a doença envolver frequentemente o sistema linfático, linfonodomegalias hilares ou mediastinais são incomuns. Linfonodopatia é relatada em apenas 13% dos casos, e derrame pleural é incomum, tanto nas formas agudas como crônicas. Pneumotórax secundário a PCM também foi relatado, provavelmente causado por ruptura de um espaço contendo ar (enfisema, com ou sem formação de bolhas, ou uma lesão escavada)(15). Envolvimento ósseo na PCM é incomum e resulta, principalmente, de disseminação hematogênica. Uma revisão de 173 casos consecutivos de PCM aguda e crônica mostrou lesões ósseas em apenas 1,7% dos casos(9). Apesar de raras, lesões ósseas ou articulares ocorrem com mais frequência na forma juvenil da doença, especialmente em crianças(16-18). Por esta razão, a associação de lesões pulmonares e ósseas é extremamente rara. O reconhecimento dos padrões de TC associados com a PCM pulmonar pode ajudar no diagnóstico precoce e na instituição do tratamento específico, reduzindo assim a morbidade e mortalidade associadas com a doença. REFERÊNCIAS 1. Blotta MH, Mamoni RL, Oliveira SJ, et al. Endemic regions of paracoccidioidomycosis in Brazil: a clinical and epidemiologic study of 584 cases in the southeast region. Am J Trop Med Hyg. 1999;61:390-4. 2. Marchiori E, Moraes HP, Muniz MAS, et al. Paracoccidioidomicose: correlação da tomografia computadorizada de alta resolução com a anatomopatologia. Radiol Bras. 2000;33:333-40. 3. Muniz MAS, Marchiori E, Magnago M, et al. Paracoccidioidomicose pulmonar - aspectos na tomografia computadorizada de alta resolução. Radiol Bras. 2002;35:147-54. 4. Gasparetto EL, Escuissato DL, Davaus T, et al. Reversed halo sign in pulmonary paracoccidioidomycosis. AJR Am J Roentgenol. 2005;184:1932-4. 5. Souza AS Jr, Gasparetto EL, Davaus T, et al. High-resolution CT findings of 77 patients with untreated pulmonary paracoccidioidomycosis. AJR Am J Roentgenol. 2006;187:1248-52. 6. Funari M, Kavakama J, Shikanai-Yasuda MA, et al. Chronic pulmonary paracoccidioidomycosis (South American blastomycosis): high-resolution CT findings in 41 patients. AJR Am J Roentgenol. 1999;173:59-64. 7. Marchiori E, Valiante PM, Mano CM, et al. Paracoccidioidomycosis: high-resolution computed tomography-pathologic correlation. Eur J Radiol. 2011;77:80-4. 8. Barreto MM, Marchiori E, Amorim VB, et al. Thoracic paracoccidioidomycosis: radiographic and CT findings. Radiographics. 2012;32:71-84. 9. Trad HS, Trad CS, Elias Jr J, et al. Radiological review of 173 consecutive cases of paracoccidioidomycosis. Radiol Bras. 2006;39:175-9. 10. Moraes CS, Queiroz-Telles F, Marchiori E, et al. Análise das alterações radiográficas pulmonares durante a terapêutica da paracoccidioidomicose. Radiol Bras. 2011;44:20-8. 11. Freitas Filho M, Gonçalves FG, Basílio MAR, et al. Pulmonary paracoccidioidomycosis and reversed halo sign: a two-case report. Radiol Bras. 2007;40:355-7. 12. Costa AN, Marchiori E, Benard G, et al. Lung cysts in chronic paracoccidioidomycosis. J Bras Pneumol. 2013;39:368-72. 13. Marchiori E, Gasparetto EL, Escuissato DL, et al. Pulmonary paracoccidioidomycosis and AIDS: high-resolution CT findings in five patients. J Comput Assist Tomogr. 2007;31:605-7. 14. Marchiori E, Escuissato DL, Souza AS Jr, et al. Computed tomography findings in patients with tracheal paracoccidioidomycosis. J Comput Assist Tomogr. 2008;32:788-91. 15. Pereira ML, Marchiori E, Zanetti G, et al. Spontaneous pneumothorax as an atypical presentation of pulmonary paracoccidioidomycosis: a case report with emphasis on the imaging findings. Case Rep Med. 2010;2010:961984. 16. Marchiori E, Ferreira EC, Zanetti G, et al. Whole-body magnetic resonance imaging for the evaluation of thoracic involvement in disseminated paracoccidioidomycosis. J Bras Pneumol. 2013;39:248-50. 17. Bayerl JS, Oliveira ARN, Peçanha PM, et al. Osteomyelitis of the wrist in a patient with disseminated paracoccidioidomycosis: a rare presentation. Radiol Bras. 2012;45:238-40. 18. Marchiori E, Dalston M, Zanetti G, et al. Paracoccidioidomycosis: another cause of sternal osteomyelitis. Joint Bone Spine. 2012;79:323-4. 1. Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 2. Universidade Federal de Santa Catarina (UFSC), Florianópolis, SC, Brasil 3. Radiologia Anchieta – Hospital Anchieta, Taguatinga, DF, Brasil 4. A.C.Camargo Cancer Center, São Paulo, SP, Brasil 5. Santa Casa de Porto Alegre, Porto Alegre, RS, Brasil 6. Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil 7. Universidade Federal da Bahia (UFBA), Salvador, BA, Brasil 8. Faculdade de Medicina de São José do Rio Preto (Famerp), São José do Rio Preto, SP, Brasil Endereço para correspondência: Dr. Edson Marchiori Rua Thomaz Cameron, 438, Valparaíso Petrópolis, RJ, Brasil, 25685-120 E-mail: edmarchiori@gmail.com Trabalho realizado na Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RS, Brasil. |
|
GN1© Copyright 2024 - All rights reserved to Colégio Brasileiro de Radiologia e Diagnóstico por Imagem
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554