Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 46 nº 5 - Set. / Out. of 2013
Vol. 46 nº 5 - Set. / Out. of 2013
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Viviane Brandão Amorim1; Rosana Souza Rodrigues2; Miriam Menna Barreto3; Gláucia Zanetti4; Edson Marchiori5 |
|
|
Descritores: Influenza A (H1N1); Infecção pulmonar; Viroses pulmonares; Tomografia computadorizada. |
|
|
Resumo: INTRODUÇÃO
Em abril de 2009 teve início uma epidemia de doença respiratória febril aguda causada por um novo vírus: influenza A (H1N1). Os primeiros casos ocorreram no México e a infecção rapidamente se propagou pelo mundo(1). Até agosto de 2010, 214 países haviam sido atingidos pela infecção, com mais de 18.000 óbitos confirmados(1,2). Este novo vírus é transmitido de pessoa a pessoa de forma direta ou indireta, por meio de secreções respiratórias de pessoas infectadas. Os sintomas podem iniciar-se no período de 3 a 7 dias após contato com o vírus e a transmissão ocorre principalmente em locais fechados, começando antes do início dos sintomas. As manifestações clínicas da infecção são semelhantes às da gripe comum, muitas vezes autolimitadas. Entretanto, em algumas ocasiões os sintomas respiratórios podem ser exuberantes, chegando a insuficiência respiratória e óbito(3). A radiografia torácica proporciona informações adequadas para definir a conduta na maior parte dos pacientes afetados(4). Todavia, muitas vezes a tomografia computadorizada de alta resolução (TCAR) se torna uma importante ferramenta para estabelecer a extensão do comprometimento pulmonar, além de ser útil na avaliação de complicações, infecções mistas ou falha na resposta à terapia adequada(5). Embora o diagnóstico da infecção viral seja baseado no quadro clínico e na identificação do vírus, familiaridade com os aspectos de imagem da doença pode ser útil em pacientes com manifestações clínicas frustras ou atípicas, em que a infecção pelo H1N1 não tenha sido suspeitada. O objetivo deste trabalho foi fazer uma revisão dos achados tomográficos pulmonares mais frequentes nos pacientes com infecção comprovada pelo vírus influenza A (H1N1). CONSIDERAÇÕES GERAIS O vírus da influenza A (H1N1) ocasionou a primeira pandemia do século XXI. Em agosto de 2010, a Organização Mundial da Saúde (OMS) declarou o fim do período pandêmico. Mesmo com o fim da pandemia, o subtipo A/H1N1 2009 continua circulando no mundo inteiro, agora produzindo apenas surtos localizados, dado que grande parte das pessoas já está protegida contra ele, seja porque tiveram a infecção natural em 2009 (estima-se que até 30% da população podem ter tido influenza pelo subtipo A/H1N1 2009) ou porque se vacinaram. Os surtos vêm ocorrendo em praticamente todos os países do mundo(6). Logo, a possibilidade da infecção pelo vírus da influenza A (H1N1) ainda deve ser considerada em pacientes com síndrome gripal, principalmente naqueles com fator de risco para uma pior evolução. A influenza pandêmica (H1N1) 2009 foi causada por uma cepa do vírus influenza que nunca havia circulado entre humanos até o início do ano de 2009. O agente etiológico é denominado vírus influenza A (H1N1) de origem suína(7). A transmissão ocorre por meio de secreções respiratórias contendo os vírus, que são espalhados por pequenas partículas de aerossol geradas durante o ato de espirrar, tossir ou falar(3). As infecções duram aproximadamente uma semana e são caracterizadas pelo início súbito dos sintomas, como febre alta, do-res musculares, cefaleia, mal-estar, tosse e coriza. A maioria das pessoas recupera-se sem necessidade de tratamento médico. Em crianças muito jovens, idosos ou pessoas com comorbidades (doenças pulmonares, metabólicas, renais, entre outras) a evolução pode apresentar complicações(2,3). Apesar de o fim da pandemia ter sido declarada pela OMS em agosto de 2010, há ainda a ocorrência de casos e surtos localizados em todo o Brasil(8,9). De acordo com dados do Ministério da Saúde (MS), em 2011 foram notificados aproximadamente 5.000 casos de síndrome respiratória aguda grave (SRAG) em pacientes hospitalizados, sendo 181 (3,7%) confirmados para influenza A (H1N1). Dentre os casos confirmados, 21 (11,6%) evoluíram a óbito(8). No ano de 2012, até a data de 7 de novembro, do total de casos de SRAG internados, a influenza foi responsável por 20,4% (3.978/19.521), e destes, 65,5% foram causados pelo vírus influenza A (H1N1). As regiões que acumularam o maior número de casos registrados no período foram a Região Sul e a Região Sudeste(9). MANIFESTAÇÕES CLÍNICAS A infecção pelo vírus influenza A (H1N1) apresenta amplo espectro de síndromes clínicas, que varia desde casos assintomáticos até pneumonia viral fulminante, falência respiratória e morte(5). A grande maioria dos pacientes que procuram por auxílio médico apresenta sinais e sintomas semelhantes aos observados nos pacientes acometidos pela influenza sazonal. Geralmente, há febre e tosse, sintomas que muitas vezes são acompanhados de odinofagia, rinorreia, mialgia e cefaleia. Sintomas gastrintestinais, inclusive náuseas, vômitos e diarreia, ocorrem mais comumente que na influenza sazonal, particularmente em adultos. Ocasionalmente, a influenza pode causar broncoespasmo ou pneumonia(3). A evolução usual é a resolução espontânea em 7 dias, embora a tosse, o mal-estar e a fadiga possam permanecer por algumas semanas. Alguns casos podem evoluir com complicações(10). Dispneia, taquipneia em crianças, dor torácica, hemoptise ou escarro purulento, febre prolongada ou recorrente, letargia, desidratação e reaparecimento dos sintomas após melhora inicial são sinais de evolução desfavorável ou surgimento de complicações da doença(3). As infecções bacterianas (sinusite, otite, pneumonia) são as complicações mais comuns em crianças e em idosos(3). A principal síndrome clínica que leva à internação hospitalar e à admissão em UTI é a pneumonia viral difusa associada com hipoxemia grave, síndrome do desconforto respiratório do adulto (SDRA), choque e insuficiência renal. Sua progressão geralmente é rápida, a partir de 4-5 dias após o início da doença, e muitas vezes é necessária intubação dentro das primeiras 24 horas após a admissão(3). Coinfecção bacteriana pode afetar a gravidade das manifestações clínicas e o desfecho da doença. Ela foi descrita em casos graves e fatais de outras pandemias causadas pelo vírus influenza (90% das autópsias na pandemia de 1918 e cerca de 75% das autópsias na pandemia de 1957) e na influenza sazonal(11,12). A incidência de pneumonia bacteriana associada ao vírus A (H1N1) varia de 29% a 55% dos casos(11-13). Esta coinfecção tem papel relevante na evolução da infecção pelo vírus pandêmico. DIAGNÓSTICO Os achados laboratoriais mais comumente presentes são: leucopenia com linfocitopenia, trombocitopenia, aumento leve a moderado das transaminases e da desidrogenase láctica (LDH)(2,14). Pode ocorrer ainda aumento da creatininoquinase, observado em pacientes que evoluíram com miosite(15). Segundo o MS, o exame laboratorial para diagnóstico específico da influenza pandêmica (H1N1) 2009 somente está indicado em casos de SRAG e em casos de surtos de síndrome gripal em comunidades fechadas, conforme a orientação da vigilância epidemiológica(14,16). A técnica de diagnóstico preconizada pela OMS para confirmação laboratorial do vírus influenza A (H1N1) é a reação em cadeia de polimerase por tempo real (PCRRT). O material clínico de escolha é a secreção de ambas as narinas e da orofaringe, podendo ser coletado por aspirado ou por swabs (rayon). Este último não é recomendado para crianças menores de 2 anos. As amostras de secreções respiratórias devem ser coletadas preferencialmente no 3º dia após o início dos sintomas, antes do início do tratamento com oseltamivir, e, no máximo, até o 7º dia(14,16). Espécimes do trato respiratório inferior, incluindo secreção, aspirado endotraqueal e lavado broncoalveolar, podem ser mais sensíveis nos casos em que há predomínio do envolvimento do trato respiratório inferior. Além disso, o vírus pode ser detectado no sangue, nas fezes e na urina(17). O padrão ouro para o diagnóstico do vírus é a cultura viral positiva, realizada a partir de secreções respiratórias ou outros espécimes teciduais(17). ASPECTOS HISTOPATOLÓGICOS O vírus influenza A (H1N1) provoca alterações histopatológicas tanto no trato respiratório superior quanto no inferior. As típicas infecções não complicadas com curso benigno aparentemente acometem somente a mucosa da árvore traqueobrônquica superior(13). Os achados histopatológicos são semelhantes aos das pneumonias ocasionadas por outros vírus influenza, logo, não são patognomônicos(18). O vírus influenza é um vírus respiratório citopático que causa injúria pulmonar afetando o epitélio difusamente, e nos casos mais graves resultando em bronquite e/ou bronquiolite necrotizante e dano alveolar difuso (DAD)(19). Autópsias realizadas em pacientes que faleceram em decorrência da pneumonia pelo vírus influenza A (H1N1) mostram que a principal alteração pulmonar é o DAD(11-13,18). Na fase tardia da doença, DAD em organização, fibrose, hiperplasia de pneumócitos tipo II, regeneração epitelial e metaplasia escamosa são encontrados, que são compatíveis com fase fibroproliferativa da SDRA e DAD(17). ASPECTOS RADIOLÓGICOS A avaliação do tórax por métodos de imagem tem sido motivo de uma série de publicações recentes na literatura radiológica nacional(19-28). Os achados radiológicos em infecções virais não são específicos e dependem do processo patológico ao qual o pulmão é submetido. Eles refletem uma ampla variedade de características histopatológicas, como o DAD (edema intra-alveolar, fibrina e infiltrados celulares com membrana hialina), a hemorragia intra-alveolar e o infiltrado intersticial de células inflamatórias (intrapulmonar ou na via aérea)(29,30). A radiografia do tórax normalmente é a primeira modalidade de imagem obtida para a avaliação dos quadros respiratórios agudos(5), sendo um método acessível, rápido e de baixo custo. Os achados radiográficos não são suficientes para o diagnóstico definitivo de pneumonia viral, porém em combinação com os dados clínicos e laboratoriais podem melhorar substancialmente a precisão do diagnóstico da doença(29). Em pneumonias virais, as radiografias torácicas podem mostrar-se normais ou apresentar áreas focais unilaterais ou bilaterais de consolidação, opacidades nodulares, espessamento de paredes brônquicas e pequenos derrames pleurais; consolidação lobar é incomum(29). Nas radiografias realizadas em pacientes com pneumonia pelo vírus A (H1N1) comumente são observados infiltrados alveolares focais bilaterais, predominantes nas bases pulmonares(15). A TC, especialmente a TCAR, é um excelente método na avaliação de doenças pulmonares, apresentando maior acurácia em relação à radiografia. Nos dias atuais, um número crescente de pacientes é submetido à TC quando a suspeita clínica de infecção viral é alta e as radiografias torácicas são normais ou duvidosas(5,29). Heussel et al.(31) realizaram um estudo em pacientes neutropênicos febris e observaram que em 48% dos casos nos quais a radiografia torácica era normal havia achados sugestivos de pneumonia na TC. A TC também é útil na avaliação de complicações em pacientes com pneumonia conhecida e que não respondem à terapêutica adequada(5). Na TC de pacientes acometidos por pneumonias virais, os achados predominantes são opacidades em vidro fosco uni ou bilaterais, associadas ou não a áreas focais ou multifocais de consolidação. As opacidades em vidro fosco e as áreas de consolidação têm distribuição predominante peribroncovascular e subpleural, assemelhando-se a pneumonia em organização(5,29,30,32). Outros achados comuns são micronódulos, nódulos centrolobulares, padrão de "árvore em brotamento", espessamento de paredes brônquicas e aprisionamento aéreo(29,30). A hiperinsuflação é comum, devido à bronquiolite associada(5,30). A forma aguda da pneumonia com rápida progressão mostra uma rápida confluência da consolidação ocasionada pelo dano alveolar difuso, que pode ser homogênea ou irregular, unilateral ou bilateral, além de opacidades em vidro fosco ou nódulos centrolobulares mal definidos(30). Os principais achados na TCAR de pacientes acometidos pelo vírus A (H1N1) são opacidades em vidro fosco, consolidação ou a combinação de vidro fosco e consolidação (Figuras 1 e 2)(5,18,33-40). Os pacientes com consolidação apresentam evolução clínica pior(5,18,33,34). A distribuição destas alterações é predominantemente sub-pleural e peribroncovascular(5,33,35). Existe predileção pelas bases pulmonares(35,37). 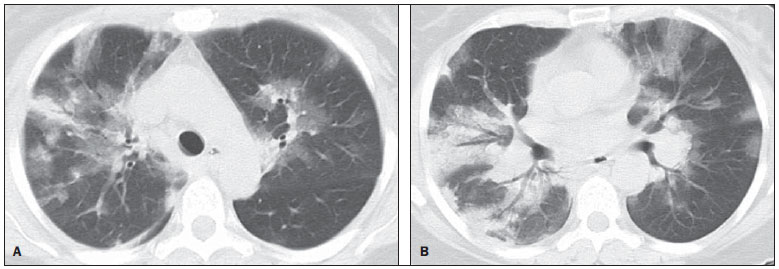 Figura 1. TCAR mostrando áreas de consolidação e opacidades em vidro fosco nos lobos superiores (A) e inferiores (B) de ambos os pulmões. 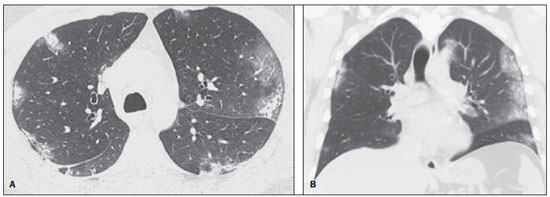 Figura 2. TCAR em corte axial (A) e reformatação no plano coronal (B) demonstrando opacidades em vidro fosco e focos de consolidação com distribuição predominantemente periférica. Marchiori et al.(5) correlacionaram os achados radiográficos e tomográficos de 20 pacientes com diagnóstico comprovado de infecção pelo influenza A (H1N1). As radiografias e as TCARs foram realizadas em um mesmo dia. A radiografia de tórax foi normal em 4 pacientes, observando-se consolidações bilaterais nas radiografias dos demais pacientes. Os principais achados na TCAR foram opacidades em vidro fosco (n = 12), consolidação (n = 2) e a associação de opacidades em vidro fosco e consolidação (n = 6). Em todos os pacientes as alterações foram bilaterais, com distribuição subpleural (periférica) em 13 casos e randômica em 7 casos. Nesse estudo não foram observadas opacidades nodulares ou linfonodomegalias. Nos pacientes em que a radiografia torácica foi normal, foram vistas opacidades em vidro fosco à TCAR. Os pacientes que apresentaram consolidação na TCAR evoluíram de maneira desfavorável em relação aos que apresentaram vidro fosco. Dos 8 pacientes com consolidação, 4 necessitaram de ventilação mecânica e 3 morreram. A série de Grieser et al.(36) teve como objetivo avaliar se os achados tomográficos teriam valor em predizer o prognóstico em pacientes acometidos pelo vírus influenza A (H1N1) que evoluíram precocemente com SDRA. Os autores analisaram 23 TCs quanto às alterações apresentadas e as graduaram a partir de um escore baseado na distribuição e intensidade dos achados nas seis zonas pulmonares e a densidade desses achados medida por unidades Hounsfield. Em todas as TCs foi observada uma associação de opacidades em vidro fosco e consolidação acometendo ambos os pulmões, sem predominância zonal em 17 pacientes, ou predominando nos lobos inferiores em 6 dos pacientes. Quanto à graduação dos achados, um escore maior foi obtido nos pacientes que morreram (9 pacientes; 39%), sendo significativamente menor nos pacientes que sobreviveram. Os autores concluíram que o escore usado tem valor prognóstico nos pacientes que evoluíram com SDRA. Toufen et al.(41) acompanharam clínica e radiologicamente 4 pacientes acometidos pelo vírus pandêmico da influenza A (H1N1) que evoluíram com SDRA. Os pacientes realizaram exames durante a sua estadia no hospital, entre 1 e 2 meses e posteriormente com 6 meses após a alta hospitalar. Todos os pacientes apresentaram opacidades em vidro fosco difusas nas TCARs realizadas durante a internação, observando-se melhora dessas alterações após 6 meses. Em nenhum dos pacientes a TCAR realizada na fase expiratória após 6 meses mostrou aprisionamento aéreo. Em relação aos estudos pulmonares funcionais, 2 pacientes (50%) persistiam com padrão pulmonar restritivo e todos apresentaram capacidade de difusão do monóxido de carbono normal. Os resultados surpreenderam, uma vez que a literatura destaca anormalidades da função pulmonar em sobreviventes da SDRA após 6 meses de evolução, com baixa capacidade de difusão do monóxido de carbono e alterações residuais sugestivas de fibrose na TCAR. Nos pacientes que evoluem para a cura, as opacidades pulmonares geralmente regridem durante a fase de convalescença e as consolidações podem ocasionalmente evoluir para opacidades lineares(5,18,34). Estas opacidades lineares provavelmente representam pneumonia em organização(33,34,42,43). Com o objetivo de comparar os achados radiológicos durante as fases aguda e de convalescença da doença, Li et al.(18) realizaram uma análise seriada dos achados em TCARs de 70 pacientes acometidos pelo vírus influenza A (H1N1). Os autores dividiram os pacientes em dois grupos: o grupo 1 era formado por pacientes mais graves e que necessitaram de internação em UTI ou foram submetidos a ventilação mecânica, e o grupo 2 foi formado por pacientes que tiveram rápida internação, sem necessidade de ventilação mecânica. Opacidades em vidro fosco foram o achado predominante na primeira semana após o início dos sintomas (95% dos pacientes), associadas ou não a consolidação, reduzindo a sua frequência nas semanas subsequentes. Aprisionamento aéreo foi observado em apenas 9 pacientes que foram submetidos a ventilação mecânica. Quanto à extensão do acometimento pulmonar pela doença, este foi maior na segunda semana após o início dos sintomas nos dois grupos, com lenta resolução nas semanas seguintes. Foi observado um maior acometimento pulmonar no grupo 1. Achados sugestivos de fibrose (linhas intralobulares, opacidades reticulares, bronquiectasias de tração, bandas parenquimatosas e opacidades lineares irregulares) já eram observados na primeira semana após o início dos sintomas e aumentaram a sua frequência posteriormente. A segunda semana após o início dos sintomas foi o período em que se observou o maior número de linhas intralobulares e opacidades reticulares em associação às opacidades em vidro fosco. O tempo médio de achados sugestivos de fibrose foi de 22,6 ± 15,8 dias. Após um mês do início dos sintomas os pacientes apresentaram melhora dos achados relativos à fibrose, demonstrando capacidade de regeneração pulmonar. Marchiori et al.(34) acompanharam a evolução clínica e radiológica de um paciente acometido por influenza A (H1N1) que se recuperou completamente da infecção. Seus achados foram semelhantes aos de Li et al.(18). A TCAR inicial evidenciou vidro fosco e consolidação. Durante a fase de convalescença da doença, a TCAR mostrou opacidades lineares onde antes havia vidro fosco e consolidação. Com o tratamento o paciente evoluiu com remissão completa dos sintomas. Uma TCAR de controle após três meses do início dos sintomas foi normal. Durante o tratamento e a fase de recuperação da doença, opacidades persistentes nas radiografias do tórax podem não ser informativas o suficiente para distinguir entre a progressão da doença e a cura. Nestes casos a TCAR auxilia a reconhecer e caracterizar a fase da doença, monitorando sua progressão e resposta ao tratamento, bem como identificando complicações(34). Alterações que refletem comprometimento de pequenas vias aéreas, comumente associadas a infecção viral, como nódulos centrolobulares, opacidades em "árvore em brotamento", aprisionamento aéreo e espessamento de paredes brônquicas, também são descritas na infecção pelo influenza A (H1N1), porém são pouco comuns(35,37,44,45). Ketai(46) sugere que os pacientes com infecção pelo vírus A (H1N1) desenvolvem doença de pequenas vias aéreas no início de seu curso e então melhoram clinicamente ou progridem para outro padrão mais grave de envolvimento pulmonar que os fazem procurar auxílio médico. O padrão peribroncovascular em muitos desses pacientes mais gravemente doentes fala a favor do envolvimento de grandes vias aéreas, ao invés de pequenas vias aéreas. Contrariando a sugestão de Ketai(46), na qual o acometimento das pequenas vias aéreas se daria num curso precoce da doença, Marchiori et al.(35) acompanharam uma paciente de 38 anos com a gripe A (H1N1) que evoluiu com acometimento de pequenas vias aéreas na fase de convalescença, apresentando achados clínicos e radiológicos sugestivos de bronquiolite. Na fase aguda da doença, a paciente apresentou consolidação bilateral na radiografia de tórax e na TCAR se evidenciaram consolidação e opacidades em vidro fosco bilaterais, com distribuição peribroncovascular predominantemente basal. Após três meses de evolução da doença, a paciente apresentava dispneia. A TCAR desta época mostrou completa regressão das opacidades e o aparecimento de aprisionamento aéreo, mais bem demonstrado na fase expiratória (Figura 3). A espirometria confirmou os achados de envolvimento de pequenas vias aéreas. 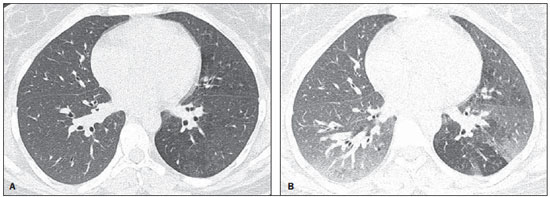 Figura 3. TCAR em cortes axiais em inspiração (A) e expiração (B) identificando área de aprisionamento aéreo no lobo inferior do pulmão esquerdo. O acometimento de pequenas vias aéreas foi descrito em duas séries realizadas em pacientes imunocomprometidos infectados pelo vírus da influenza A (H1N1)(37,44). Em um desses estudos, Elicker et al.(44) avaliaram 20 TCs de 8 pacientes. Espessamento de paredes brônquicas foi evidenciado em todos os exames. O segundo achado mais frequente foi consolidação, observada em 85% dos exames, com distribuição mais comumente periférica (50%) e acometendo os lobos inferiores (90%). Opacidades em vidro fosco foram vistas em 65% dos exames (13/20). Nódulos centrolobulares estavam presentes em 8 das 20 TCs (40%), sendo em 2 delas com o padrão de "árvore em brotamento" (Figura 4). No outro estudo, Rodrigues et al.(37) também avaliaram pacientes imunocomprometidos e, assim como Elicker et al.(44), descreveram o acometimento de pequenas vias aéreas. Os autores analisaram os achados tomográficos de 8 pacientes oncológicos neutropênicos febris acometidos pelo vírus da influenza A (H1N1). Na sua série, os achados predominantes foram opacidades em vidro fosco (todos os pacientes) e consolidação (7/8 pacientes). Nódulos do espaço aéreo foram observados em 6 pacientes. Este não é um achado comum na literatura relacionado ao vírus A (H1N1), fato que os autores atribuem à interpretação alternativa de nódulos do espaço aéreo como áreas focais de consolidação. Nódulos centrolobulares, padrão de "árvore em brotamento" e espessamento de paredes brônquicas foram evidenciados em 25% dos pacientes (2/8). Um paciente apresentou o padrão de "pavimentação em mosaico" (Figura 5). Os autores classificaram os achados de acordo com o padrão predominante, sendo este característico de pneumonia em 5 pacientes, bronquite/bronquiolite em 2 pacientes e de cronicidade em 1 paciente. Dos pacientes com padrão pneumônico, em 4 os achados eram dominantes nos terços inferiores. 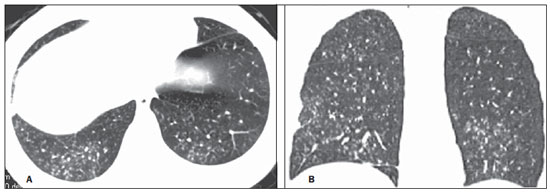 Figura 4. TCAR em corte axial (A) e reformatação no plano coronal (B) evidenciando múltiplos pequenos nódulos centrolobulares, alguns configurando o aspecto de "árvore em brotamento", distribuídos principalmente nas porções posteriores dos pulmões. 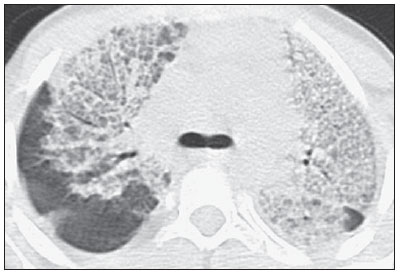 Figura 5. TCAR em corte axial ao nível da carina mostrando áreas de atenuação em vidro fosco associadas a espessamento de septos interlobulares em ambos os pulmões (padrão de pavimentação em mosaico). Tanaka et al.(38) compararam os achados na TCAR de 10 pacientes acometidos pelo vírus da influenza sazonal e de 19 pacientes acometidos pelo vírus da influenza pandêmica A (H1N1). Opacidades em vidro fosco foram as alterações mais comuns, observadas em todos os casos de gripe sazonal e em 84,6% dos casos de gripe pandêmica, não havendo diferença significativa entre os grupos. O padrão de pavimentação em mosaico foi mais frequentemente visto na gripe sazonal (70% versus 25%), assim como o padrão de atenuação em mosaico (80% versus 15,8%) e espessamento de septos interlobulares (60% versus 21,1%). Por outro lado, consolidação do espaço aéreo e impactação mucoide foram mais notadas nos pacientes com a gripe pandêmica (84,2% versus 40%, e 52,6% versus 10%, respectivamente). Consolidação com perda de volume pulmonar foi frequente na influenza pandêmica (62,5%). Segundo os autores, a presença de impactação mucoide e perda de volume pulmonar indicam que a infecção pelo vírus influenza A (H1N1) tende a afetar tanto as grandes quanto as pequenas vias aéreas, assim como o parênquima pulmonar, causando uma excessiva produção de muco que resulta em perda de volume e atelectasias. Outros achados comuns aos dois tipos de infecção na série de Tanaka et al.(38) foram nódulos centrolobulares e espessamento de paredes brônquicas. A frequência de nódulos centrolobulares em pacientes acometidos pelo vírus pandêmico (68,4%) nesse trabalho contraria outros estudos que sugeriram a infrequência do acometimento das pequenas vias aéreas por esta infecção(5,18,34). Para os autores, uma das razões pelas quais as opacidades centrolobulares são raramente vistas é o fato de que esta pequena anormalidade possa ser obscurecida em pacientes com doença mais extensa. Uma outra causa para este fato, em concordância com Ketai(46), seria que o acometimento das pequenas vias aéreas se daria precocemente no curso da doença, uma vez que os pacientes do estudo tiveram acesso rápido e fácil ao sistema de saúde. Marchiori et al.(33) correlacionaram os achados tomográficos e histopatológicos de 6 pacientes comprovadamente acometidos pelo vírus A (H1N1) e que evoluíram para óbito, sem evidência clínica, bacteriológica ou histopatológica de infecção bacteriana superposta. Os principais achados tomográficos foram consolidação multifocal ou difusa bilateral (100%), associadas ou não a opacidades em vidro fosco (50%). A característica patológica dominante foi o DAD com formação de membrana hialina (83%), associados a edema, hemorragia, inflamação alveolar e intersticial e bronquiolite. O paciente que sobreviveu por mais tempo apresentou achados de pneumonia em organização na TCAR realizada 15 dias após o primeiro exame. Na correlação com a TCAR, as áreas de consolidação correspondiam, na microscopia, a preenchimento alveolar por edema, exsudato inflamatório ou hemorrágico. As opacidades em vidro fosco refletiram a presença de septos alveolares espessados por inflamação ou edema e/ou preenchimento parcial do espaço aéreo. Derrame pleural, quando observado, é de pequeno a moderado volume(5,18,37). Linfonodomegalias geralmente não são observadas. Há alguns relatos na literatura de pneumomediastino e pneumotórax. Danos no parênquima predispõem à formação de cistos, que podem se romper causando coleções aéreas extra-alveolares. Este ar livre pode dissecar causando pneumotórax ou pneumomediastino(33,44). A semelhança nos padrões radiológicos da infecção pulmonar pelo vírus da influenza A (H1N1) e a SRAG foi ressaltada por alguns autores(18,46). Durante as fases iniciais de ambas as doenças, os vírus causam inflamação alveolar e edema intersticial que resultam em opacidades em vidro fosco como achado radiográfico dominante, muitas vezes com distribuição subpleural(18). Em ambas as doenças os casos graves podem rapidamente exibir características patológicas e radiológicas do desenvolvimento de dano alveolar difuso ou mesmo de SDRA(18). Além disso, nestas doenças não é comum a presença de nódulos centrolobulares, padrão de "árvore em brotamento", escavação e linfonodomegalias mediastinal ou hilar(18). Nos pacientes acometidos pela síndrome da imunodeficiência adquirida, a presença de opacidades em vidro fosco na TCAR é frequentemente encontrada na pneumonia por Pneumocystis jiroveci, devendo ser lembrada também a possibilidade do acometimento pelo vírus influenza A (H1N1)(33,47). A pneumonia viral pelo influenza A (H1N1) complicada por coinfecção bacteriana é um desafio diagnóstico ao radiologista, uma vez que consolidação extensa já pode se manifestar na pneumonia pelo vírus pandêmico. Nestes casos, na dependência da evolução clínica e laboratorial, a possibilidade de infecção bacteriana secundária ou a manifestação pulmonar de SDRA devem ser avaliadas(33). REFERÊNCIAS 1. World Health Organization. Pandemic Influenza A (H1N1). [acessado em 21 de junho de 2011]. Disponível em: http://www.who.int/csr/resources/publications/swineflu/h1n1_donor_032011.pdf. 2. Cao B, Li XW, Mao Y, et al. Clinical features of the initial cases of 2009 pandemic influenza A (H1N1) virus infection in China. N Engl J Med. 2009;361:2507-17. 3. Bautista E, Chotpitayasunondh T, Gao Z, et al. Writing Committee of the WHO Consultation on Clinical Aspects of Pandemic (H1N1) 2009 Influenza. Clinical aspects of pandemic 2009 influenza A (H1N1) virus infection. N Engl J Med. 2010;362:1708-19. 4. Aviram G, Bar-Shai A, Sosna J, et al. H1N1 influenza: initial chest radiographic findings in helping predict patient outcome. Radiology. 2010;255:252-9. 5. Marchiori E, Zanetti G, Hochhegger B, et al. High-resolution computed tomography findings from adult patients with Influenza A (H1N1) virus-associated pneumonia. Eur J Radiol. 2010;74:93-8. 6. Ministério da Saúde. Portal da Saúde. MS alerta sobre condutas frente a casos de gripe. 15 de julho de 2012. [acessado em 8 de setembro de 2012]. Disponível em: http://portal.saude.gov.br/portal/aplicacoes/noticias/default.cfm?pg=dspDetalheNoticia&id_area=124&CO_NOTICIA=14037. 7. Zimmer SM, Burke DS. Historical perspective - Emergence of influenza A (H1N1) viruses. N Engl J Med. 2009;361:279-85. 8. Secretaria Estadual da Saúde de São Paulo. Centro de Vigilância Epidemiológica "Prof. Alexandre Vranjac". Situação epidemiológica da influenza A(H1N1)pdm09 e vigilância sentinela da influenza. [acessado em 10 de setembro de 2012]. Disponível em: http://www.cve.saude.sp.gov.br/htm/resp/pdf/IF12_influ0902.pdf. 9. Ministério da Saúde. Portal da Saúde. Boletim informativo de Influenza: semana epidemiológica 44. 12 de novembro de 2012. [acessado em 16 de novembro de 2012]. Disponível em: http://portalsaude.saude.gov.br/portalsaude/noticia/8100/785/boletim-informativo-de-influenza:-semana-epidemiologica-44.html. 10. Ministério da Saúde. Secretaria de Vigilância em Saúde. Brasil. Protocolo de tratamento de Influenza - 2012. [acessado em 8 de setembro de 2012]. Disponível em: http://portalsaude.saude.gov.br/portalsaude/arquivos/protocolo_de_tratamento_influenza_ms_2012.pdf. 11. Mauad T, Hajjar LA, Callegari GD, et al. Lung pathology in fatal novel human influenza A (H1N1) infection. Am J Respir Crit Care Med. 2010;181:72-9. 12. Shieh WJ, Blau DM, Denison AM, et al. 2009 Pandemic influenza A (H1N1): pathology and pathogenesis of 100 fatal cases in the United States. Am J Pathol. 2010;177:166-75. 13. Gill JR, Sheng ZM, Ely SF, et al. Pulmonary pathologic findings of fatal 2009 pandemic influenza A/H1N1 viral infections. Arch Pathol Lab Med. 2010;134:235-43. 14. Ministério da Saúde. Secretaria de Vigilância em Saúde. Brasil. Departamento de Vigilância Epidemiológica. Guia de vigilância epidemiológica (Série A. Normas e Manuais Técnicos). 7ª ed. Brasília: Ministério da Saúde; 2009. 15. Perez-Padilla R, de la Rosa-Zamboni D, Ponce de Leon S, et al. Pneumonia and respiratory failure from swine-origin influenza A (H1N1) in Mexico. N Engl J Med. 2009;361:680-9. 16. Ministério da Saúde. Secretaria de Vigilância em Saúde. Brasil. Protocolo de manejo clínico e vigilância epidemiológica da Influenza. Versão III. [acessado em 14 de março de 2011]. Disponível em: http://portal.saude.gov.br/portal/arquivos/pdf/protocolo_de_manejo_clinico_05_08_2009.pdf. 17. Cheng VC, To KK, Tse H, et al. Two years after pandemic influenza A/2009/H1N1: what have we learned? Clin Microbiol Rev. 2012;25:223-63. 18. Li P, Zhang JF, Xia XD, et al. Serial evaluation of high resolution computed tomography findings in patients with pneumonia in novel swine origin influenza A (H1N1) virus infection. Br J Radiol. 2012;85:729-35. 19. Bozi LC, Severo A, Marchiori E. Pulmonary metastatic calcification: a case report. Radiol Bras. 2012;45:297-9. 20. Souza RC, Marchiori E, Zanetti G, et al. Spontaneous regression of pulmonary alveolar proteinosis: a case report. Radiol Bras. 2012;45:294-6. 21. Melo ASA, Marchiori E, Capone D. Tomographic and pathological findings in pulmonary sarcoidosis. Radiol Bras. 2011;44:220-4. 22. Moraes CS, Queiroz-Telles F, Marchiori E, et al. Review of lung radiographic findings during treatment of patients with chronic paracoccidioidomycosis. Radiol Bras. 2011;44:20-8. 23. Koenigkam-Santos M, Barreto ARF, Chagas Neto FA, et al. Neuroendocrine tumors of the lung: major radiologic findings in a series of 22 histopathologically confirmed cases. Radiol Bras. 2012;45:191-7. 24. Cerci JJ, Takagaki TY, Trindade E, et al. 2-[18F]-fluoro-2-deoxy-D-glucose positron-emission tomography is cost-effective in the initial staging of non-small cell lung cancer patients in Brazil. Radiol Bras. 2012;45:198-204. 25. Almeida LA, Barba MF, Moreira FA, et al. Computed tomography findings of pulmonary tuberculosis in adult AIDS patients. Radiol Bras. 2011;44:13-9. 26. Mohan K, McShane J, Page R, et al. Impact of 18F-FDG PET scan on the prevalence of benign thoracic lesions at surgical resection. Radiol Bras. 2011;44:279-82. 27. Chojniak R, Pinto PNV, Ting CJ, et al. Computed tomography-guided transthoracic needle biopsy of pulmonary nodules. Radiol Bras. 2011;44:315-20. 28. Rodrigues RS, Capone D, Ferreira Neto AL. High-resolution computed tomography findings in pulmonary Langerhans cell histiocytosis. Radiol Bras. 2011;44:225-32. 29. Franquet T. Imaging of pulmonary viral pneumonia. Radiology. 2011;260:18-39. 30. Kim EA, Lee KS, Primack SL, et al. Viral pneumonias in adults: radiologic and pathologic findings. Radiographics. 2002;22(Spec No):S137-S149. 31. Heussel CP, Kauczor HU, Heussel G, et al. Early detection of pneumonia in febrile neutropenic patients: use of thin-section CT. AJR Am J Roentgenol. 1997;169:1347-53. 32. Marchiori E, Zanetti G, Hochhegger B, et al. High-resolution computed tomography findings in a patient with Influenza A (H1N1) virus-associated pneumonia [Letter to the Editor]. Br J Radiol. 2010;83:85-6. 33. Marchiori E, Zanetti G, Fontes CA, et al. Influenza A (H1N1) virus-associated pneumonia: high-resolution computed tomography-pathologic correlation. Eur J Radiol. 2011;80:e500-4. 34. Marchiori E, Zanetti G, Mano CM, et al. Follow-up aspects of Influenza A (H1N1) virus-associated pneumonia: the role of high-resolution computed tomography in the evaluation of the recovery phase. Korean J Radiol. 2010;11:587. 35. Marchiori E, Zanetti G, Mano CM. Swine-origin Influenza A (H1N1) viral infection: small airways disease. AJR Am J Roentgenol. 2010;195:W317. 36. Grieser C, Goldmann A, Steffen IG, et al. Computed tomography findings from patients with ARDS due to Influenza A (H1N1) virus-associated pneumonia. Eur J Radiol. 2012;81:389-94. 37. Rodrigues RS, Marchiori E, Bozza FA, et al. Chest computed tomography findings in severe influenza pneumonia occurring in neutropenic cancer patients. Clinics (Sao Paulo). 2012;67:313-8. 38. Tanaka N, Emoto T, Suda H, et al. High-resolution computed tomography findings of influenza virus pneumonia: a comparative study between seasonal and novel (H1N1) influenza virus pneumonia. Jpn J Radiol. 2012;30:154-61. 39. Marchiori E, Zanetti G, D'Ippolito G, et al. Swine-origin influenza A (H1N1) viral infection: thoracic findings on CT. AJR Am J Roentgenol. 2011;196:723-8. 40. Marchiori E, Zanetti G, D'Ippolito G. Crazy-paving pattern on HRCT of patients with H1N1 pneumonia. Eur J Radiol. 2011;80:573-5. 41. Toufen C Jr, Costa EL, Hirota AS, et al. Follow-up after acute respiratory distress syndrome caused by influenza a (H1N1) virus infection. Clinics (Sao Paulo). 2011;66:933-7. 42. Marchiori E, Hochhegger B, Zanetti G. Organising pneumonia as a late abnormality in influenza A (H1N1) virus infection. Br J Radiol. 2012;85:841. 43. Marchiori E, Zanetti G, Ferreira Francisco FA, et al. Organizing pneumonia as another pathological finding in pandemic influenza A (H1N1). Med Intensiva. 2012 Oct 4. doi: 10.1016/j.medin. 2012.08.002. 44. Elicker BM, Schwartz BS, Liu C, et al. Thoracic CT findings of novel influenza A (H1N1) infection in immunocompromised patients. Emerg Radiol. 2010;17:299-307. 45. Verrastro CGY, Abreu Junior L, Hitomi DZ, et al. Manifestations of infection by the novel influenza A (H1N1) virus at chest computed tomography. Radiol Bras. 2009;42:343-8. 46. Ketai LH. Conventional wisdom: unconventional virus. AJR Am J Roentgenol. 2009;193:1486-7. 47. Marchiori E, Zanetti G, Hochhegger B, et al. High-resolution computed tomography findings in a patient HIV-positive with swine-origin Influenza A (H1N1) virus-associated pneumonia. Br J Radiol. 2010;83:179. 1. Especialização, Mestranda em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 2. Doutora, Médica do Serviço de Radiodiagnóstico da Universidade Federal do Rio de Janeiro (UFRJ) e do Instituto D'Or de Pesquisa, Rio de Janeiro, RJ, Brasil 3. Doutora, Médica do Serviço de Radiodiagnóstico da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 4. Doutora, Professora da Faculdade de Medicina de Petrópolis, Petrópolis, RJ, Brasil 5. Doutor, Professor Associado de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Edson Marchiori Rua Thomaz Cameron, 438, Valparaíso Petrópolis, RJ, Brasil, 25.685.120 E-mail: edmarchiori@gmail.com Recebido para publicação em 4/1/2013. Aceito, após revisão, em 14/3/2013. Trabalho realizado na Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554