Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 46 nº 3 - Maio / Jun. of 2013
Vol. 46 nº 3 - Maio / Jun. of 2013
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Rodrigo da Fonseca Monjardim1; Danilo Manuel Cerqueira Costa1; Ricardo Francisco Tavares Romano1; Priscila Silveira Salvadori1; Jaime de Vargas Conde dos Santos1; Augusto Castelli Von Atzingen2; David Carlos Shigueoka3; Giuseppe D'Ippolito4 |
|
|
Descritores: Fígado gorduroso; Esteatose hepática; Hepatopatias; Tomografia; Tomografia computadorizada multidetectores; Meios de contraste. |
|
|
Resumo: INTRODUÇÃO
A esteatose hepática (EH) vem sendo considerada uma afecção clinicamente significativa em razão do aumento do risco de progressão para alterações necroinflamatórias, mesmo quando não é associada ao consumo alcoólico, conhecida como esteatohepatite não alcoólica (EHNA), e para cirrose(1). Dados americanos estimam que cerca de 40 milhões de adultos sejam acometidos pela EHNA(1). Outros estudos indicam que a prevalência da EH na população em geral pode chegar a 24%(2,3). Quando a EHNA é diagnosticada precocemente, o seu tratamento pode evitar a progressão para um estágio final e irreversível de cirrose hepática(4). Além disso, os pacientes com EH podem se desqualificar como candidatos a doação para transplante hepático intervivos pelo fato de o fígado esteatótico ser mais vulnerável a injuria por procedimentos anestésicos e reperfusão isquêmica(5-7). Até 30% dos candidatos a doação hepática são recusados por apresentarem EH(8). A biópsia hepática percutânea tem sido o padrão de referência para o diagnóstico e graduação da EH(4), mas trata-se de um método invasivo e com possíveis complicações. Por outro lado, métodos por imagem como a ultrassonografia (US), a tomografia computadorizada (TC) e a ressonância magnética (RM) têm sido extensivamente utilizados, não somente para a avaliação abrangente de doenças abdominais, mas especificamente no diagnóstico da EH(1,4,9). A US, mesmo sendo amplamente disponível e sem contraindicações, utiliza critérios subjetivos e pouco reprodutíveis, que não permitem uma quantificação confiável da esteatose(4). A RM vem sendo considerada o método não invasivo mais eficaz para o diagnóstico da EH(4), todavia, é um procedimento caro e ainda pouco acessível no nosso meio. ATC, por sua vez, tem sido o meio diagnóstico mais largamente utilizado para a avaliação das doenças abdominais e uma importante ferramenta no diagnóstico da EH(10,11). Para isso, vêm contribuindo diversos fatores, entre eles o desenvolvimento de aparelhos de TC com múltiplos detectores (TCMD), o que permite realizar exames mais rápidos, com maior comodidade para o paciente e com elevada acurácia diagnóstica. Por outro lado, os efeitos nocivos da radiação ionizante, inerentes ao método, têm sido fonte de preocupação(12,13). Entre as diversas estratégias de redução da dose de radiação em exames de TC, tem sido recomendada uma atenta revisão dos protocolos de exame, no sentido de se evitar fases de aquisição desnecessárias(14). A fase de contrastação portal, realizada entre 60 e 80 segundos após a injeção intravenosa do meio de contraste, é considerada isoladamente a mais útil na grande maioria das indicações de TC de abdome superior, desde que se garanta a confiabilidade e a acurácia diagnóstica do método(9,14,15), levando a uma tendência de se abolir a fase sem o meio de contraste. Por outro lado, os critérios tomográficos para o diagnóstico de EH dependem, segundo diversos autores, dessa fase do exame(10,11,16). Esse fato estimulou a execução de estudos que procuraram estabelecer o valor da fase portal, isoladamente, no diagnóstico da EH(9,10,17). O mais recente desses estudos demonstrou que ao se utilizar apenas a fase portal é possível obter acurácia semelhante à obtida com os critérios adotados na TC sem contraste intravenoso no diagnóstico e quantificação da EH(9). Os autores propuseram uma equação matemática que leva em consideração a média de densidade da veia porta e da aorta a partir de medidas obtidas em três locais distintos e a média de densidade do fígado, obtida por oito medidas (duas para cada um dos quatro segmentos do lobo direito). Essa estratégia, apesar de ter mostrado bons resultados, consome bastante tempo do examinador, tornando o método algo cansativo e certamente mais complexo que as simples medidas obtidas com a fase sem meio de contraste. Além disso, as diversas variáveis envolvidas no processo, tais como concentração e velocidade de injeção do meio de contraste e tempo de aquisição das imagens, podem influenciar nos resultados(16), levando à necessidade de se validar os resultados previamente obtidos e comprovar a utilidade de um método simplificado para o diagnóstico da EH pela TC com o meio de contraste intravenoso. Considerando-se a ocorrência de EH, o objetivo deste estudo foi comparar a capacidade diagnóstica da fase portal com método de cálculo simplificado, em relação à fase sem contraste da TC de abdome. MATERIAIS E MÉTODOS Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Instituição, tendo sido dispensada a aplicação do termo de consentimento livre e esclarecido. Os exames de TC de abdome foram analisados, independentemente da indicação clínica, retrospectivamente, no período de 21/5/2011 a 1/2/2012, até atingir o número arbitrariamente estipulado de 100 pacientes com EH, denominados "casos", e 50 sem EH, denominados "controles", utilizando-se a TC sem contraste intravenoso como teste de referência. No grupo de "casos", 49 eram do sexo masculino (média de idade de 51,6 anos ± 14,3) e 51 eram do sexo feminino (média de idade de 54,7 anos ± 14,0). Entre os "controles", 26 eram do sexo masculino (média de idade de 57,6 anos ± 18,2) e 24 eram do sexo feminino (média de idade de 53,2 anos ± 18,4). Foram incluídos pacientes maiores que 18 anos com pedido espontâneo de TC de abdome com uso de meio de contraste intravenoso, sendo excluídos pacientes com: a) fígado heterogêneo; b) inúmeras lesões hepáticas em ambos os lobos; c) injeção inadequada do meio de contraste (por exemplo: extravasamento do meio de contraste); d) exames com artefatos (por exemplo: artefatos de respiração) que tornariam as medidas de densidade imprecisas ou não confiáveis; e) exames incompletos. Os critérios de não inclusão foram: a) pacientes menores que 18 anos; b) pacientes com indicação de TC de abdome sem o meio de contraste; c) pacientes com contraindicação ao meio de contraste iodado; d) pacientes esplenectomizados. Os exames foram realizados em equipamento de TC modelo Brilliance 64® (Philips Medical Systems; Best, Holanda). Os exames foram realizados com aquisição volumétrica, antes e 70 segundos após a injeção intravenosa do meio de contraste iodado hidrossolúvel, por meio de bomba injetora automática, na velocidade de 3-4 ml/s, em quantidade de 1,5-2 ml/kg de peso, com volume máximo de 150 ml. Os parâmetros técnicos utilizados nos exames de TC foram: a) colimação de 64 × 0,625 mm; b) tempo de rotação do gantry = 0,5 s; c) reconstrução com 1 mm e 3 mm de espessura; d) pitch = 0,891; e) 120 kVp; f) mAs dependente da modulação automática da dose de radiação (DoseRight ACS®). Todos os exames foram interpretados em estação de trabalho Synapse® PACS/3D (FujiFilm; EUA) por um único observador, com três anos de experiência em diagnóstico por imagem. No momento da interpretação, nenhum dos dados clínicos ou laboratoriais dos pacientes estava disponível. A diferenciação entre os dois grupos de pacientes foi realizada com base no critério diagnóstico de EH estabelecido para a TC sem o meio de contraste intravenoso, utilizando-se a análise das atenuações hepática e esplênica dadas em unidades Hounsfield (UH), considerando-se que atenuação hepática menor que a atenuação esplênica indica o diagnóstico de esteatose(4,17,18). O diagnóstico de EH pela TC com meio de contraste intravenoso foi obtido com base no método proposto por Kim et al.(9), utilizando a fórmula [L - 0,3 × (0,75 × P + 0,25 × A)] / 0,7, onde L é a atenuação hepática, P a atenuação da veia porta, A a atenuação da aorta abdominal. As medidas foram realizadas na fase de contrastação portal, isto é, entre 60 e 80 segundos após o início da injeção intravenosa do meio de contraste. No estudo original, as variáveis L, P e A foram obtidas a partir das médias de oito medidas do fígado, três da veia porta e três da aorta, respectivamente, o que torna o processo bastante trabalhoso e pouco prático. Alguns estudos vêm propondo que a utilização de uma única medida de atenuação hepática não apresenta diferença significativa em relação à média obtida após múltiplas medições(11,19). Com essa premissa e com o objetivo de validar um método simplificado de diagnóstico de EH a partir de fase portal isoladamente, foi realizado, inicialmente, um estudo piloto com cinco pacientes sem EH (atenuação hepática maior que a esplênica na fase sem contraste), cinco com EH leve (diferença de atenuação hepática e esplênica maior que -10 UH) e cinco com EH acentuada (diferença de atenuação hepática e esplênica menor que -10 UH)(4), comparando os resultados obtidos a partir da aplicação da fórmula supracitada com todas as médias das variáveis (método original) com uma única medida para cada variável (método simplificado). A análise do projeto piloto foi realizada por dois pesquisadores independentes, cegos em relação aos resultados da fase sem contraste, tendo sido encontrada concordância praticamente perfeita entre o método de cálculo original e o simplificado (kappa = 0,842; p = 0,001). Os resultados iniciais obtidos justificaram que o presente estudo fosse continuado aplicando-se a fórmula previamente proposta(9), com uma única medida para cada sítio anatômico (lobo hepático direito, veia porta e aorta), simplificando-se assim o método (Figura 1). 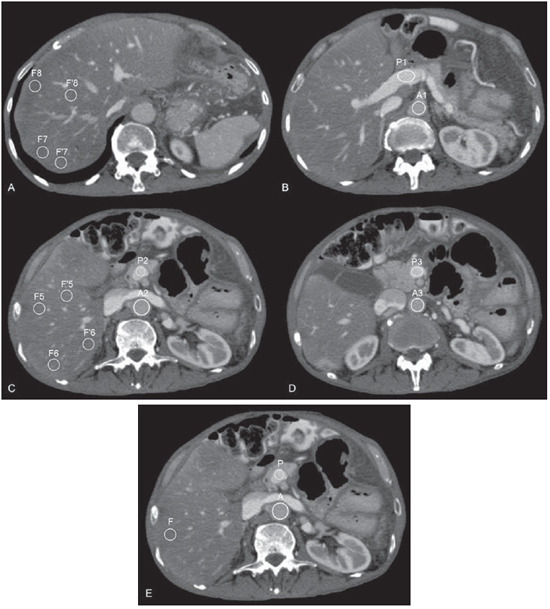 Figura 1. Medidas de atenuação necessárias para o cálculo do método original proposto por Kim et al.(9) (A–D) e do método simplificado proposto no presente estudo (E). Foi proposto originalmente por Kim et al.(9) que os resultados da sua fórmula < 104 UH estão associados a graus de esteatose maiores que 5%. Portanto, no nosso estudo, usamos como critério diagnóstico para a EH na fase portal o ponto de corte < 104 UH, indicativo de esteatose maior que 5%(20-23). A obtenção dos valores de densidade foi realizada medindo-se a atenuação hepática por região de interesse (ROI) circular, com 1,5 cm2(9), locado no lobo hepático direito(4), evitando-se os vasos e eventuais lesões focais, tanto para os cálculos na fase sem contraste como na fase portal. Dessa mesma forma, foi calculada a atenuação esplênica. As medidas da atenuação na veia porta e aorta foram obtidas ao nível do tronco celíaco, utilizando-se ROIs que ocupavam a maior área possível do lúmen vascular. Os valores da atenuação de L, P e A obtidos na análise foram inseridos numa planilha do Excel® pré-programada para o cálculo automático da fórmula. Para fins de análise estatística, os pacientes foram categorizados em "com esteatose" e "sem esteatose", tanto para a fase sem contraste quanto para a fase portal, e calculados sensibilidade, especificidade, valores preditivos positivos e negativos, além de taxas de falso-positivos e falso-negativos, considerando-se a avaliação obtida pela TC sem contraste como o padrão de referência. RESULTADOS Aplicando-se o método proposto para a fase portal, dos 150 pacientes analisados, 132 tiveram resultados menores que 104 UH, preenchendo critérios de EH, e 18 tiveram resultados maiores que 104 UH, sendo considerados negativos, isto é, sem EH. O cálculo da acurácia da fase portal com o método simplificado proposto utilizando-se a fase sem contraste como padrão de referência permitiu encontrar os seguintes resultados: sensibilidade de 100%, especificidade de 36%, valor preditivo negativo de 100% e valor preditivo positivo de 75,8%. A taxa de falso-positivos foi 64%. Não foram encontrados falso-negativos. DISCUSSÃO Vários estudos têm sido desenvolvidos por autores nacionais abordando a importância dos métodos de imagem na avaliação das doenças hepáticas(24-28), sendo que o diagnóstico tomográfico da EH é tradicionalmente realizado utilizando-se critérios aplicados à fase sem contraste(10,11,16). No entanto, em um cenário de crescente preocupação com os efeitos nocivos da radiação ionizante, e considerando-se a oportunidade de se obter o diagnóstico de EH por meio da fase de contrastação portal aliado ao fato de essa fase ser a mais útil na maioria das indicações de TC de abdome(9,14,15), torna particularmente interessante a possibilidade de se confirmar o valor da TC com contraste na triagem de pacientes com EH. Procurando definir um critério diagnóstico de EH pela TC com meio de contraste intravenoso, Kim et al.(9) propuseram uma equação matemática que considera a densidade no fígado, na veia porta e na aorta. Essa forma de cálculo tende a ser menos dependente em relação a fatores potencialmente limitantes, como diferenças na velocidade de injeção, quantidade, concentração ou tipo de contraste utilizado, problemas que estudos anteriores com o mesmo propósito apresentaram(10,15,16). Em relação às medidas de atenuação previamente utilizadas(9), propomos a utilização de uma única medida para cada variável, simplificando assim o método e permitindo resultados semelhantes aos obtidos pelos autores originais. Ao inserirmos os dados obtidos a partir dos valores de atenuação no fígado, aorta e veia porta em uma planilha do programa Excel®, foi possível obter de forma automática e pré-programada o resultado, o que já vem sendo utilizado pelos residentes da instituição, com boa aceitação e bons resultados. Novos métodos de análise da fase portal com o objetivo de avaliar EH estão sendo estudados, por exemplo, a definição de áreas de realce anômalo na fossa da vesícula biliar ou na periferia do segmento hepático IV, com especificidade de 100% para o diagnóstico de EH(29). Combinando método ao aqui proposto, poderíamos elevar a sua especificidade, aumentando o valor da fase portal no diagnóstico da EH. Essa combinação de critérios diagnósticos poderá ser avaliada em estudos futuros. Nosso estudo possui uma série de limitações. Por tratar-se de um estudo retrospectivo, não foi possível garantir que todos os exames tenham seguido rigorosamente o protocolo definido e a calibração do aparelho para aferição das medidas de atenuação, e além disso, a proporção de pacientes com EH é superior à prevalência na população e pode ter elevado o valor preditivo positivo do método. O padrão de referência adotado para o cálculo da acurácia não foi a biópsia hepática, mas a TC na fase sem contraste, sabidamente menos eficaz que a avaliação histológica(4). Por outro lado, diversos trabalhos têm empregado método semelhante(9,10,15-17) e o nosso objetivo não foi propor um método de escolha para o diagnóstico não invasivo da EH, e sim demonstrar que ao se utilizar a fase portal é possível identificar pacientes com EH, sem termos tido falso-negativos, o que permitiria evitar o uso da fase sem contraste na TC de abdome em exames de rotina. Ademais, em pacientes em pesquisa específica de EH e com o propósito de quantificá-la, entendemos, assim como outros autores, que a RM é o método mais eficaz(4). Com os resultados obtidos, podemos concluir que a TC de abdome na fase portal permite obter dados úteis como método de triagem para EH, quando comparada à fase sem contraste, tendo sido possível afastar o diagnóstico da doença com elevada sensibilidade e valor preditivo negativo. Por outro lado, essa mesma afirmação não pode ser feita em relação à confirmação diagnóstica da EH em razão da baixa especificidade do método, com elevada taxa de falso-positivos. É possível que a combinação de critérios adotados a partir da avaliação da fase portal permita elevar a especificidade e a acurácia do método para o diagnóstico da EH. REFERÊNCIAS 1. Qayyum A, Chen DM, Breiman RS, et al. Evaluation of diffuse liver steatosis by ultrasound, computed tomography, and magnetic resonance imaging: which modality is best? Clin Imaging. 2009;33:110-5. 2. Ong JP, Younossi ZM. Epidemiology and natural history of NAFLD and NASH. Clin Liver Dis. 2007;11:1-16. 3. Lazo M, Clark JM. The epidemiology of nonalcoholic fatty liver disease: a global perspective. Semin Liver Dis. 2008;28:339-50. 4. Ma X, Holalkere NS, Kambadakone RA, et al. Imaging-based quantification of hepatic fat: methods and clinical applications. Radiographics. 2009;29:1253-77. 5. Nikeghbalian S, Nejatollahi SM, Salahi H, et al. Does donor's fatty liver change impact on early mortality and outcome of liver transplantation. Transplant Proc. 2007;39:1181-3. 6. Perez-Daga JA, Santoyo J, Suárez MA, et al. Influence of degree of hepatic steatosis on graft function and postoperative complications of liver transplantation. Transplant Proc. 2006;38:2468-70. 7. Vauthey JN, Pawlik TM, Ribero D, et al. Chemotherapy regimen predicts steatohepatitis and an increase in 90-day mortality after surgery for hepatic colorectal metastases. J Clin Oncol. 2006;24:2065-72. 8. Tsang LL, Chen CL, Huang TL, et al. Preoperative imaging evaluation of potential living liver donors: reasons for exclusion from donation in adult living donor liver transplantation. Transplant Proc. 2008;40:2460-2. 9. Kim DY, Park SH, Lee SS, et al. Contrast-enhanced computed tomography for the diagnosis of fatty liver: prospective study with same-day biopsy used as the reference standard. Eur Radiol. 2010;20:359-66. 10. Kodama Y, Ng CS, Wu TT, et al. Comparison of CT methods for determining the fat content of the liver. AJR Am J Roentgenol. 2007;188:1307-12. 11. Pickhardt PJ, Park SH, Hahn L, et al. Specificity of unenhanced CT for non-invasive diagnosis of hepatic steatosis: implications for the investigation of the natural history of incidental steatosis. Eur Radiol. 2012;22:1075-82. 12. Kalra MK, Maher MM, Toth TL, et al. Strategies for CT radiation dose optimization. Radiology. 2004;230:619-28. 13. Wolbarst AB, Wiley AL Jr, Nemhauser JB, et al. Medical response to a major radiologic emergency: a primer for medical and public health practitioners. Radiology. 2010;254:660-77. 14. Iannaccone R, Laghi A, Catalano C, et al. Hepatocellular carcinoma: role of unenhanced and delayed phase multi-detector row helical CT in patients with cirrhosis. Radiology. 2005;234:460-7. 15. Jacobs JE, Birnbaum BA, Shapiro MA, et al. Diagnostic criteria for fatty infiltration of the liver on contrast-enhanced helical CT. AJR Am J Roentgenol. 1998;171:659-64. 16. Johnston RJ, Stamm ER, Lewin JM, et al. Diagnosis of fatty infiltration of the liver on contrast enhanced CT: limitations of liver-minus-spleen attenuation difference measurements. Abdom Imaging. 1998;23:409-15. 17. Panicek DM, Giess CS, Schwartz LH. Qualitative assessment of liver for fatty infiltration on contrast-enhanced CT: is muscle a better standard of reference than spleen? J Comput Assist Tomogr. 1997;21:699-705. 18. Piekarski J, Goldberg HI, Royal SA, et al. Difference between liver and spleen CT numbers in the normal adult: its usefulness in predicting the presence of diffuse liver disease. Radiology. 1980;137:727-9. 19. Speliotes EK, Massaro JM, Hoffmann U, et al. Liver fat is reproducibly measured using computed tomography in the Framingham Heart Study. J Gastroenterol Hepatol. 2008;23:894-9. 20. Brunt EM. Pathology of fatty liver disease. Mod Pathol. 2007;20 Suppl 1:S40-8. 21. Hübscher SG. Histological assessment of non-alcoholic fatty livre disease. Histopathology. 2006;49:450-65. 22. Castéra L, Hézode C, Roudot-Thoraval F, et al. Worsening of steatosis is an independent factor of fibrosis progression in untreated patients with chronic hepatitis C and paired liver biopsies. Gut. 2003;52:288-92. 23. Fartoux L, Chazouillères O, Wendum D, et al. Impact of steatosis on progression of fibrosis in patients with mild hepatitis C. Hepatology. 2005;41:82-7. 24. Matsuoka MW, Oliveira IRS, Widman A, et al. Contribuição da ultrassonografia para o diagnóstico das alterações histopatológicas presentes na hepatite C crônica, com ênfase na esteatose hepática. Radiol Bras. 2011;44:141-6. 25. Borges VF, Diniz ALD, Cotrim HP, et al. Dopplerfluxometria da veia hepática em pacientes com esteatose não alcoólica. Radiol Bras. 2011;44:1-6. 26. Burke LMB, Vachiranubhap B, Tannaphai P, et al. Contrast enhancement of liver lesions in cirrhotic patients: a single institution crossover comparative study of two MR contrast agents. Preliminary results. Radiol Bras. 2011;44:147-50. 27. Sousa JPLBA, Bekhor D, Saito Filho CF, et al. Perfusão por tomografia computadorizada do abdome: aplicações clínicas, princípios e técnica do exame. Radiol Bras. 2012;45:39-45. 28. Leão ARS, Sales DM, Santos JEM, et al. Avaliação do volume de fluxo portal em pacientes esquistossomóticos: estudo comparativo entre ressonância magnética e ultrassom Doppler. Radiol Bras. 2010;43:355-61. 29. Lawrence DA, Oliva IB, Israel GM. Detection of hepatic steatosis on contrast-enhanced CT images: diagnostic accuracy of identification of areas of presumed focal fatty sparing. AJR Am J Roentgenol. 2012;199:44-7. 1. Médicos Residentes do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. 2. Médico Radiologista, Pós-graduando nível Doutorado do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. 3. Professor Adjunto do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. 4. Livre-docente, Professor Adjunto do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. Endereço para correspondência: Dr. Giuseppe D'Ippolito Departamento de Diagnóstico por Imagem - EPM-Unifesp Rua Napoleão de Barros, 800, Vila Clementino São Paulo, SP, Brasil, 04024-002 E-mail: giuseppe_dr@uol.com.br Recebido para publicação em 30/10/2012. Aceito, após revisão, em 22/1/2013. * Trabalho realizado no Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554