INTRODUÇAO
A expressão colangiopancreatografia por ressonância magnética (CPRM) pode ser estendida a uma série de técnicas de aquisição cuja característica principal é a de explorar o longo tempo de relaxamento T2 dos líquidos contidos no interior da árvore biliopancreática para a formação da imagem(1). Como regra, estudos de CPRM são realizados utilizando-se tanto aquisições em apneia (CPRM 2D) quanto com sincronização respiratória (CPRM 3D). Essa estratégia procura combinar as vantagens inerentes a cada uma das duas modalidades, tais como o curto tempo de aquisição das sequências 2D e a maior resolução espacial obtida com as técnicas 3D(2,3).
Em virtude da sua natureza projecional, o sinal do líquido gastrintestinal pode se sobrepor a árvore biliopancreática e limitar a qualidade diagnóstica do exame(4). O sinal do líquido gastrintestinal pode ser abolido ou reduzido com o uso de três estratégias: por meio de jejum prolongado, pela ingestão de contrastes orais negativos(5) ou por meio da redução farmacológica da secreção gástrica(6).
Os contrastes negativos consistem em soluções paramagnéticas que promovem a redução da intensidade do sinal do líquido gastrintestinal por encurtarem o tempo de relaxamento T2 nos exames de ressonância magnética (RM). Neste grupo de substâncias incluem-se desde produtos industrializados contendo ferro(7) até sucos em que a concentração mineral das frutas (por exemplo: o manganês no abacaxi) é suficiente para reduzir o tempo de relaxamento T2(8,9). Os meios de contrastes paramagnéticos para uso oral são caros, não palatáveis e podem ocasionar efeitos colaterais(7). Quanto aos sucos, diferenças na concentração mineral necessária para o efeito de supressão do sinal do líquido gastrintestinal podem ocorrer no preparo doméstico das soluções, bem como nas soluções industrializadas, tornando-os ineficazes.
Por outro lado, substâncias farmacológicas como a ranitidina são baratas, disponíveis, de simples administração, têm baixa incidência de efeitos colaterais(10) e não carecem de prescrição médica para a sua compra, tendo sido demonstrado, em pelo menos um estudo, a sua contribuição na avaliação das vias biliares por meio da RM, por reduzir o sinal do líquido gastroduodenal e minimizar a sua interferência na visualização da árvore biliopancreática(6). Por esta razão, decidimos neste estudo confirmar o valor do uso da ranitidina administrada por via oral na avaliação da árvore biliopancreática em exames de CPRM.
MATERIAIS E MÉTODOS
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Instituição. Termo de consentimento livre e informado foi obtido de todos os participantes do estudo.
Foi realizado um estudo prospectivo, transversal, observacional e autopareado. A proposta para a realização da CPRM foi aberta para voluntários hígidos, conscientes, colaborativos, maiores de 18 anos, que concordassem em participar da pesquisa. Qualquer contraindicação relativa ou absoluta à realização da RM (por exemplo: marca-passo cardíaco, clipes de aneurisma cerebral, implantes cocleares, claustrofobia), alergia prévia ao medicamento e o uso de medicações com ação sinérgica à ranitidina (por exemplo: diazepam, cetoconazol, fenitoína, claritromicina e varfarina) foram assumidos como critérios de não inclusão.
Os exames de CPRM foram realizados em 32 voluntários, sendo 12 mulheres e 20 homens, com idade entre 27 e 63 anos, média de 32 anos, não tendo havido exclusões.
Preparo dos pacientes
Foram realizadas as seguintes etapas:
Primeira etapa - CPRM sem nenhuma medicação e após pelo menos 4 horas de jejum, adquirindo-se imagens com técnica 3D e 2D.
Segunda etapa - CPRM após a ingestão de meio de contraste negativo via oral, adquirindo-se imagens com técnica 3D e 2D. O meio de contraste negativo utilizado foi uma solução de 5 ml de gadolínio em 75 ml de água, conforme já descrito na literatura(5).
Estas duas etapas foram realizadas no mesmo dia.
Terceira etapa - CPRM após pelo menos 4 horas de jejum e 12 horas após a ingestão de 300 mg de ranitidina, em razão do seu pico de ação, e adquirindo-se imagens com técnica 3D e 2D. O tempo médio entre as duas primeiras etapas e a terceira foi de 30 dias, variando entre 21 e 35 dias.
Equipamento e técnica
Todos os exames foram realizados em aparelho de RM operando em campo magnético de 1,5 T, modelo Gyroscan Intera
®(Release 13) (Philips Medical Systems; Best, Holanda) equipado com bobina de sinergia (
sinergy sense body) para recepção e emissão do sinal.
Os parâmetros de aquisição das imagens de CPRM foram idênticos nas três etapas, ou seja:
CPRM 3D: tempo de repetição (TR) = 1433; tempo de eco (TE) = 650; NEX = 1; matriz = 256 x 205; espessura de corte = 1,6 mm; intervalo (
gap) = 0,8 mm com 80% de sobreposição; fator turbo (FT) = 144;
flip angle de 90 graus;
field of view (FOV) = 512 x 512; espaço entre os ecos de 9,9 ms; largura de banda de 723 Hz; e aquisições durante a fase expiratória final utilizando-se sincronização respiratória (SR). O tempo médio de duração do exame foi de 5 minutos.
CPRM 2D: TR = 8000; TE = 800; NEX = 1; matriz = 228 x 182; espessura de corte = 4,0 cm; FT = 182;
flip angle de 90 graus; FOV = 380 x 380; largura de banda de 320 Hz; 6 aquisições coronais radiais centradas no colédoco, anguladas em 15 graus e obtidas durante a apneia. O tempo gasto para cada uma das aquisições (
slab de 4,0 cm) foi de 2 segundos, e para a sequência toda, inferior a 30 segundos.
Avaliação dos exames
Os exames foram avaliados de forma independente e randômica por três observadores diferentes (observador 1, com 10 anos de experiência em radiologia geral; observador 2, com 4 anos de experiência em radiologia geral e 2 anos de experiência em radiologia abdominal; observador 3, com 4 anos de experiência em radiologia geral). Não houve análise conjunta ou consenso das avaliações discordantes entre os observadores.
As imagens foram armazenadas em formato DICOM e dispostas em monitores de alta resolução com o uso da plataforma Osirix
®. Para evitar o viés de aprendizado (
learning bias), a identificação do paciente e da técnica de supressão hídrica utilizada era substituída por códigos.
A CPRM 3D foi avaliada inicialmente, utilizando-se em conjunto os cortes milimétricos das imagens fonte e as reconstruções multiplanares com a técnica de intensidade de projeção máxima (MIP -
maximum intensity projection). Os observadores tinham total liberdade de executar reconstruções em outros planos, variar a janela da imagem conforme a sua preferência, assim como alterar a espessura das reconstruções com a técnica MIP. Cada sessão de avaliação foi intercalada por pelo menos duas semanas de intervalo.
Os exames com a aquisição 2D foram avaliados posteriormente. De maneira semelhante às sessões anteriores, os observadores tinham liberdade de modificar os parâmetros de imagem conforme lhes conviesse.
Parâmetros de avaliação
Foram avaliados os seguintes segmentos ductais:
- Ramo hepático principal direito: definido como o segmento interposto entre a confluência hilar ductal e a sua ramificação de primeira ordem.
- Ramo hepático principal esquerdo: definido como o segmento interposto entre a confluência hilar ductal e a sua ramificação de primeira ordem.
- Ducto hepático comum: segmento interposto entre a confluência hilar dos ramos principais direito e esquerdo e a inserção do cístico.
- Ducto colédoco: definido como o segmento ductal localizado abaixo do ducto cístico. O colédoco foi arbitrariamente definido em pancreático (2 cm acima de sua desembocadura no duodeno) e suprapancreático (o segmento restante).
- Ducto cístico: estrutura ductal estendendo-se do colo vesicular até o colédoco.
- Ducto pancreático cefálico: até 5 cm da junção biliopancreática(11).
- Ducto pancreático corporal: entre 5 e 7 cm da junção biliopancreática(11).
- Ducto pancreático caudal: após 7 cm da junção biliopancreática(11).
- Vesícula biliar.
Avaliação qualitativa dos exames
O grau de supressão do sinal líquido gastrintestinal foi avaliado de acordo com a seguinte escala:
1 - O sinal hiperintenso presente no estômago e no duodeno torna impossível a análise da estrutura.
2 - O sinal hiperintenso presente no estômago e no duodeno impede parcialmente a análise da estrutura.
3 - O sinal hiperintenso presente no estômago e no duodeno não impede a análise da estrutura.
4 - Não há sinal presente no interior do estômago e do duodeno.
A visualização ductal foi avaliada de acordo com a seguinte escala:
0 - O ducto não é visualizado.
1 - O ducto é parcialmente visualizado e definido.
2 - O ducto é bem visualizado e definido.
Análise estatística
Foi utilizada a soma dos escores dos três avaliadores para a variável
visualização (variando entre 0 e 2), de modo que o valor do escore fosse no mínimo 0 e no máximo 6. O mesmo foi feito para avaliar
o grau de supressão do líquido gastrintestinal (variando entre 1 e 4), em que a soma dos escores atribuída pelos três observadores podia variar entre 3 e 12. Este método foi aplicado tanto paras as duas formas de aquisição de imagem (2D e 3D) quanto para as três técnicas de supressão do sinal hídrico gastroduodenal (jejum, ranitidina e contrate via oral).
Foi utilizada ANOVA com dois fatores para verificar diferenças significantes entre técnicas e aquisição (2D e 3D). No caso de significância estatística, foi utilizado o método de comparações múltiplas de Tukey.
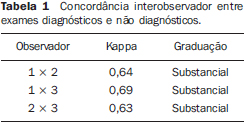
A concordância interobservadores foi avaliada pelo teste kappa (κ). Valores de κ menores do que 0,4 indicaram baixa concordância; entre 0,41e 0,60 indicaram concordância moderada; entre 0,61 e 0,80 indicaram concordância substancial; acima de 0,81 indicaram concordância excelente(12).
O nível de significância estabelecido foi
p > 0,05.
RESULTADOS
Concordância interobservador
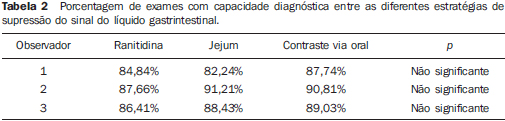
A concordância entre os três observadores para o grau de supressão do sinal líquido gastrintestinal foi considerada substancial, variando entre κ = 0,63 e κ = 0,73. Para a avaliação qualitativa da visualização dos segmentos ductais biliopancreáticos, a concordância interobservador foi considerada moderada, variando entre κ = 0,41 e κ = 0,48. Consideramos os exames com capacidade diagnóstica quando a árvore biliopancreática foi parcial ou completamente visualizada (escore de visualização 1 e 2). Consideramos o exame sem capacidade diagnóstica quando um determinado segmento biliopancreático não foi identificado (escore 0). Quando agrupamos os estudos em exames com capacidade diagnóstica (escore de visualização 1 e 2) e sem capacidade diagnóstica (escore de visualização 0), a concordância para a visualização da árvore biliopancreática passou a ser substancial (Tabela 1). Não houve diferença estatística quanto ao número de exames considerados diagnósticos entre as três técnicas (jejum, ranitidina e contraste negativo via oral) (Tabela 2).
O uso do meio de contraste por via oral foi a estratégia na qual os maiores escores de supressão foram alcançados (Figuras 1 e 2), sendo a diferença com as outras formas de supressão do sinal do líquido gastrintestinal (jejum e ranitidina) estatisticamente significativa para qualquer uma duas técnicas de aquisição (2D x 3D) (
p = 0,02). Não houve diferença estatisticamente significativa entre os escores obtidos com a ranitidina e o jejum em ambas as formas de aquisição de imagem. O efeito do contraste negativo em todos os segmentos é apresentado na Figura 3, em que os escores para as três estratégias de supressão do sinal do líquido gastrintestinal e para ambas as técnicas de aquisição estão representados.
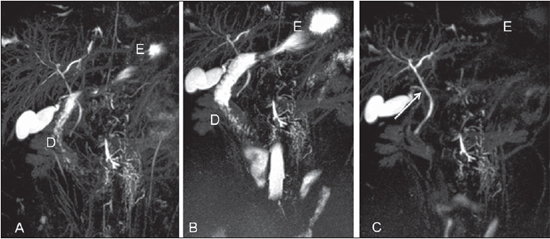
Figura 1. Reconstruções 3D MIP com ranitidina (A), jejum (B) e com solução de gadolínio (C). Redução do sinal do estômago (E) e do duodeno (D) com o uso do contraste negativo via oral. O ducto cístico (seta em C) foi mais bem caracterizado com a solução de gadolínio por via oral.

Figura 2. Comparação entre as estratégias de redução do sinal do líquido gastrintestinal em reconstruções 3D MIP com ranitidina (A), jejum (B) e com solução de gadolínio (C). O sinal do líquido gastrintestinal é semelhante com a estratégia da ranitidina e o jejum. Seta em C identifica o ducto cístico. E, estômago; D, duodeno.
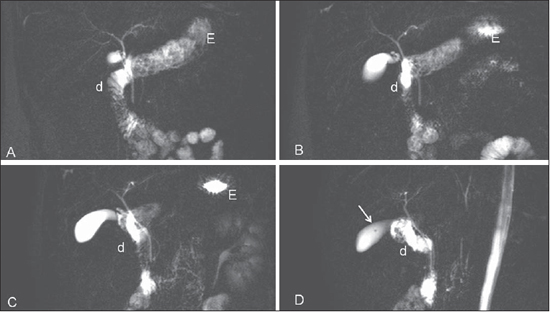
Figura 3. Sequência 2D em jejum, em que, a despeito das aquisições anguladas, o ducto cístico permaneceu sobreposto. Detalhe para o pequeno pólipo
vesicular na imagem D (seta). E, estômago; d, duodeno.
Foram avaliados dez segmentos da árvore biliopancreática. Todos os 32 pacientes foram avaliados seis vezes (três vezes em aquisições 3D e três vezes em aquisições 2D). Dessa forma, cada observador fez 1920 avaliações. Os escores 1 e 2 (quando o sinal do líquido gastrintestinal impede parcial ou totalmente a avaliação da árvore biliopancreática) ocorreram em apenas 3,2% do total de avaliações, sendo mais comuns na análise do ducto cístico em aquisições 2D pelos observadores menos experientes (Figura 4).
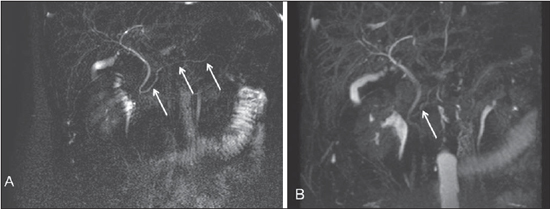
Figura 4. Todos os segmentos do ducto pancreático são identificados na aquisição 2D com solução de gadolínio (setas em A). Na sequência 3D MIP (B)
apenas a sua porção cefálica é parcialmente identificada (seta).
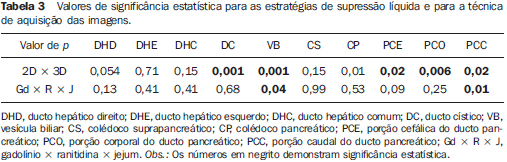
A qualidade de visualização ductal esteve mais relacionada à técnica de aquisição (2D x 3D) do que à estratégia de supressão do sinal do líquido gastrintestinal (Tabela 3).
Para o ducto hepático direito, esquerdo, comum e a porção suprapancreática do colédoco, não houve diferença estatística entre as técnicas de aquisição (2D x 3D), nem entre as estratégias de supressão do sinal do líquido gastrintestinal.
Para o ducto cístico e para a vesícula biliar, as aquisições com a técnica 3D proporcionaram maiores escores de visualização.
Para a porção pancreática do colédoco, e para toda a extensão do ducto pancreático, as aquisições 2D superaram as aquisições com a técnica 3D, e esta diferença foi estatisticamente significativa (Figura 5).
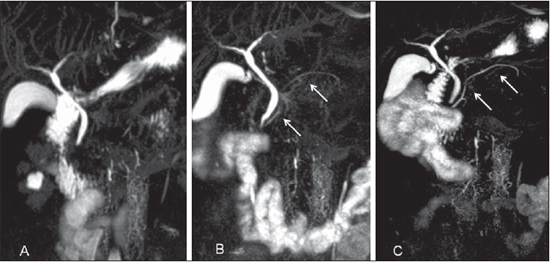
Figura 5. Reconstruções MIP 3D com o uso de ranitidina (A), solução de gadolínio por via oral (B) e jejum (C). Observar a diferença no grau de visualização do ducto pancreático no mesmo paciente (setas em B e C).
A avaliação da vesícula biliar e do ducto cístico foi significativamente superior quando se adotou a ingestão da solução de gadolínio. Nos demais segmentos da árvore biliopancreática a visualização ductal foi semelhante, entre as três estratégias de supressão do sinal líquido (Tabela 3).
Para os três observadores, na maioria dos exames, as técnicas de aquisição 2D e 3D apresentaram desempenho semelhante na visualização da árvore biliopancreática (Tabela 4).
Em todos os segmentos ductais estudados a estratégia de supressão do sinal do líquido gastrintestinal com a ingestão de ranitidina não resultou em melhor avaliação da árvore biliopancreática, quando comparada com as duas outras estratégias, e sem diferença estatística com os exames realizados apenas em jejum. Na avaliação do ducto pancreático caudal observamos uma pior definição nas imagens obtidas após o uso de ranitidina (Figura 6), quando comparada às outras estratégias de supressão do sinal do líquido gastrintestinal (Tabela 3).
DISCUSSÃO
A CPRM é o principal exame não invasivo utilizado na avaliação das doenças biliopancreáticas. Apresenta acurácia semelhante à colangiopancreatografia retrógrada endoscópica no diagnóstico de coledocolitíase, obstrução biliar e colangite esclerosante(13,14), sem os riscos potenciais envolvidos neste procedimento invasivo(15). Para que se obtenha os resultados propagados, é imprescindível garantir a aquisição de exames com uma boa qualidade de imagem, que, por sua vez, é expressa pelo grau de visualização ductal(16). A caracterização inadequada dos ductos da árvore biliopancreática pode advir principalmente da presença de artefatos oriundos de movimentos peristáltico, respiratórios e de sobreposição hídrica entérica(17). No presente estudo procuramos demonstrar os resultados encontrados na qualidade de visualização ductal em exames de CPRM quando diferentes estratégias foram empregadas, com o intuito de minimizar a sobreposição do líquido gastrintestinal sobre as árvores biliar e pancreática.
Entre estas estratégias, a adoção da ingestão de solução de gadolínio diluído em água foi a melhor forma de abolir o sinal do líquido gastrintestinal. Quanto à estratégia farmacológica, utilizando ranitidina por via oral, os nossos resultados não se assemelharam ao encontrado em estudo anterior(5). Constatamos que não houve diferença significativa na redução do sinal entre os exames realizados com jejum e após a ingestão de 300 mg de ranitidina.
A ranitidina reduz a secreção ácida gástrica graças à sua ação nos receptores H2, reduzindo a concentração de prótons de hidrogênio no suco gástrico(10). Estes, por sua vez, são utilizados para a formação da imagem nos exames de RM. Existem trabalhos demonstrando relação linear entre a intensidade do sinal mensurado pela RM e a concentração local de hidrogênio(18,19). Provavelmente, houve uma diferença na concentração destes íons no suco gástrico quando os pacientes realizaram o estudo em jejum, e após o uso da ranitidina. Porém, esta diferença não foi expressa em termos da quantidade de sinal do líquido gastrintestinal percebida pelos observadores. Um outro ponto a ser considerado é o efeito da ranitidina na motilidade gástrica. Para alguns autores, há um efeito pró-cinético, acelerando o esvaziamento gástrico, enquanto para outros há um efeito contrário(20-23), o que pode influenciar nos resultados referentes à quantidade de líquido no interior da cavidade gástrica. Este ponto ainda é controverso e deverá ser aprofundado em estudos ulteriores sobre a motilidade gastroduodenal. A dose de ranitidina e o tempo de administração são outros pontos que poderiam ter influenciado sobre a sua efetividade no sentido de uma redução mais expressiva da secreção gástrica. No entanto, estas variáveis foram consoantes com as utilizadas em outros estudos e suportadas pela sua ação farmacológica(6,10).
Observamos uma piora na visualização da porção caudal do ducto pancreático com o uso da ranitidina em ambas as técnicas de aquisição (2D e 3D). Bowes et al. também citaram uma redução não significativa na visualização do ducto pancreático em seu estudo, mas não teceram comentários sobre o assunto(6). A nossa hipótese é a de que a secreção ácida gástrica basal mantenha algum estímulo sobre a secreção exógena pancreática de bicarbonato, o que faria com que houvesse líquido no interior do lúmen ductal pancreático, e consequente sinal de RM nas sequências colangiográficas. Ao contrário, a supressão da secreção gástrica promovida pela ranitidina limitaria este efeito.
A sobreposição hídrica prejudicial à visualização ductal foi um evento infrequente, identificada em apenas 3,2% dos exames. Este achado foi mais comum para o ducto cístico em aquisições 2D. Estes escores tiveram maior ocorrência na análise dos observadores com menor experiência. Até onde pudemos verificar, o nosso estudo é o primeiro a quantificar a frequência com a qual a sobreposição hídrica limita a visualização ductal, e o primeiro a relacioná-lo com o grau de experiência dos observadores.
Observamos que o escore de visualização esteve mais vinculado com a forma de aquisição empregada e com a localização do segmento avaliado. Pelos resultados do nosso estudo, as sequências obtidas com técnica 3D e SR melhoram o grau de visualização do ducto cístico e da vesícula biliar. Nos demais segmentos, os escores de visualização obtidos com as sequências em apneia foram equivalentes ou superiores aos adquiridos em sequências 3D. Este aspecto foi observado sobretudo no ducto pancreático. Segundo alguns autores, existe uma superioridade na visualização deste segmento quando o seu plano anatômico está contido no bloco de aquisição, como o obtido com a técnica 2D(24). Além do mais, as reconstruções com a técnica MIP realizadas a partir das imagens obtidas com a técnica 3D podem exacerbar a manifestação dos artefatos de movimento(25). Considerando-se estes aspectos e o tempo mais curto de aquisição das imagens obtidas com a técnica 2D em apneia, entendemos que é justificável iniciar o exame de CPRM por esta técnica de aquisição. Nos casos em que algum segmento ductal, crucial para definição diagnóstica, não seja representado adequadamente na técnica 2D, o exame pode ser complementado pelas imagens adquiridas com SR e técnica 3D. Quando utilizamos apenas o jejum com estratégia de supressão do sinal do líquido gastrintestinal, o contraste negativo via oral teria sido necessário em 3 (9%) dos 32 casos para o observador 1, em nenhum caso para o observador 2 e em 5 casos (15%) para o observador 3. A supressão do sinal do líquido gastrintestinal seria útil principalmente para a avaliação do ducto cístico apenas em aquisições 2D.
Em resumo, os três observadores concordaram de maneira substancial para o fato de o sinal do suco entérico ser um fator que raramente afeta o grau de visualização da árvore biliopancreática quando o exame é feito em jejum. Por isso consideramos, à semelhança de outros autores, que o uso de contraste negativo pode ser dispensável em exames de CPRM(2). Contudo, na literatura, não há consenso a respeito deste tema(9). Alguns autores emitem opiniões não baseadas em evidências e fruto apenas da sua experiência, indicando que o contrate oral não é necessário(1). Em contrapartida, outros demonstram a utilidade desta estratégia em melhorar a qualidade de visualização da árvore biliopancreática(5,17). É importante notar que estes últimos não utilizaram a sequência radial nas aquisições em 2D com apneia, ou não realizaram as sequências 3D com SR na avaliação rotineira da árvore biliopancreática nos seus estudos, ao contrário do que fizemos no nosso trabalho e que reduz a sobreposição indesejada do suco gástrico sobre as vias biliopancreáticas. Isto explicaria a discrepância obtida no nosso estudo quando comprado com os anteriores, no sentido de considerar desnecessário o contraste via oral, uma vez que as diferentes angulações das aquisições radiais e volumétricas evitam a sobreposição hídrica no mapeamento da árvore biliopancreática.
O nosso estudo apresenta algumas limitações. Primeiro, não controlamos o tempo de jejum dos pacientes, apenas estabelecemos um tempo mínimo de pelo menos quatro horas entre o exame e a última refeição; alguns pacientes podem ter prolongado o tempo de jejum, como também ocorre na prática diária. Segundo, não controlamos a dieta dos voluntários. Existem alguns alimentos capazes de retardar o esvaziamento gástrico, o que eventualmente pode prejudicar a eficácia do jejum como estratégia de redução da sobreposição ductal; porém, não é comum, nas orientações de preparo para o exame de CPRM limitar a ingestão de determinados alimentos. Terceiro, não utilizamos medicações antiperistálticas. Sodickson et al. referem, em seu trabalho, a apresentação dos artefatos de movimento decorrentes de movimentos peristálticos sob a forma de ruído disperso por toda a imagem em aquisições de CPRM 3D, promovendo indefinição dos contornos ductais(26). Isto pode ter prejudicado a qualidade das imagens em aquisições 3D; por outro lado, evitar o uso deste tipo de medicação aumenta a tolerância ao procedimento, uma vez que alguns pacientes são sensíveis à escopolamina. Finalmente, as novas técnicas de sincronização respiratória por meio da monitoração do movimento diafragmático (PACE)(27) parecem ser superiores à utilizada por nós. Isto pode ter favorecido as sequências 2D no nosso estudo, isto é, adotar técnicas mais modernas de SR poderia ter elevado a qualidade das imagens obtidas em 3D e torná-las melhores que as obtidas em apneia. No entanto, devemos considerar que, da mesma forma, novas técnicas de aquisição em apneia também poderiam otimizar os seus resultados na avaliação da árvore biliopancreática pela CPRM.
Na avaliação das doenças que acometem as vias biliares e pancreáticas, a CPRM tem ocupado espaço crescente, decorrente das suas muitas virtudes e complementar à ultrassonografia(28-30). Estabelecer um protocolo de exame de CPRM que a torne mais simples, rápida e eficiente, sem prejudicar a sua habilidade diagnóstica, se reveste de certa importância, como procuramos contribuir com o nosso estudo.
Concluindo, demonstramos que o uso da ranitidina por via oral não traz benefícios expressivos à qualidade de imagem em estudos de CPRM, sendo possível realizar o exame de forma simplificada e com boa qualidade, utilizando-se técnica de aquisição em apneia e jejum. Ao se dispensar o uso de sequências com SR com longo tempo de aquisição e estratégias de redução do sinal do líquido gastrintestinal, sejam elas farmacológicas ou com o uso de contrastes orais, em detrimento de sequências rápidas em apneia, podemos economizar tempo e recursos.
REFERÊNCIAS
1. Bearcroft PW, Lomas DJ. Magnetic resonance cholangiopancreatography. Gut. 1997;41:135-7.
2. Larena JA, Astigarraga E, Saralegui I, et al. Magnetic resonance cholangiopancreatography in the evaluation of pancreatic duct pathology. Br J Radiol. 1998;71:1100-4.
3. Lomas DJ, Bearcroft PW, Gimson AE. MR cholangiopancreatography: prospective comparison of a breath-hold 2D projection technique with diagnostic ERCP. Eur Radiol. 1999;9:1411-7.
4. Irie H, Honda H, Kuroiwa T, et al. Pitfalls in MR cholangiopancreatographic interpretation. Radiographics. 2001;21:23-37.
5. Chan JH, Tsui EY, Yuen MK, et al. Gadopentetate dimeglumine as an oral negative gastrointestinal contrast agent for MRCP. Abdom Imaging. 2000;25:405-8.
6. Bowes MT, Martin DF, Melling A, et al. Single dose oral ranitidine improves MRCP image quality: a double-blind study. Clin Radiol. 2007;62:53-7.
7. Galvão Filho MM, D'Ippolito G, Borri ML, et al. Uso do contraste oral negativo em exames de colangiografia por ressonância magnética. Radiol Bras. 2002;35:267-71.
8. Riordan RD, Khonsari M, Jeffries J, et al. Pineapple juice as a negative oral contrast agent in magnetic resonance cholangiopancreatography: a preliminary evaluation. Br J Radiol. 2004;77:991-9.
9. Sanchez TA, Elias J Jr, Colnago LA, et al. Clinical feasibility of açaí (Euterpe oleracea) pulp as an oral contrast agent for magnetic resonance cholangiopancreatography. J Comput Assist Tomogr. 2009;33:666-71.
10. Santos DRDS, Silva LR. Farmacologia clínica das drogas antiulcerosas e antidispépticas. In: Silva P, organizador. Farmacologia. Rio de Janeiro, RJ; 2010. p. 881-7.
11. Chu ZQ, Ji Q, Zhang JL. Orally administered lemon/orange juice improved MRCP imaging of pancreatic ducts. Abdom Imaging. 2010;35:367-71.
12. Bland JM, Altman DG. Measuring agreement in method comparison studies. Stat Methods Med Res. 1999;8:135-60.
13. Romagnuolo J, Bardou M, Rahme E, et al. Magnetic resonance cholangiopancreatography: a meta-analysis of test performance in suspected biliary disease. Ann Intern Med. 2003;139:547-57.
14. Vitellas KM, Enns RA, Keogan MT, et al. Comparison of MR cholangiopancreatographic techniques with contrast-enhanced cholangiography in the evaluation of sclerosing cholangitis. AJR Am J Roentgenol. 2002;178:327-34.
15. Scheiman JM, Carlos RC, Barnett JL, et al. Can endoscopic ultrasound or magnetic resonance cholangiopancreatography replace ERCP in patients with suspected biliary disease? A prospective trial and cost analysis. Am J Gastroenterol. 2001;96:2900-4.
16. Hundt W, Petsch R, Scheidler J, et al. Clinical evaluation of further-developed MRCP sequences in comparison with standard MRCP sequences. Eur Radiol. 2002;12:1768-77.
17. Coppens E, Metens T, Winant C, et al. Pineapple juice labeled with gadolinium: a convenient oral contrast for magnetic resonance cholangiopancreatography. Eur Radiol. 2005;15:2122-9.
18. Heverhagen JT, Müller D, Battmann A, et al. MR hydrometry to assess exocrine function of the pancreas: initial results of noninvasive quantification of secretion. Radiology. 2001;218:61-7.
19. Punwani S, Gillams AR, Lees WR. Non-invasive quantification of pancreatic exocrine function using secretin-stimulated MRCP. Eur Radiol. 2003;13:273-6.
20. Kemmostsu O, Mizushima M, Morimoto Y, et al. Effect of preanesthetic intramuscular ranitidine on gastric acidity and volume in children. J Clin Anesth. 1991;3:451-5.
21. Cucchiara S, Raia V, Minella R, et al. Ultrasound measurement of gastric emptying time in patients with cystic fibrosis and effect of ranitidine on delayed gastric emptying. J Pediatr. 1996;128:485-8.
22. Madsen JL, Graff J. Effects of the H2-receptor antagonist ranitidine on gastric motor function after a liquid meal in healthy humans. Scand J Clin Lab Invest. 2008;68:681-4.
23. Parkman HP, Urbain JL, Knight LC, et al. Effect of gastric acid suppressants on human gastric motility. Gut. 1998;42:243-50.
24. Chen RC, Lin KY, Lii JM, et al. MR cholangiopancreatography: prospective comparison of 3-dimensional turbo spin echo and single-shot turbo spin echo with ERCP. J Formos Med Assoc. 2003;102:172-7.
25. Morrin MM, Farrell RJ, McEntee G, et al. MR cholangiopancreatography of pancreaticobiliary diseases: comparison of single-shot RARE and multislice HASTE sequences. Clin Radiol. 2000;55:866-73.
26. Sodickson A, Mortele KJ, Barish MA, et al. Three-dimensional fast-recovery fast spin-echo MRCP: comparison with two-dimensional singleshot fast spin-echo techniques. Radiology. 2006;238:549-59.
27. Morita S, Ueno E, Suzuki K, et al. Navigator-triggered prospective acquisition correction (PACE) technique vs. conventional respiratory-triggered technique for free-breathing 3D MRCP: an initial prospective comparative study using healthy volunteers. J Magn Reson Imaging. 2008;28:673-7.
28. Arruda ECM, Coelho JCU, Yokochi JM, et al. O papel da colangiografia por ressonância magnética na avaliação da anatomia biliar em doadores de transplante hepático intervivos. Radiol Bras. 2008;41:361-5.
29. Sales DM, Santos JEM, Shigueoka DC, et al. Correlação interobservador das alterações morfológicas das vias biliares em pacientes com esquistossomose mansoni pela colangiorressonância magnética. Radiol Bras. 2009;42:277-82.
30. Souza LRMF, Rodríguez FB, Tostes LV, et al. Avaliação por imagem das lesões císticas congênitas das vias biliares. Radiol Bras. 2012;45:113-7.
1. Médicos Radiologistas, Mestrandos em Radiologia Clínica da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil.
2. Pós-graduandos do Setor de Abdome do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), Médicos Radiologistas do Hospital São Luiz, São Paulo, SP, Brasil.
3. Livre-docente, Professor Adjunto do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil.
Endereço para correspondência:
Dr. Giuseppe D'Ippolito
Departamento de Diagnóstico por Imagem - EPM-Unifesp
Rua Napoleão de Barros, 800, Vila Clementino
São Paulo, SP, Brasil, 04024-002
E-mail: giuseppe_dr@uol.com.br
Recebido para publicação em 8/10/2012.
Aceito, após revisão, em 4/1/2013.
* Trabalho realizado no Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina - Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil.
 Vol. 46 nº 2 - Mar. / Abr. of 2013
Vol. 46 nº 2 - Mar. / Abr. of 2013