Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 45 nº 6 - Nov. / Dez. of 2012
Vol. 45 nº 6 - Nov. / Dez. of 2012
|
ARTIGOS DE REVISÃO
|
|
|
|
|
Autho(rs): Filipe Ramos Barra1; Renato Ramos Barra2; Alaor Barra Sobrinho3 |
|
|
Descritores: Mamografia; Cintilografia mamária; Neoplasias da mama; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
O câncer da mama é o tipo de câncer que mais acomete as mulheres em todo o mundo e sua incidência tem aumentado nos últimos anos. Excluindo os tumores da pele não melanoma, o câncer de mama é o mais frequente nas mulheres das regiões Sudeste, Centro-Oeste e Nordeste do Brasil(1). Apesar de ser considerado um câncer com bom prognóstico se diagnosticado e tratado corretamente, as taxas de mortalidade por câncer da mama no País estão caindo, porém continuam elevadas, provavelmente porque o diagnóstico é feito em estádios avançados. A sobrevida média após cinco anos na população de países desenvolvidos é de cerca de 85%, enquanto nos países em desenvolvimento fica em torno de 60%(1). Um dos fatores que contribuem para uma melhor sobrevida é o correto estadiamento e detecção precoce de metástases, que pode ser feito com PET/CT, cintilografia óssea ou tomografia com multidetectores(2,3). A mamografia é um método de avaliação morfológica, sendo o único com impacto comprovado na redução da mortalidade por câncer de mama(4). Por ser bidimensional, há supressão tecidual, tendo menor sensibilidade de diferenciação tecidual, principalmente em mulheres jovens e nas com mamas densas(5,6). Além disto, não apresenta boa performance no planejamento cirúrgico, com taxa de lesão residual pós-operatória de 30% a 60%(7). A densidade mamária tem relação direta com a utilização de terapia de reposição hormonal e indireta com idade, paridade e índice de massa corporal(8). Nas mulheres com mamas densas, tem-se aumento no número de achados duvidosos (provavelmente benignos) e na taxa de falso-positivos, determinando biópsias desnecessá-rias(9). Mesmo com a utilização da ferramenta de detecção auxiliada por computador (CAD), a performance da mamografia não é perfeita, em especial para distorções arquiteturais e nódulos(10). O ultrassom tem importante papel como exame complementar à mamografia e ao exame clínico. Além de detectar lesões ocultas à mamografia, ajuda na diferenciação entre nódulos císticos e sólidos e na caracterização do grau de suspeição dos nódulos sólidos. Com a utilização de parâmetros morfométricos pode-se ter uma melhor distinção entre lesões benignas e malignas, sendo a razão entre a largura e a profundidade da lesão um parâmetro com bons resultados e de fácil execução(11). A ressonância magnética (RM) tem mostrado excelentes resultados na detecção e caracterização de lesões mamárias. Com a RM, novos conceitos relacionados a angiogênese e suprimento vascular surgiram. Na prática diária, as principais indicações da RM são de avaliação de achados inconclusivos na mamografia ou na ultrassonografia, planejamento cirúrgico e avaliação de resposta a tratamento(12). Utilizando-se a sequência de difusão pode-se diferenciar algumas lesões benignas das malignas(13). Questiona-se então se apenas a análise morfológica da mamografia é suficiente na avaliação mamária ou se é necessária a avaliação do comportamento vascular e metabólico das lesões(14,15). Atualmente, o melhor método para avaliação de mamas densas, mulheres com alto risco (familiar ou pessoal), achados dúbios à mamografia, estadiamento pré-quimioterapia neoadjuvante e de resposta ao tratamento é a RM(15-17). As limitações da RM incluem seu alto custo, seu tempo de interpretação longo, suas contraindicações e sua correlação nem sempre fácil com mamo-grafia e ultrassonografia em razão do diferente posicionamento. Novas tecnologias de avaliação funcional estão surgindo para suprir as necessidades existentes. Pesquisamos artigos publicados sobre mamografia digital com contraste e imagem molecular e descrevemos as técnicas, comentando suas principais características, vantagens e desvantagens, além de mostrar um pouco da nossa experiência inicial. MAMOGRAFIA DIGITAL COM CONTRASTE A melhora tecnológica nos detectores digitais e tubos de raios X, assim como estudos sobre a técnica de dupla energia, possibilitaram o desenvolvimento da mamografia digital com contraste, também chamada de mamografia espectral com contraste ou simplesmente mamografia com contraste(18). Existem duas técnicas descritas para a mamografia com contraste: a técnica de dupla energia e a técnica temporal(18,19). Independentemente da técnica, é utilizado contraste iodado na mesma dose da tomografia (1 a 2 ml/kg), de preferência injetado por uma bomba injetora com fluxo de 3 a 5 ml/s, tendo as mesmas contraindicações e riscos de reações da tomografia, necessitando de preparo semelhante(20,21). A mamografia com contraste com técnica temporal é semelhante à angiografia. Uma imagem pré-contraste é adquirida servindo como máscara para subtração das imagens pós-contraste subsequentes. O contraste é administrado estando a mama comprimida. O procedimento todo tem duração de cerca de cinco minutos, podendo ser suscetível a artefatos de movimentação. Permite avaliação cinética dos achados com o estudo da curva de realce, similar à RM, porém, apenas de uma mama, em uma única incidência(22). A técnica de dupla energia explora as diferentes atenuações dos raios X pelos diferentes materiais. É realizada uma adaptação do sistema de mamografia digital com a introdução de um filtro de cobre, permitindo assim obter um espectro de raios X com energia acima da camada K do iodo (33,2 keV) para as imagens de alta energia, geralmente entre 45 e 49 kV. O agente de contraste iodado é administrado com a paciente sentada, sem as mamas estarem comprimidas. Um par de imagens com baixa e alta energia é obtido em cada incidência, tendo duração média de 10 segundos por incidência. As imagens são adquiridas entre 2 e 7 minutos, tomando como base os conhecimentos prévios da RM. A dose de radiação da imagem de alta energia equivale a cerca de 20% da obtida na mamografia convencional, e assim há um incremento total de apenas 20% na dose final do exame(20). Tem como vantagem a possibilidade de obtenção de imagens em diferentes planos, além de compressões e magnificações de ambas as mamas com uma única injeção de contraste. Porém, impossibilita o estudo da cinética do realce (curva de realce). Comparando-se com a mamografia digital, a mamografia com contraste apresenta maior sensibilidade (93% vs. 78%), com boa especificidade (83%) (20). Utilizando múltiplos observadores, foi possível identificar aumento da sensibilidade em cerca de 20%, principalmente nas mamas densas, sendo que alguns tumores somente foram identificados nas imagens com contraste(23). Na nossa experiência com o aparelho GE SenoBright (GE Healhtcare; Buc, França) identificamos realce considerável nas lesões suspeitas (carcinoma ductal in situ e invasivo e carcinoma lobular), havendo boa correlação com a ultrassonografia e principalmente com a RM. Nas mulheres com mamas densas, as imagens de alta energia destacaram as lesões suspeitas, como demonstrado nas Figuras 1 e 2, possibilitando a identificação retrospectiva destas na mamografia sem contraste. 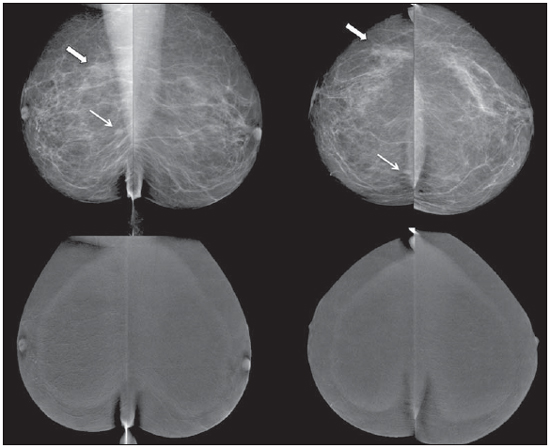 Figura 1. Mamografia digital com contraste de uma mulher com 65 anos de idade. As imagens superiores da mamografia digital tradicional demonstram assimetria focal de densidade no quadrante superolateral (seta grossa) e nódulo no quadrante inferomedial (seta fina), ambos na mama direita. As imagens da subtração (alta menos baixa energia) na linha inferior demonstram que não houve realce de suspeição, favorecendo benignidade. 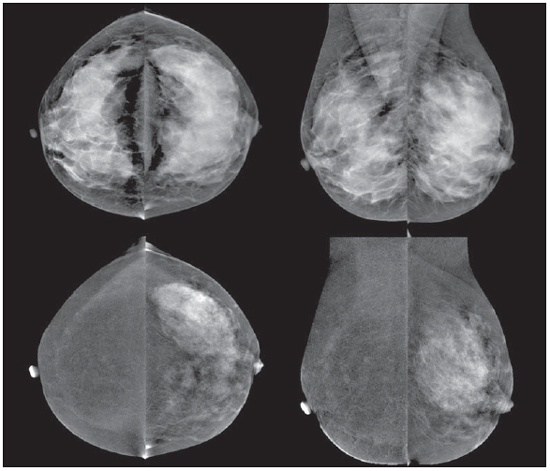 Figura 2. Mulher de 50 anos de idade apresentando massa palpável na mama esquerda. Na mamografia digital simples (linha superior) não há achados que se destaquem. Nas imagens de subtração (linha inferior) se observa com clareza a massa no quadrante superolateral da mama esquerda. A biópsia demonstrou carcinoma ductal in situ. IMAGEM MOLECULAR MAMÁRIA A cintilografia mamária tradicional é utilizada desde a década de 90, quando se observou captação em lesões mamárias pelo traçador sestamibi marcado com tecnécio, que é utilizado em exames de cintilografia miocárdica(24). É um bom método para avaliação de lesões mamárias benignas e malignas, com performance não influenciada pela densidade mamária. Em razão da grande distância entre o detector e a mama, apresenta baixa sensibilidade para lesões menores que 10 mm e naquelas localizadas próximas à parede torácica. Novas gama-câmaras, dedicadas a avaliação mamária, foram desenvolvidas buscando-se melhorar a resolução da cintilografia tradicional(25). Esses aparelhos possuem em comum a disposição dos detectores em placas paralelas, possibilitando aquisição de imagens em posições análogas à mamografia e com isto aumento na sensibilidade de detecção de pequenas lesões. Um tipo de gama-câmara específica para mama foi desenvolvido com detectores semicondutores de alta resolução (CZT - sigla em inglês para telureto de cádmio de zinco), no lugar dos tradicionais tubos fotomultiplicadores. Esses detectores possibilitam aumento da resolução espacial, com detecção de lesões de até 0,2 cm(26-29). Para diferenciar da cintilografia mamária, optou-se por denominá-lo molecular breast imaging (MBI) (imagem molecular mamária), cunhado pelos autores como cintilografia mamária de alta resolução, procurando vincular a cintilografia mamária tradicional com a nova tecnologia de alta resolução. O exame é realizado com a mulher sentada e as mamas imobilizadas por leve compressão, cerca de um terço da mamografia. As imagens podem ser obtidas em qualquer incidência mamográfica, sendo a rotina incluir craniocaudal e mediolateral oblíqua, para facilitar a correlação com a mamografia. O tempo de aquisição das imagens é variável na literatura, entre 5 e 10 minutos(28,29). Considerando-se a dose de radiação, há uma diferença substancial entre a cintilografia e a mamografia. A radiação da mamografia é apenas mamária enquanto a cintilografia é corpórea, concentrando-se principalmente nos sistemas urinário e intestinal. Na grande maioria dos trabalhos a dose de tecnécio utilizada foi 20-30 mCi, o que corresponde a cerca de 7 mSv (dose corpórea), 2-7 vezes a radiação de uma mamo-grafia (1-3 mSv). Estudos estão sendo realizado com doses menores (8 mCi e até 4 mCi) para se chegar à radiação final próxima à da mamografia(26). Em pacientes com diagnóstico de achados suspeitos a mamografia e/ou ultrassonografia, a MBI apresentou sensibilidade global de 91% (97% para lesões maiores que 10 mm, 91% para lesões entre 5 e 10 mm e 69% para lesões menores que 5 mm)(30), e além disso detectou lesões adicionais em 10% dos casos(31). Em relação à RM, houve concordância de 97%, com sensibilidade da RM de 98% e da MBI de 94%(30). Esta diferença deve-se principalmente às lesões entre 0,2 e 0,4 cm(30). Na nossa experiência, utilizando o aparelho GE Discovery NM 750B (GE Healthcare; Haifa, Israel) com protocolo de aquisição de 10 minutos por incidência, observamos captação em carcinomas ductais in situ e invasivo, carcinomas lobulares, assim como em tumores filoide e fibroadenomas (Figuras 3 e 4). Em RMs de algumas mulheres notamos que a sensibilidade para lesões maiores que 0,5 cm é semelhante. 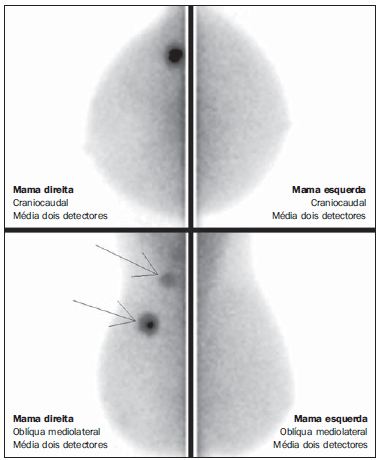 Figura 3. Imagem molecular mamária de uma mulher com 59 anos de idade que apresentava mamografia inconclusiva com mamas densas (BI-RADS 0). Nota-se captação de forte intensidade no quadrante superolateral da mama direita com linfonodo axilar ipsilateral hipercaptante. A biópsia demonstrou carcinoma ductal invasor com metástase linfonodal. 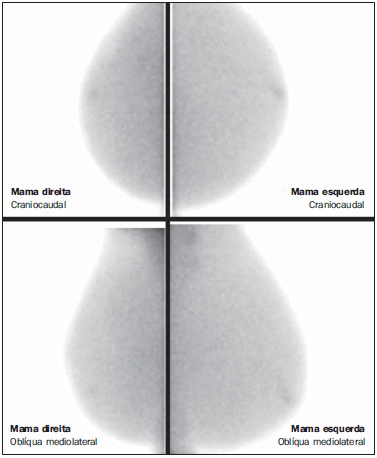 Figura 4. Mulher de 55 anos de idade submetida a cirurgia conservadora na mama direita. Na imagem molecular mamária observa-se redução volumétrica da mama direita, porém sem captação de suspeição, sugerindo ausência de lesão residual ou recidiva. DISCUSSÃO Novas técnicas de avaliação vascular/funcional de lesões mamárias estão surgindo. Suas melhores indicações clínicas estão por serem estabelecidas, sendo, em tese, semelhantes às da RM. No rastreamento, poderiam detectar lesões ocultas em mamas densas, esclarecendo achados duvidosos (assimetrias ou distorções focais, assimetrias vistas apenas em uma incidência); no diagnóstico, reduziriam o número de biópsias desnecessárias; no planejamento de tratamento, ajudariam a avaliar a extensão local da doença e detectar outros focos; no monitoramento do tratamento, tanto cirúrgico como químio ou radioterápico, permitiriam avaliar a resposta. A mamografia com contraste, assim como a RM, avalia a morfologia e a vascularização das lesões. As grandes vantagens em relação à RM são a perfeita correlação com as imagens mamográficas, o menor custo e o tempo de exame. Suas desvantagens incluem a impossibilidade atual da realização de biópsias e marcações das áreas de realce e os possíveis efeitos adversos da utilização do contraste iodado. A imagem molecular mamária, comparada à RM, tem como vantagens o posicionamento análogo ao da mamografia, facilitando a comparação e interpretação menos complexas, e o menor custo. Em relação à mamografia, aplica menor força de compressão mamária e sua sensibilidade não depende da densidade mamária. Suas desvantagens são o tempo longo de exame, a dose de radiação total ainda alta e a impossibilidade de se fazer análise morfológica. Os falso-positivos descritos na literatura e os da nossa experiência são semelhantes aos da RM, como fibroadenoma, adenose, alterações fibrocísticas, papiloma, tumor filoide, fibrose, necrose gordurosa inflamatória, cicatriz radial, inflamação focal e hi-perplasia pseudoangiomatosa(20,21,26,29). Vale ressaltar que os estudos iniciais, incluindo o nosso, não representam exatamente a população real. As pessoas envolvidas na interpretação das imagens avaliam os exames com mais cuidado e, em vários estudos, pela população ter alto índice de câncer, os achados são mais valorizados. Com relação ao custo dos exames, tomando como base a RM, a imagem molecular mamária custa cerca de 70-80% e a mamografia com contraste, 50%. CONCLUSÃO Novos métodos de avaliação funcional mamária estão disponíveis, mostrando resultados promissores e em alguns casos performance próxima à da RM. Suas indicações poderiam ser as mesmas da RM, com a vantagem do menor custo. Cabe esperar por mais resultados a fim de se definir um fluxograma de conduta e assim usufruir o máximo das vantagens de cada tecnologia, com o mínimo de dano e risco à população. REFERÊNCIAS 1. Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Câncer: incidência de câncer no Brasil. Rio de Janeiro, RJ: INCA; 2012. 2. Miranda CMNR, Santos CJJ, Maranhão CPM, et al. A tomografia computadorizada multislice é uma ferramenta importante para o estadiamento e seguimento do câncer de mama? Radiol Bras. 2012;45:105-12. 3. Brennan ME, Houssami N. Evaluation of the evidence on staging imaging for detection of asymptomatic distant metastases in newly diagnosed breast cancer. Breast. 2012;21:112-23. 4. Chala LF, Barros N. Avaliação das mamas com métodos de imagem. Radiol Bras. 2007;40(1):iv-vi. 5. Boyd NF, Guo H, Martin LJ, et al. Mammographic density and the risk and detection of breast cancer. N Engl J Med. 2007;356:227-36. 6. Buist DSM, Porter PL, Lehman C, et al. Factors contributing to mammography failure in women aged 40-49 years. J Natl Cancer Inst. 2004;96:1432-40. 7. Gwin JL, Eisenberg BL, Hoffman JP, et al. Incidence of gross and microscopic carcinoma in specimens from patients with breast cancer after re-excision lumpectomy. Ann Surg. 1993;218:729-34. 8. Alvares BR, Freitas CHA, Jales RM, et al. Densidade mamográfica em mulheres menopausadas assintomáticas: correlação com dados clínicos e exames ultrassonográficos. Radiol Bras. 2012;45:149-54. 9. Prado GLM, Guerra MTPM. Valor preditivo positivo das categorias 3, 4 e 5 do Breast Imaging Reporting and Data System (BI-RADS®). Radiol Bras. 2010;43:171-4. 10. Calas MJG, Gutfilen B, Pereira WCA. CAD e mamografia: por que usar esta ferramenta? Radiol Bras. 2012;45:46-52. 11. Calas MJG, Alvarenga AV, Gutfilen B, et al. Avaliação de parâmetros morfométricos calculados a partir do contorno de lesões de mama em ultras-sonografias na distinção das categorias do sistema BI-RADS. Radiol Bras. 2011;44:289-96. 12. Marques EF, Medeiros MLL, Souza JA, et al. Indicações de ressonância magnética das mamas em um centro de referência em oncologia. Radiol Bras. 2011;44:363-6. 13. Pereira FPA, Martins G Figueiredo E, et al. O uso da difusão por ressonância magnética na diferenciação das lesões mamárias benignas e malignas. Radiol Bras. 2009;42:283-8. 14. Kuhl C. The current status of breast MR imaging. Part I. Choice of technique, image interpretation, diagnostic accuracy, and transfer to clinical practice. Radiology. 2007;244:356-78. 15. Kuhl CK. Current status of breast MR imaging. Part 2. Clinical applications. Radiology. 2007; 244:672-91. 16. Yeh ED. Breast magnetic resonance imaging: current clinical indications. Obstet Gynecol Clin North Am. 2011;38:159-77, ix. 17. Mameri CTS. Impacto da ressonância magnética mamária no tratamento cirúrgico, abordagem axilar e terapêutica sistêmica do câncer de mama. Radiol Bras. 2008;41:422. 18. Dromain C, Balleyguier C, Adler G, et al. Contrast-enhanced digital mammography. Eur J Radiol. 2009;69:34-42. 19. Helvie MA. Digital mammography imaging: breast tomosynthesis and advanced applications. Radiol Clin North Am. 2010;48:917-29. 20. Dromain C, Thibault F, Muller S, et al. Dual-energy contrast-enhanced digital mammography: initial clinical results. Eur Radiol. 2011;21:565-74. 21. Lewin JM, Isaacs PK, Vance V, et al. Dual-energy contrast-enhanced digital subtraction mammog-raphy: feasibility. Radiology. 2003;229:261-8. 22. Jong RA, Yaffe MJ, Skarpathiotakis M, et al. Contrast-enhanced digital mammography: initial clinical experience. Radiology. 2003;228:842-50. 23. Diekmann F, Freyer M, Diekmann S, et al. Evaluation of contrast-enhanced digital mammography. Eur J Radiol. 2011;78:112-21. 24. Khalkhali I, Vargas HI. The role of nuclear medicine in breast cancer detection: functional breast imaging. Radiol Clin North Am. 2001;39:1053-68. 25. Majewski S, Curran E, Keppel C, et al. Optimization of dedicated scintimammography procedure using detector prototypes and compressible phantoms. Nuclear Science Symposium Conference Record, 2000 IEEE; 2000. 26. Rhodes DJ, Hruska CB, Phillips SW, et al. Dedicated dual-head gamma imaging for breast cancer screening in women with mammographically dense breasts. Radiology. 2011;258:106-18. 27. Tafreshi NK, Kumar V, Morse DL, et al. Molecular and functional imaging of breast cancer. Cancer Control. 2010;17:143-55. 28. Hruska CB, Rhodes DJ, Collins DA, et al. Evaluation of molecular breast imaging in women undergoing myocardial perfusion imaging with Tc-99m sestamibi. J Womens Health (Larchmt). 2012;21:730-8. 29. Kim BS. Usefulness of breast-specific gamma imaging as an adjunct modality in breast cancer patients with dense breast: a comparative study with MRI. Ann Nucl Med. 2012;26:131-7. 30. Hruska C, Boughey J, Phillips S, et al. Molecular breast imaging: a review of the Mayo Clinic experience. Am J Surg. 2008;196:470-6. 31. Rhodes DJ, O'Connor MK, Phillips SW, et al. Molecular breast imaging: a new technique using technetium Tc 99m scintimammography to detect small tumors of the breast. Mayo Clin Proc. 2005;80:24-30. 1. Mestre, Médico Radiologista do IMEB - Imagens Médicas de Brasília, Brasília, DF, Brasil. 2. Mestrando, Médico Nuclear do IMEB - Imagens Médicas de Brasília, Brasília, DF, Brasil. 3. Médico Nuclear, Diretor Técnico do IMEB - Imagens Médicas de Brasília, Brasília, DF, Brasil. Endereço para correspondência: Dr. Filipe Ramos Barra SMHN, Quadra 2, Bloco C, Ed. Dr. Crispim, Sobreloja 18, IMEB Brasília, DF, Brasil, 70710-100 E-mail: filipe@imeb.com.br Recebido para publicação em 20/5/2012. Aceito, após revisão, em 25/9/2012. * Trabalho realizado no IMEB - Imagens Médicas de Brasília, Brasília, DF, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554