INTRODUÇÃO
A osteoartrite é uma causa comum de consulta médica(1). Uma melhor compreensão do papel da osteoartrite, não somente no que diz respeito aos sintomas, mas também no que se refere aos riscos potencialmente modificáveis, poderia proporcionar novas estratégias no manejo da doença(2).
Vários fatores, incluindo biomecânica, genética e inflamação, afetam a condição heterogênea da osteoartrite(3). A combinação desses fatores contribui para os sintomas de dor, rigidez e disfunção articular. Nesse contexto, a dor no joelho tem-se mostrado como sendo o sintoma mais frequente na osteoartrite, condição que é a principal causa de incapacidade crônica em indivíduos mais velhos e uma grande fonte de deficiência atribuível a essa doença. A gravidade dessa dor varia amplamente, da ausência até a imobilização e/ou incapacitação física do paciente(4).
É pouco provável que a intensidade da dor no joelho, em pessoas com osteoartrite, seja um fenômeno de simples explicação. A base anatômica e a patogênese molecular têm-se centrado no conceito de que a iniciação e a progressão da doença estão relacionadas ao afinamento e amolecimento da cartilagem articular, com deterioração progressiva da articulação(5). Há tempos a investigação sobre a causa estrutural da dor tem-se baseado nos defeitos cartilaginosos, mesmo sabendo que a cartilagem não possui fibras sensitivas dolorosas(6). Diversos estudos têm indicado associações variáveis entre dor no joelho e perda da cartilagem articular hialina(7,8).
Embora a osteoartrite seja tradicionalmente considerada como uma doença da cartilagem hialina, na atualidade tem-se enfatizado que considerá-la como uma doença primária da cartilagem articular é uma conclusão muito simplista(9), uma vez que se trata de um processo que envolve tecidos articulares e estruturas tais como o osso subcondral, as fibrocartilagens, os ligamentos, os músculos, a cápsula articular e a membrana sinovial(10).
As fontes de dor na osteoartrite permanecem obscuras, como se pode observar em diversas publicações, e o quadro álgico pode ser proveniente de qualquer um dos vários tecidos inervados. Torna-se importante salientar que outras anormalidades como o derrame articular, a sinovite e as lesões meniscais podem estar associadas. Além disso, o osso subcondral também pode desempenhar um papel importante na geração da dor(11).
Atualmente, tem-se dado ênfase à pesquisa envolvendo as causas de dor no joelho, tomando-se como base os achados objetivos observados na área do diagnóstico por imagem, em especial, na ressonância magnética (RM)(12,13).
Na investigação da dor no joelho, igualmente importante é correlacionar dados clínicos/idade do paciente com as possíveis doenças mais prevalentes naquele subgrupo. Por exemplo, a osteonecrose espontânea do joelho é uma afecção que cursa com início súbito de dor localizada, acomete majoritariamente indivíduos do sexo feminino, notadamente a partir da sétima década de vida, sem associação com desordens sistêmicas, abuso de álcool, terapia prévia com corticosteroides, cirurgia meniscal ou trauma local(14). Em mulheres mais jovens, a ocorrência de osteonecrose corrobora a suspeita de alguma doença reumatológica, notadamente o lúpus eritematoso sistêmico. Nesses pacientes, a osteonecrose provoca dor antes da destruição articular(15).
No estudo de Kornaat et al.(8) avaliou-se a associação de características clínicas e anormalidades estruturais encontradas na RM, em pacientes com osteoartrite do joelho. Associada a dor e rigidez do joelho, pode-se encontrar moderada a grande quantidade de líquido articular. Concomitantemente, a presença de osteófito femoropatelar e/ou mais de quatro osteófitos em todo o joelho também associaram-se com a dor. Já as alterações cartilaginosas focais ou difusas, os cistos subcondrais, o edema da medula óssea, a subluxação e/ou lesões meniscais ou cistos de Baker não foram associados com dor e rigidez.
Em resumo, a identificação das estruturas que de fato estão associadas com a dor na osteoartrite do joelho contribuirá para uma melhor compreensão do assunto e, em longo prazo, propiciará condutas terapêuticas racionais para esta doença.
GÊNESE DA OSTEOARTRITE
A cartilagem articular normalmente é o tecido que apresenta as maiores alterações encontradas nos casos de osteoartrite e que podem ser observadas tanto na forma primária quanto na forma secundária. Dentre as alterações morfológicas evidenciadas, nota-se que a cartilagem perde a natureza homogênea e mostra-se rompida, fragmentada, com fibrilação, fissuras e ulcerações. Muitas vezes, com o avanço do processo patológico, não se percebe mais a cartilagem e em consequência depara-se com áreas expostas de osso subcondral(16).
Uma das etiologias mais frequentes na osteoartrite é o aumento na rigidez da placa óssea subcondral, fato que poderia dar início ao dano cartilaginoso, notadamente no que diz respeito a fibrilação e fissuras. A integridade desse tecido é necessária para o funcionamento normal da articulação(17).
Apesar de a esclerose subcondral radiográfica ser vista como uma consequência secundária aos danos na cartilagem, existe na atualidade uma série de relatos sugerindo que pode haver uma mudança fundamental neste conceito e, portanto, ser realmente a esclerose óssea que leva a danos na cartilagem e não vice-versa(17).
Outro dado de grande interesse refere-se ao osso esponjoso que pode ser detectado próximo às articulações sinoviais e que tem a importante função de amortecer as forças transmitidas à articulação. Essas forças podem ser essenciais na produção de danos à cartilagem, na vigência do quadro de osteoartrite, particularmente se houver excesso de força atuando sobre o osso(18).
Alterações do osso subcondral, em modelos experimentais de osteoartrite, ocorrem de maneira precoce após a indução da doença e deixam à mostra evidente remodelamento ósseo provocado por ela. Essa modificação sucede-se cerca de duas semanas após procedimentos cirúrgicos envolvendo os ligamentos cruzados e em casos de meniscectomias, antes mesmo que ocorram as lesões condrais. No início do quadro observam-se danos focais na superfície cartilaginosa do compartimento medial e é importante notar que na fase precoce do processo o afinamento da cartilagem é detectado somente por histomorfometria(19).
Radin et al.(20,21) descreveram aumento de formação óssea subcondral e diminuição da porosidade, em um modelo animal de osteoartrite, que foi associada com rigidez relativa do osso. Após alteração óssea precoce há ocorrência de fibrilação profunda da cartilagem articular sobrejacente.
O QUE É FADIGA ÓSSEA?
Ao que tudo indica, a fadiga óssea pode representar a remodelação do osso subcondral nos casos de osteoartrites e, como consequência, promover alteração na forma e no contorno do osso ou até mesmo provocar perda de tecido ósseo(22). Esta é a alteração do osso subcondral menos estudada, sendo avaliada como se fosse uma perda de densidade óssea pela radiografia convencional(23) ou como achatamento/depressão do córtex articular por meio da RM(24).
A presença de fadiga óssea esteve fortemente associada com a perda de cartilagem ao longo do tempo, ocorrendo no osso na mesma região da perda cartilaginosa do joelho(25). Estes achados foram consistentes em ambos os compartimentos do joelho, embora sugerissem que os efeitos se apresentaram em maior magnitude em áreas específicas que suportaram maior carga.
Cabe salientar que a cartilagem e o osso subjacente podem sofrer modificações na osteoartrite, como resultado da carga transmitida a esses tecidos. A fadiga óssea influencia a perda da cartilagem sobrejacente, em consequência de alterações na forma da superfície óssea, podendo tornar essa estrutura mais vulnerável à carga. Essa fadiga pode, portanto, servir como marcador de área submetida a forças compressivas na qual a perda de cartilagem se torna inevitável(18,25).
Lories(26) e Brandt et al.(27), em estudos recentes sobre a etiopatogênese da osteoartrite, concluíram que na atualidade é comumente aceito que complexas interações entre os vários mecanismos de reparo e regeneração do osso, após uma agressão inicial, podem explicar muitas das alterações articulares vistas tardiamente na doença.
CAUSAS DE FADIGA ÓSSEA
O desalinhamento dos joelhos pode associar-se ao aumento da prevalência e incidência de fadiga do osso subcondral de uma forma compartimental específica(28). Por exemplo, quando o joelho apresenta deformidade em varo, o estresse mecânico é transmitido pelo compartimento medial. Esta deformidade relaciona-se com risco aumentado de progressão dos danos estruturais visualizados em joelhos com osteoartrite pré-existente e com a perda de cartilagem no compartimento acometido. Além disso, um estudo multicêntrico sobre osteoartrite (MOST) demonstrou que o desalinhamento associou-se à fadiga óssea no compartimento submetido a maior estresse(18,25,27,29-32).
A fadiga pode representar alterações da remodelação óssea em resposta às forças mecânicas que atuam sobre o osso(33). A contribuição de lesões da medula óssea à gravidade da dor depende da presença de fadiga óssea subarticular(34). Essas lesões são consideradas como um reflexo do mau alinhamento no compartimento articular específico(35,36). Um estresse articular provoca remodelação óssea subcondral, com consequente fadiga nessas áreas que enfrentam maior tensão(37).
MANIFESTAÇÕES CLÍNICAS DA FADIGA ÓSSEA
Neogi et al.(25), em um estudo transversal, sugeriram que a fadiga óssea está associada a dor nos joelhos, e esta associação foi mais evidente nos joelhos sem osteoartrite evidente pela radiografia convencional, sugerindo que a fadiga óssea participa precocemente na gênese de dor em estágios iniciais ou moderados da doença.
Dieppe et al.(23) relataram evidências de possível relação entre fadiga óssea observada radiograficamente e dor noturna. Em outro estudo, Dieppe(38), utilizando imagens de RM e que envolveu 143 indivíduos com osteoartrite dolorosa de joelho, evidenciou que a intensidade da dor se encontrava associada a fadiga óssea, lesão de medula óssea, lesões meniscais e sinovite/derrame.
Quando se detecta fadiga óssea em exames radiográficos convencionais, aumenta-se em duas a três a vezes a possibilidade de o paciente apresentar dor, rigidez e incapacidade física. Ao se interpretar radiografias ósseas, deve-se ter atenção não somente com a redução do espaço articular e osteófitos, mas também com o osso subcondral(39).
A alteração do contorno da superfície óssea poderia resultar de processos de remodelação subcondral, como fibrose, necrose e colapso ósseo focal, sendo responsável, em última análise, pela dor articular(40-42).
DIAGNÓSTICO E CLASSIFICAÇÃO
A fadiga óssea não é uma alteração facilmente reconhecida. Pode ser de difícil detecção na ausência de defeitos claros da integridade cortical e em decorrência da sobreposição de estruturas ósseas nas radiografias simples.
Ahlbäck(43), em 1968, introduziu um sistema de classificação que incluía uma avaliação da fadiga óssea por meio de radiografias convencionais. Como as alterações são muito sutis por esse método diagnóstico, e na ausência de anormalidades corticais, a aparência dessas alterações é quase a mesma na RM ou na tomografia computadorizada (TC). Entretanto, estes dois últimos métodos têm a vantagem de propiciar a visão multiplanar.
A fadiga óssea é interpretada na radiografia convencional, na TC e na RM como um achatamento ou depressão das superfícies articulares e é classificada com base no grau subjetivo de desvio do contorno normal em várias imagens. Dessa forma, têmse: grau 0 = normal; grau 1 = leve; grau 2 = moderado; grau 3 = grave (Figura 1)(24).
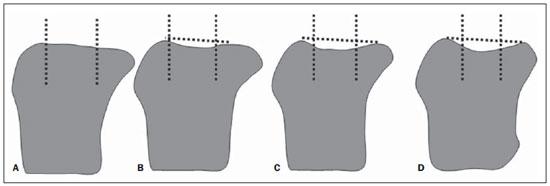
Figura 1. Grau 0 (normal) (A), grau 1 (leve) (B), grau 2 (moderado) (C), grau 3 (grave) (D). Graduação de fadiga óssea subarticular. Classificação baseada no grau de achatamento ou depressão da superfície articular em relação ao normal. Modificado de Peterfy et al.(24).
Por exemplo, as superfícies articulares dos côndilos femorais e da faceta medial da patela são, em geral, ligeiramente convexas. Dessa forma, a convexidade normal é mostrada na Figura 2, enquanto o achatamento dessas estruturas corresponde ao grau 1 (Figura 3), ligeira concavidade é igual a grau 2 (Figura 4) e acentuada concavidade recebe o grau 3 (Figura 5).
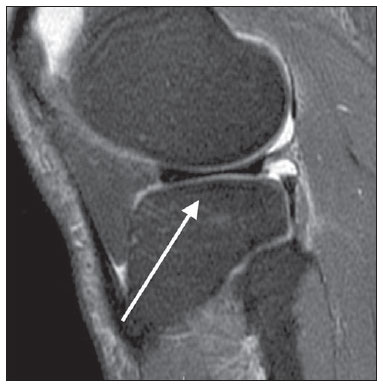
Figura 2. Grau 0 (normal). RM de joelho em corte sagital T2, com saturação de gordura, sem sinais de alterações estruturais.
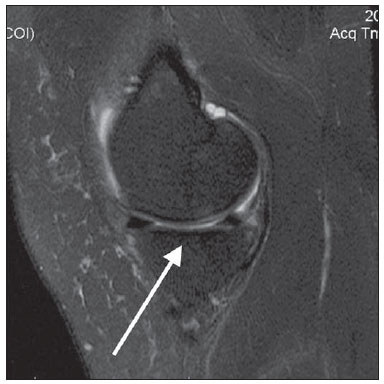
Figura 3. Grau 1 (leve). RM de joelho em corte sagital T2, com saturação de gordura. Sinais de discreto infradesnivelamento do platô tibial, sugerindo fadiga óssea visualizada no platô tibial medial.
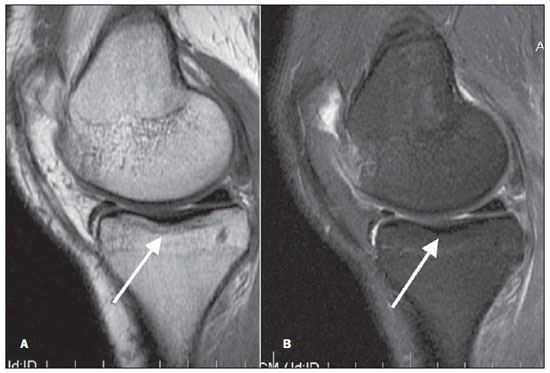
Figura 4. Grau 2 (moderado). RM de joelho em cortes sagitais T1 (A) e T2 (B), com supressão de gordura. Moderado infradesnivelamento do platô tibial, observando-se ainda sinais de discreta esclerose subcondral, caracterizada por hipointensidade de sinal em T1, sugerindo fadiga óssea visualizada no platô tibial medial.
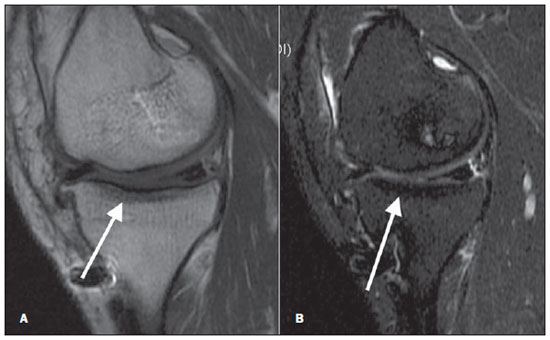
Figura 5. Grau 3 (grave). RM de joelho em cortes sagitais T1 (A) e T2 (B), com supressão de gordura. Sinais de acentuado infradesnivelamento do platô tibial e moderada perda da concavidade com retificação do côndilo femoral, associado ainda a sinais de esclerose subcondral em platô tibial, sugerindo fadiga óssea visualizada no platô tibial medial e no côndilo femoral. A cartilagem hialina de revestimento mostra sinais de comprometimento por alterações da intensidade de sinal e afilamento.
A RM tem-se revelado superior à radiografia simples, pois evidencia a articulação em conjunto com suas estruturas internas(42). A TC vem sendo menos utilizada, pois não mostra com nitidez algumas estruturas internas do joelho, como os meniscos e a cartilagem. Por outro lado, a RM demonstra muito bem todas as estruturas internas do joelho e, também, a remodelação óssea e eventuais alterações de sinais(44).
Caso a fadiga óssea ocorra antes da osteoartrite avançada, poderia sugerir que as alterações ósseas ocorrem simultaneamente com a perda de cartilagem e que os tratamentos visando a recuperação da cartilagem não irão funcionar, mesmo em joelhos que não se apresentem em estágio avançado da doença. Exames de RM sugerem que muitos joelhos com osteoartrite radiograficamente moderada, sem estreitamento do espaço articular, têm alguma evidência de fadiga óssea(45).
DISCUSSÃO
A dor articular pode tornar-se fator limitante e até incapacitante na vida do paciente, podendo acometer qualquer articulação(46,47). A literatura apresenta dados discordantes sobre as reais causas de dor em pacientes com osteoartrite, no entanto, trabalhos recentes multicêntricos como MOST(28,30) têm demonstrado a associação de fadiga óssea com dor.
A alteração por fadiga óssea sempre esteve presente em radiografias convencionais, no entanto, talvez por dificuldade de definição por este método, não foi bem difundida na avaliação clínica de rotina(48).
Atualmente, com a presença de métodos seccionais de alta resolução e equipamentos de RM de alto campo, pode-se definir claramente esta alteração, fato que tem permitido se lidar com o quadro álgico nos pacientes com fadiga óssea.
É importante frisar que a literatura não apresenta, até o presente momento, tratamento específico para a dor quando se trata de fadiga óssea. Com o avanço tecnológico, vislumbra-se um novo campo de pesquisa para o acompanhamento e tratamento desses pacientes.
CONCLUSÕES
Um maior número de estudos poderia nos proporcionar melhores esclarecimentos sobre os limiares da verdadeira fadiga, de preferência contendo leitura independente de fadiga óssea e outras características da osteoartrite.
A perda de cartilagem é vista como uma característica marcante no desenvolvimento da osteoartrite e, até o momento, a resposta do osso tornou-se evidente apenas no final do processo. Em função disso, o osso subcondral pode tornar-se importante para futuras pesquisas relacionadas aos mecanismos de geração da dor, e ainda, para o desenvolvimento de novas estratégias terapêuticas. O envolvimento do osso subcondral, em um momento inicial da doença, pode ajudar a explicar o fracasso dos agentes condroprotetores, como o que ocorre com as drogas modificadoras da doença.
Estudos por meio da RM com sódio e um campo maior que o atual padrão de 1,5 tesla poderiam ser utilizados para explorar dados importantes envolvendo a bioquímica e a fisiologia da fadiga óssea.
Finalmente, a prevalência da fadiga óssea em osteoartrites não avançadas é substancial, e os médicos devem estar cientes de sua importância e de como diagnosticar e descrever esta alteração nos exames desses pacientes.
REFERÊNCIAS
1. Cisternas MG, Yelin E, Katz JN, et al. Ambulatory visit utilization in a national, populationbased sample of adults with osteoarthritis. Arthritis Rheum. 2009;61:1694-703.
2. Jüni P, Reichenbach S, Dieppe P. Osteoarthritis: rational approach to treating the individual. Best Pract Res Clin Rheumatol. 2006;20:721-40.
3. Peterfy CG, Gold G, Eckstein F, et al. MRI protocols for whole-organ assessment of the knee in osteoarthritis. Osteoarthritis Cartilage. 2006;14 Suppl A:A95-111.
4. Clauw DJ, Witter J. Pain and rheumatology: thinking outside the joint. Arthritis Rheum. 2009;60:321-4.
5. Hudelmaier M, Glaser C, Hohe J, et al. Age-related changes in the morphology and deformational behavior of knee joint cartilage. Arthritis Rheum. 2001;44:2556-61.
6. Felson DT. The sources of pain in knee osteoarthritis. Curr Opin Rheumatol. 2005;17:624-8.
7. Wluka AE, Wolfe R, Stuckey S, et al. How does tibial cartilage volume relate to symptoms in subjects with knee osteoarthritis? Ann Rheum Dis. 2004;63:264-8.
8. Kornaat PR, Bloem JL, Ceulemans RY, et al. Osteoarthritis of the knee: association between clinical features and MR imaging findings. Radiology. 2006;239:811-7.
9. Brandt KD, Radin EL, Dieppe PA, et al. Yet more evidence that osteoarthritis is not a cartilage disease. Ann Rheum Dis. 2006;65:1261-4.
10. Hunter DJ, Felson DT. Osteoarthritis. BMJ. 2006;332:639-42.
11. Hill CL, Gale DG, Chaisson CE, et al. Knee effusions, popliteal cysts, and synovial thickening: association with knee pain in osteoarthritis. J Rheumatol. 2001;28:1330-7.
12. Torres L, Dunlop DD, Peterfy C, et al. The relationship between tissue lesion and pain severity in persons with knee osteoarthritis. Osteoarthritis Cartilage. 2006;14:1033-40.
13. Hunter DJ, Lo GH, Gale D, et al. The reliability of a new scoring system for knee osteoarthritis MRI and the validity of bone marrow lesion assessment: BLOKS (Boston Leeds Osteoarthritis Knee Score). Ann Rheum Dis. 2008;67:206-11.
14. Cunha DL, Carvalho ACP, Ribeiro EJS, et al. Ressonância magnética da osteonecrose do joelho: estudo de 19 casos. Radiol Bras. 2010;43:77-80.
15. Ribeiro DS, Araújo Neto C, D'Almeida F, et al. Achados de imagem das alterações musculoesqueléticas associadas ao lúpus eritematoso sistêmico. Radiol Bras. 2011;44:52-8.
16. Rezende MU, Hernandez AJ, Camanho GL, et al. Cartilagem articular e osteoartrose. Acta Ortop Bras. 2000;8:100-4.
17. Imhof H, Breitenseher M, Kainberger F, et al. Degenerative joint disease: cartilage or vascular disease? Skeletal Radiol. 1997;26:398-403.
18. Radin EL, Paul IL, Rose RM. Role of mechanical factors in pathogenesis of primary osteoarthritis. Lancet. 1972;1:519-22.
19. Hayami T, Pickarski M, Zhuo Y, et al. Characterization of articular cartilage and subchondral bone changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis. Bone. 2006;38:234-43.
20. Radin EL, Martin RB, Burr DB, et al. Effects of mechanical loading on the tissues of the rabbit knee. J Orthop Res. 1984;2:221-34.
21. Radin EL, Rose RM. Role of subchondral bone in the initiation and progression of cartilage damage. Clin Orthop Relat Res. 1986;(213):34-40.
22. Burr DB. The importance of subchondral bone in the progression of osteoarthritis. J Rheumatol Suppl. 2004;70:77-80.
23. Dieppe PA, Reichenbach S, Williams S, et al. Assessing bone loss on radiographs of the knee in osteoarthritis: a cross-sectional study. Arthritis Rheum. 2005;52:3536-41.
24. Peterfy CG, Guermazi A, Zaim S, et al. Whole- Organ Magnetic Resonance Imaging Score (WORMS) of the knee in osteoarthritis. Osteoarthritis Cartilage. 2004;12:177-90.
25. Neogi T, Felson D, Niu J, et al. Cartilage loss occurs in the same subregions as subchondral bone attrition: a within-knee subregion-matched approach from the Multicenter Osteoarthritis Study. Arthritis Rheum. 2009;61:1539-44.
26. Lories RJ. Joint homeostasis, restoration, and remodeling in osteoarthritis. Best Pract Res Clin Rheumatol. 2008;22:209-20.
27. Brandt KD, Dieppe P, Radin EL. Etiopathogenesis of osteoarthritis. Rheum Dis Clin North Am. 2008;34:531-59.
28. Neogi T, Nevitt M, Niu J, et al. Subchondral bone attrition may be a reflection of compartment-specific mechanical load: the MOST Study. Ann Rheum Dis. 2010;69:841-4.
29. Dieppe P, Cushnaghan J, Young P, et al. Prediction of the progression of joint space narrowing in osteoarthritis of the knee by bone scintigraphy. Ann Rheum Dis. 1993;52:557-63.
30. Roemer FW, Neogi T, Nevitt MC, et al. Subchondral bone marrow lesions are highly associated with, and predict subchondral bone attrition longitudinally: the MOST study. Osteoarthritis Cartilage. 2010;18:47-53.
31. Sharma L, Song J, Felson DT, et al. The role of knee alignment in disease progression and functional decline in knee osteoarthritis. JAMA. 2001;286:188-95.
32. Hunter DJ, Zhang Y, Niu J, et al. Structural factors associated with malalignment in knee osteoarthritis: the Boston osteoarthritis knee study. J Rheumatol. 2005;32:2192-9.
33. Hernández-Molina G, Neogi T, Hunter DJ, et al. The association of bone attrition with knee pain and other MRI features of osteoarthritis. Ann Rheum Dis. 2008;67:43-7.
34. Torres L, Dunlop DD, Peterfy C, et al. The relationship between specific tissue lesions and pain severity in persons with knee osteoarthritis. Osteoarthritis Cartilage. 2006;14:1033-40.
35. Felson DT, McLaughlin S, Goggins J, et al. Bone marrow edema and its relation to progression of knee osteoarthritis. Ann Intern Med. 2003;139(5 Pt 1):330-6.
36. Hunter DJ, Zhang Y, Niu J, et al. Increase in bone marrow lesions associated with cartilage loss: a longitudinal magnetic resonance imaging study of knee osteoarthritis. Arthritis Rheum. 2006;54:1529-35.
37. Dequeker J. The relationship between osteoporosis and osteoarthritis. Clin Rheum Dis. 1985;11:271-96.
38. Dieppe P. Subchondral bone should be the main target for the treatment of pain and disease progression in osteoarthritis. Osteoarthritis Cartilage. 1999;7:325-6.
39. Reichenbach S, Dieppe PA, Nüesch E, et al. Association of bone attrition with knee pain, stiffness and disability: a cross-sectional study. Ann Rheum Dis. 2011;70:293-8.
40. Zanetti M, Bruder E, Romero J, et al. Bone marrow edema pattern in osteoarthritic knees: correlation between MR imaging and histologic findings. Radiology. 2000;215:835-40.
41. Martig S, Boisclair J, Konar M, et al. MRI characteristics and histology of bone marrow lesions in dogs with experimentally induced osteoarthritis. Vet Radiol Ultrasound. 2007;48:105-12.
42. Bergman AG, Willén HK, Lindstrand AL, et al. Osteoarthritis of the knee: correlation of subchondral MR signal abnormalities with histopathologic and radiographic features. Skeletal Radiol. 1994;23:445-8.
43. Ahlbäck S. Osteoarthrosis of the knee. A radiographic investigation. Acta Radiol Diagn (Stockh). 1968;Suppl 277:7-72.
44. Yusuf E, Kortekaas MC, Watt I, et al. Do knee abnormalities visualised on MRI explain knee pain in knee osteoarthritis? A systematic review. Ann Rheum Dis. 2011;70:60-7.
45. Reichenbach S, Guermazi A, Niu J, et al. Prevalence of bone attrition on knee radiographs and MRI in a community-based cohort. Osteoarthritis Cartilage. 2008;16:1005-10.
46. Melo Junior CF, Saito OC, Guimarães Filho HA. Avaliação ultrassonográfica dos distúrbios intracapsulares temporomandibulares. Radiol Bras. 2011;44:355-9.
47. Lima CMAO, Ribeiro EB, Coutinho EPD, et al. Síndrome do impacto do tornozelo na ressonância magnética: ensaio iconográfico. Radiol Bras. 2010;43:53-7.
48. Albuquerque RP, Carvalho ACP, Giordano V, et al. Estudo comparativo entre incidências radiográficas para a osteoartrose do joelho. Acta Reumatol Port. 2009;34:380-7.
1. Médicos Radiologistas do Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.
2. Doutor, Professor Adjunto do Departamento de Propedêutica Complementar da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.
3. Doutor, Professor Associado do Departamento de Propedêutica Complementar da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.
4. Mestre, Professora Assistente do Departamento de Propedêutica Complementar da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.
5. Doutora, Professora Adjunta do Departamento do Aparelho Locomotor da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.
Endereço para correspondência:
Dr. Wilson Campos Tavares Júnior
Rua Gonçalves Dias, 750/1803, Funcionários
Belo Horizonte, MG, Brasil, 30140-091
E-mail: wilsoncamp2000@yahoo.com.br
Recebido para publicação em 25/4/2012.
Aceito, após revisão, em 20/8/2012.
* Trabalho realizado no Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.
 Vol. 45 nº 5 - Set. / Out. of 2012
Vol. 45 nº 5 - Set. / Out. of 2012




