INTRODUÇÃO
Tumores miofibroblásticos inflamatórios (TMIs), pseudotumores inflamatórios ou tumores pseudossarcomatosos fibromixoides são tumores mesenquimais originados da proliferação não neoplásica de células miofibroblásticas e inflamatórias com etiologia e potencial maligno incertos que acometem vários sítios anatômicos, sobretudo pulmão e fígado(1). Estudos recentes sugerem o envolvimento do cromossomo 2p23(2) e a co-infecção com
Mycobacterium tuberculosis(3) na patogênese dos TMIs.
Neste artigo relatamos o caso de uma criança atendida no Hospital Universitário e no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo com diagnóstico de TMI de bexiga, enfocando os achados radiológicos e diagnóstico diferencial da doença.
RELATO DO CASO
Paciente do sexo feminino, 13 anos de idade, com queixa de dor abdominal há um mês, perda ponderal (6 kg) e hematúria macroscópica. Apresentava-se em bom estado geral, hipocorada (++/4+), com abdome dolorido à palpação. Exames laboratoriais demonstraram anemia normocítica/normocrômica (hemoglobina = 7,8 mg/dl), hematúria e leucocitúria, com urocultura negativa. Leucograma e provas de função renal e hepáticas inalteradas.
Ultrassonografia revelou massa heterogênea na parede vesical, medindo 6,0 × 3,0 cm, com vascularização interna ao Doppler (Figura 1). Tomografia computadorizada (TC) evidenciou espessamento difuso da parede vesical e lesão expansiva heterogênea lobulada, na parede superior, medindo 6,0 × 4,1 cm, apresentando realce heterogêneo, com borramento da gordura adjacente (Figura 2).
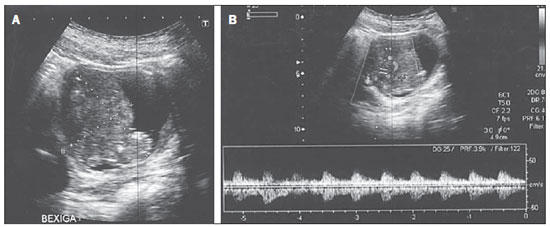
Figura 1. A: Ultrassonografia pélvica evidenciando massa heterogênea e lobulada na parede vesical. B: Mapeamento Doppler da massa vesical demonstrando fluxo de padrão arterial em seu interior.
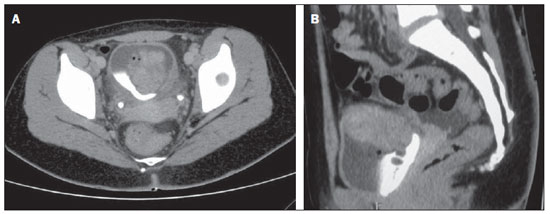
Figura 2. A: Tomografia computadorizada de pelve em corte axial após contraste intravenoso (fase excretora) mostrando lesão expansiva heterogênea lobulada na parede superior da bexiga, com realce heterogêneo e borramento da gordura adjacente. B: Tomografia computadorizada de pelve em corte sagital após contraste intravenoso (fase excretora) evidenciando espessamento parietal vesical difuso e a referida lesão expansiva.
Foi realizada biópsia de congelação seguida de ressecção do tumor, com peça cirúrgica medindo 10,0 × 7,5 × 4,0 cm, coloração acastanhada e pedículo medindo 2,0 × 1,5 cm. O exame anatomopatológico confirmou TMI, com áreas de ulceração da mucosa, estendendo-se até a camada muscular própria e mucosa adjacente, apresentando hiperplasia urotelial sem atipias. A paciente evoluiu sem intercorrências pós-operatórias.
No período de seguimento, ressonância magnética (RM) de pelve realizada após dois meses demonstrou alterações fibróticas pós-operatórias, sem sinais de recidiva. Ultrassonografias abdominais de controle não mostraram alterações.
DISCUSSÃO
Os TMIs raramente acometem as vias urinárias e estão amiúde associados a traumatismos, infecções ou instrumentação do trato geniturinário(1). São mais comuns em adultos e raros em crianças, sendo que meta-análise recente identificou apenas 35 casos descritos de TMI de bexiga nesta faixa etária(4).
Os TMIs de bexiga podem ser localmente agressivos e mimetizar neoplasia maligna na cistoscopia e nos exames de imagem, sendo este seu principal diagnóstico diferencial. Embora possam acometer qualquer sítio vesical, há discreta predileção pela parede superior(5). Critérios essenciais para o diagnóstico anatomopatológico incluem proliferação de células fusiformes mioepiteliais e um infiltrado linfocítico(2). A imuno-histoquímica pode revelar positividade para citoqueratina, vimentina e quinase do linfoma anaplásico (ALK)(2).
Na avaliação por imagem, variantes císticas e sólidas já foram relatadas, embora geralmente se observe massa única com aspecto exofítico ou polipoide, quase sempre poupando o trígono vesical(6). Na TC e na ultrassonografia, muitas lesões são mal definidas e invadem os tecidos circunjacentes, sendo a vascularização interna geralmente identificada ao Doppler colorido(6). Grandes lesões podem apresentar componente extravesical com difícil diferenciação com tumores malignos. A lesão geralmente compreende tecido necrótico na região central e células fusiformes em um estroma edematoso com vasos e células inflamatórias na periferia, explicando o realce pós-contraste anelar na TC. Na RM, as imagens ponderadas em T2 mostram área central hiperintensa e periferia com baixa intensidade de sinal, enquanto os carcinomas de bexiga geralmente apresentam sinal hiperintenso. Após administração de contraste, o sinal da periferia aumenta significativamente, enquanto o da região central aumenta pouco(6).
O tratamento consiste em ressecção cirúrgica, corticoterapia, radioterapia ou tratamento conservador, sendo geralmente rara a recidiva após ressecção.
Haja vista a grande sobreposição de achados radiológicos entre TMI, rabdomiossarcoma e leiomiossarcoma, faz-se premente a diferenciação anatomopatológica diante dos achados descritos, tencionando-se reduzir o número de cirurgias radicais desnecessárias.
REFERÊNCIAS
1. Lecuona AT, Van Wyk AC, Smit SG, et al. Inflammatory myofibroblastic tumor of the bladder in a 3-year-old boy. Urology. 2012;79:215-8.
2. Yagnik V, Chadha A, Chaudhari S, et al. Inflammatory myofibroblastic tumor of the urinary bladder. Urol Ann. 2010;2:78-9.
3. Androulaki A, Papathomas TG, Liapis G, et al. Inflammatory pseudotumor associated with Mycobacterium tuberculosis infection. Int J Infect Dis. 2008;12:607-10.
4. Houben CH, Chan A, Lee KH, et al. Inflammatory myofibroblastic tumor of the bladder in children: what can be expected? Pediatr Surg Int. 2007;23:815-9.
5. Kim H, Oh SN, Rha SE, et al. Inflammatory myofibroblastic tumor of the bladder: report of two cases. J Korean Soc Radiol. 2010;63:261-5.
6. Wong-You-Cheong JJ, Woodward PJ, Manning MA, et al. From the archives of the AFIP: Inflammatory and nonneoplastic bladder masses: radiologic-pathologic correlation. Radiographics. 2006;26:1847-68.
1. Médico Pós-graduando em Radiologia e Diagnóstico por Imagem do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
2. Médicos Assistentes do Serviço de Imagenologia do Hospital Universitário da Universidade de São Paulo (HU-USP), São Paulo, SP, Brasil.
3. Médica Pós-graduanda, Residente em Patologia do Hospital das Clínicas da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
4. Professor Titular do Departamento de Radiologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil.
5. Livre-docente, Professor do Departamento de Radiologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), Diretor do Serviço de Imagenologia do Hospital Universitário da Universidade de São Paulo (HU-USP), São Paulo, SP, Brasil.
Endereço para correspondência:
Dr. José de Arimatéia Batista Araújo Filho
Alameda Santos, 2534, ap. 51, Cerqueira César
São Paulo, SP, Brasil, 01418-200
E-mail: ariaraujocg@hotmail. com
Recebido para publicação em 24/2/2012.
Aceito, após revisão, em 24/5/2012.
Trabalho realizado no Hospital Universitário da Universidade de São Paulo (HU-USP) e no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
 Vol. 45 nº 4 - Jul. / Ago. of 2012
Vol. 45 nº 4 - Jul. / Ago. of 2012

