INTRODUÇÃO
Nos últimos anos observamos expressiva evolução na área da radiologia e diagnóstico por imagem, com o surgimento da tomografia computadorizada multidetectores (TCMD) com até 320 canais e da ressonância magnética (RM) de alto campo (3 T), entre outros métodos, com a consequente obtenção de imagens com maior qualidade e precisão. No contexto dessa evolução, na tentativa de se obter não apenas uma avaliação estrutural, mas também uma análise funcional e metabólica de diversos órgãos e tipos de lesões, novas técnicas de exames têm sido desenvolvidas. Dentre essas novas modalidades de imagem, que fornecem não apenas informações estruturais, mas também funcionais, podemos citar a difusão e a espectroscopia por RM, o PET-CT e a perfusão por RM e TC. Os dados fornecidos por este grupo de exames de imagem têm sido denominados de biomarcadores, por permitirem analisar o comportamento biológico de tecidos sadios e doentes e possibilitando, assim, entre outras utilidades, predizer precocemente a resposta terapêutica a tratamentos quimioterápicos, principalmente aqueles que utilizam drogas com propriedades citostáticas e antiangiogênicas(1). As indicações são bastante variadas, entre as quais podemos citar a diferenciação entre processos inflamatórios e tumorais, o grau de comprometimento funcional de certos órgãos, a presença de tecido tumoral residual ou recidivado após terapêuticas minimamente invasivas, entre outras(1—7). Entre estas ferramentas, a perfusão por TC (PTC) tem despertado, recentemente, o interesse de muitos pesquisadores(1,3,5,7), em virtude da sua reprodutibilidade, robustez e eficácia, decorrente da maior disponibilidade de tomógrafos equipados com tecnologia de múltiplos detectores (TCMD) e atualmente disponíveis na rede pública, como na nossa Instituição.
APLICAÇÕES DO MÉTODO
A PTC é técnica relativamente recente, que permite um estudo funcional dos tecidos pela avaliação de sua vascularização. Este método mensura as alterações temporais na densidade tecidual, após a injeção de meio de contraste intravenoso, usando séries dinâmicas de aquisição de imagens(1).
A PTC assumiu, inicialmente, um papel de destaque na avaliação de pacientes com insulto vascular cerebral isquêmico agudo, pois permite uma análise estrutural e funcional do
status vascular cerebral, auxiliando no planejamento terapêutico e, consequentemente, influenciando na avaliação do prognóstico do paciente(8).
Nos últimos anos ocorreu uma ampliação do uso deste método, para a radiologia abdominal, principalmente no campo oncológico, em que a PTC tem sido utilizada no diagnóstico, estadiamento, avaliação prognóstica e monitoração da resposta terapêutica, com potencial para ser o método de escolha para a avaliação da resposta tumoral a drogas antiangiogênicas, bem como a tratamentos minimamente invasivos, tais como a embolização intra-arterial, a alcoolização percutânea e a termoablação por radiofrequência(1,6,9,10).
Estudos têm mostrado, ainda, outras utilidades da PTC no campo abdominal, como na diferenciação entre diverticulite e neoplasia colorretal(7), na avaliação das alterações perfusionais na cirrose hepática(2,4,5,11) e na avaliação pós-transplante de órgãos(12).
Alguns resultados obtidos nesses estudos têm-se revelado bastante interessantes, como os observados na diferenciação entre diverticulite e câncer colorretal(7) e na avaliação de pacientes com pancreatite aguda grave(13). Na pancreatite aguda, a PTC tem mostrado sensibilidade de 100% e especificidade de 95% na detecção de isquemia pancreática, o que pode auxiliar em predizer um posterior desenvolvimento de necrose pancreática(13). Sabe-se que a necrose pancreática aumenta substancialmente a morbimortalidade do paciente e sua detecção precoce permite um tratamento mais intensivo, prevenindo outras complicações e melhorando, assim, o prognóstico(13). Também na distinção entre diverticulite e o câncer colorretal, a PTC revelou-se útil ao permitir identificar uma diferença significativa entre os principais parâmetros perfusionais dos pacientes com câncer colorretal e os pacientes com diverticulite. Foi observado que o volume sanguíneo (
blood volume — BV) e o fluxo sanguíneo (
blood flow — BF) apresentam, respectivamente, sensibilidade de 80% e especificidade de 75% para o diagnóstico de câncer(7).
TÉCNICA DO EXAME: PRINCÍPIOS BÁSICOS
O estudo e a análise por PTC são baseados nas mudanças temporais de atenuação tecidual, medidas em unidades Hounsfield (UH), após administração intravenosa do meio de contraste. O realce tecidual depende da concentração de iodo no tecido e de forma indireta reflete a vascularização tecidual e a fisiologia vascular(14,15). Após a administração do contraste iodado, o realce tecidual pode ser dividido em duas fases, baseadas na sua distribuição no compartimento intra e extravascular(14).
Na fase inicial, o realce é puramente atribuído à distribuição do contraste no interior do espaço intravascular, e esta fase usualmente dura cerca de 40 a 60 segundos, após a chegada do meio de contraste neste compartimento(1,2,14—16). Na segunda fase, o contraste passa do compartimento intravascular para o extravascular, através da membrana basal. Desta forma, o realce tecidual resulta da distribuição do meio de contraste entre esses dois compartimentos(1,14).
Na primeira fase, o realce é determinado em grande parte pelo fluxo sanguíneo tecidual e pelo volume sanguíneo, ao passo que na segunda fase é mais influenciado pela permeabilidade vascular(1).
O fluxo sanguíneo ou perfusão é definido como sendo o fluxo sanguíneo através do tecido de interesse por unidade de tempo e volume e medido em mililitros de sangue por 100 gramas de tecido por minuto (ml/100 g/min). O volume sanguíneo é o volume de sangue que passa pela região de interesse, medido em mililitros de sangue por 100 gramas de tecido (ml/100 g). O pico de realce (
peak enhancement — PE) representa o pico de realce tecidual decorrente da administração do meio de contraste e medido em UH(10).
O tempo para o pico de realce (
time to peak — TTP) é definido como o tempo decorrido para se atingir o pico de realce e é medido em segundos. Já o tempo de trânsito médio (
mean transit time — MTT) representa o tempo médio que o sangue leva para atravessar a rede capilar de uma determinada região passando das arteríolas para as vênulas e é medido em segundos. A superfície de permeabilidade (
permeability surface — PS) está relacionada ao coeficiente de difusão das moléculas do meio de contraste através dos poros do endotélio capilar para o espaço extravascular e é medida em ml/100 g/min(10).
Com os atuais aparelhos tomográficos é possível obter imagens de forma rápida e sucessiva de uma área de interesse durante essas duas fases, captando as mudanças temporais da atenuação tecidual e aplicando a estas imagens modelos matemáticos apropriados para que a perfusão tecidual possa ser quantificada(1,2,14).
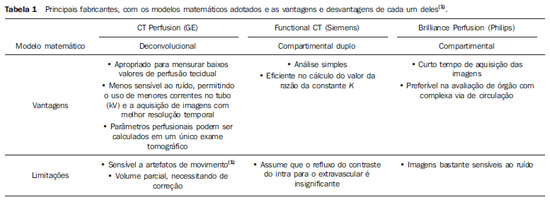
Os dois modelos matemáticos mais usados para o processamento dos dados são o compartimental e o deconvolucional, o que, de certa forma, influenciará o desenho de protocolo de exame(1,2).
Modelos matemáticos
a) Modelo compartimental
Neste modelo, a análise pode ser realizada pela utilização do método compartimental único ou pelo método duplo(2,10,16).
No método compartimental único assume-se que os espaços intra e extravasculares são compartimento único, e o cálculo da perfusão tecidual é baseado no princípio da conservação de massa no interior do sistema (princípio de Fick). Por este princípio, estima-se a perfusão usando o ponto máximo da curva de concentração tecidual normalizado para curva de concentração arterial do contraste em relação ao tempo (função de entrada de dados de fluxo arterial)(2,10,15).
O método compartimental duplo assume que os compartimentos intra e extravascular são compartimentos distintos(1,2). Este modelo utiliza a técnica chamada de análise de Patlak, a qual quantifica a passagem do contraste do espaço intravascular para o extravascular e mensura a permeabilidade capilar e o volume sanguíneo(2,10,14—16).
b) Modelo deconvolucional
Este modelo é baseado no uso da curva arterial e da curva de tempo-concentração tecidual (
tissue time-concentration curve), para calcular a função de resíduo de impulso (
impulse residue function — IRF) do tecido de interesse(1,2), onde IRF é uma curva tecidual teórica que é obtida a partir das informações de dados de fluxo arterial direto (
direct arterial input). A elevação da curva reflete a perfusão tecidual e a área abaixo da curva reflete o volume sanguíneo(2).
Estudos preliminares mostram forte correlação entre os resultados obtidos pelos dois modelos, sugerindo que eles são equivalentes(2). Porém, existem diferenças entre os modelos quanto a sua validação, suscetibilidade ao movimento e ruído(2,17).
A análise compartimental é baseada na hipótese de que o
bolus de meio de contraste deve estar retido no órgão de interesse no momento da mensuração, o que pode resultar em uma subestimação dos valores perfusionais em órgão com rápido transito vascular(1,2,18).
A análise deconvolucional, no entanto, assume que a forma do IRF é um platô com um
washout exponencial único. Embora esta hipótese seja validada para a maioria dos órgãos, pode não ser adequada para órgão com complexa via de circulação(1,2,18).
Sendo assim, o método compatimental é preferível na avaliação de órgãos com complexa via de circulação, como baço e rins(1). Também é bastante útil na avaliação hepática, pois estima separadamente os componentes arterial e portal(19—23).
Por outro lado, o método deconvolucional é apropriado para mensurar baixos valores de perfusão tecidual (< 20 ml/min/100 ml), tipicamente observados nos casos de tumores pós-tratamento(1,2,19,20).
O modelo deconvolucional é menos sensível ao ruído, permitindo o uso de menores correntes no tubo (kV) e a aquisição de imagens com melhor resolução temporal. No modelo compartimental, a presença de ruído nas imagens pode resultar em erros no cálculo dos valores perfusionais(1). Diversos fabricantes adotam modelos distintos de cálculo da PTC nos seus equipamentos (Tabela 1).
Protocolo de exame
Vários protocolos de PTC têm sido propostos e dependem de muitas variáveis, tais como órgão de interesse, modelo matemático utilizado (compartimental ou deconvolucional), equipamento disponível e objetivo clínico. Entre estas variáveis, o modelo matemático e o equipamento utilizado interferem diretamente no protocolo de exame (por exemplo: volume de contraste, velocidade de injeção e intervalo entre início da injeção e da aquisição de dados ou
delay) e em seus parâmetros técnicos (kV e mAs). Desta forma, iremos detalhar cada uma destas variáveis.
Tipicamente, a PTC consiste em uma fase sem contraste intravenoso, seguida de uma fase contrastada em que são obtidas imagens dinâmicas da área de interesse. A aquisição dinâmica das imagens pode incluir o estudo da primeira passagem do contraste, o estudo tardio, ou ambos, conforme os parâmetros a serem avaliados(2).
a) Fase sem contraste
É a primeira fase do exame, em que se realiza uma varredura desde as bases pulmonares até a sínfise púbica, utilizando os parâmetros técnicos habituais de cada serviço. Esta fase, basicamente, serve para localizar e demarcar a área de interesse (ou área de cobertura) que irá ser analisada após a administração do meio de contraste. Esta área de cobertura dependerá da configuração do tomógrafo utilizado. Equipamentos com 4 ou 16 canais possuem área de cobertura de até 2 cm; os com 64 canais possuem área de cobertura de 4 cm. Áreas de cobertura maiores (8 a 16 cm) são possíveis em equipamentos com 128 e 320 canais ou com diversos algoritmos de reconstrução(1).
b) Fase dinâmica (pós-contraste)
Esta fase é a mais importante do estudo, pois por intermédio dela se obtêm os dados necessários para o processamento e análise perfusional. Nesta fase são obtidas imagens da área previamente demarcada, de forma dinâmica, após administração do meio de contraste.
Para o estudo de primeira passagem do contraste, utilizando o método deconvolucional, as imagens são obtidas a cada segundo; no método compartimental as imagens são obtidas a cada 3 a 5 segundos, durante os primeiros 40 a 60 segundos(2,4,7).
Com esta aquisição dinâmica conseguimos acompanhar a chegada do meio de contraste e sua primeira passagem através do compartimento intravascular(1).
Para se obter esta fase, alguns parâmetros técnicos são de extrema importância, como o mAs, o kVp, o volume e a concentração do meio de contraste e a sua velocidade de injeção, pois influem diretamente nos resultados obtidos. Observa-se, na literatura, grande variação destes parâmetros, os quais dependem do tomógrafo empregado (marca e número de detectores) e do modelo matemático que é utilizado na análise dos dados. Deste modo, comentaremos a respeito de cada um deles.
b.1) Parâmetros técnicos (mAs e kVp)
A utilização de baixa voltagem (kVp) e corrente do tubo (mAs) é recomendada para reduzir a dose de radiação recebida pelo paciente. Voltagem do tubo entre 80 e 100 kVp é geralmente apropriada para a maioria das aplicações clínicas em PTC(1,2,10).
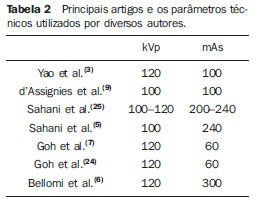
A análise da literatura mostra grande variação nos valores de mAs (entre 50 e 250 mAs), na dependência do modelo matemático que será utilizado. Para o método deconvolucional recomenda-se adotar valores entre 50 e 100 mAs. Para o método compartimental são necessários valores de mAs mais altos, entre 100 e 250(1,5,24) (Tabela 2).
b.2) Dose de radiação
A dose de radiação efetiva empregada em alguns estudos variou entre 10 e 12 mSV(7,9,24), na dependência dos parâmetros técnicos utilizados.
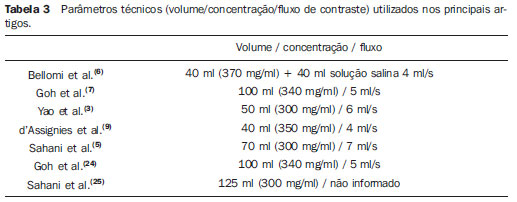
Na nossa experiência, a técnica de PTC agregou cerca de 12 mSv em média por paciente ao exame de TC convencional, cuja dose de radiação para as três fases tem variado entre 20 e 25 mSv (entre 7 e 8 mSv por fase de aquisição). Estes valores encontram-se dentro dos limites recomendados para exposição anual à radiação ionizante(25). Diversos estudos têm procurado demonstrar o valor da PTC obtida com baixas doses de radiação, reduzindo-se o kVp(5,9) e o mAs(7,24) (Tabela 3).
b.3) Volume de contraste, concentração e velocidade de injeção
Um volume de contraste entre 40 e 70 ml e uma velocidade de injeção entre 3,5 e 10 ml/s são geralmente adequados para uma ótima avaliação perfusional(1,2,10,16).
Esta grande variação ocorre em função do modelo matemático que cada aparelho utiliza. Para os que adotam o método compartimental, injeção com velocidade entre 5 e 10 ml/s é preferida. Em equipamentos que adotam o método deconvolucional, utilizam-se menores fluxos de injeção (por exemplo: entre 3,0 e 5,0 ml/s). No entanto, como já citado, altas velocidades de injeção (7 a 10 ml/s) são consideradas benéficas para maximizar o realce tecidual e otimizar a relação sinal-ruído (Tabela 3)(1). Nos nossos estudos temos adotado velocidade de injeção de 6,0 ml/s, utilizando-se cateterização de veia antecubital calibrosa através de Gelco calibre 18G ou 20G.
Devido à relação linear entre a concentração de iodo e o realce tecidual, maiores concentração de iodo no meio de contraste (370 a 400 mg/ml) são ideais(1,2,16) e esta tem sido a estratégia adotada por nós, sempre que possível.
b.4) Intervalo (delay)
Na maioria das aplicações clínicas, um intervalo de 5 a 15 segundos entre o início da injeção e o início da aquisição das imagens (
delay) é considerado adequado, na dependência da região avaliada, sendo ideal um
delay entre 5 e 8 segundos para estudos da região cervical, tórax e abdome, e entre 10 e 15 segundos para estudos da pelve e das extremidades(1).
Aquisição das imagens tomográficas
Em nossa instituição, os exames de TC de abdome e pelve são realizados em equipamento
multislice com 64 fileiras de detectores, marca Philips, modelo Brilliance 64 (Philips Medical Systems; Best, Holanda) com
software de perfusão da própria empresa (Brilliance Perfusion 4.0).
O exame de PTC é constituído por duas fases, conforme relatado anteriormente.
A primeira fase é realizada sem administração intravenosa de meio de contraste, executada com técnica
multislice e aquisição volumétrica estendendo-se desde o diafragma até a sínfise púbica. Os parâmetros técnicos da TC usados nessa fase envolvem colimação de 64 × 0,625 mm, 120 kVp, mAs 120,
pitch de 0,891 e espessura de corte de 3 mm. Esta primeira fase é utilizada para realizar a marcação da área de interesse, que terá uma extensão de 4 cm, onde será realizado o estudo perfusional. Novos programas de aquisição e reconstrução (por exemplo: Jog-scan
®), ainda não amplamente disponíveis, permitem multiplicar por dois a extensão da área de estudo ao longo do eixo z.
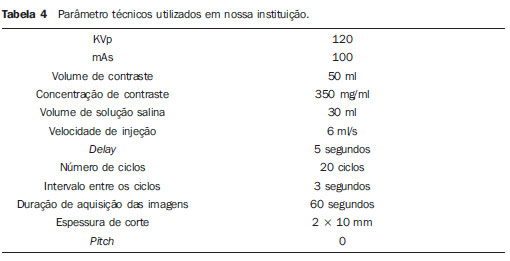
A segunda fase, que corresponde ao estudo perfusional propriamente dito, é realizada após a administração intravenosa do meio de contraste iodado, hidrossolúvel e não iônico, obtendo-se cortes axiais na área demarcada anteriormente, utilizando os parâmetros tomográficos relacionados na Tabela 4, conforme já publicado(3).
Para diminuir a presença de artefatos de movimento respiratório, que é a principal causa de insucesso na aquisição das imagens, é utilizada uma faixa de compressão abdominal (disponível no próprio aparelho), sendo o paciente orientado para respirar da forma a mais lenta e pausada possível. Desta maneira garante-se a obtenção de imagens de boa qualidade e sem artefatos de respiração (Figura 1).
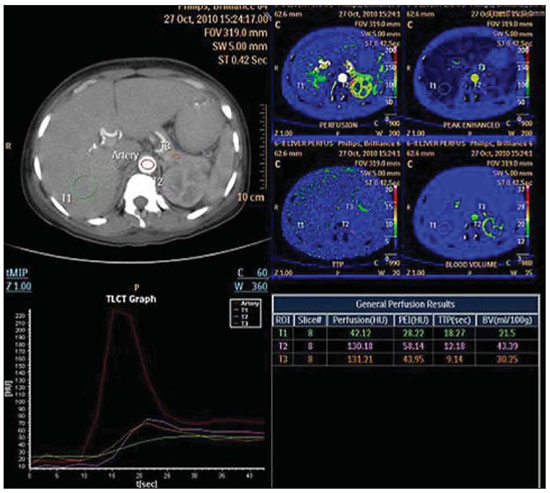
Figura 1. Exame de PTC, em que se obtêm os parâmetros perfusionais do fígado (segmento VI), cortical renal e pâncreas fornecidos em forma de mapa, gráficos e valores absolutos. A sequência foi adquirida durante respiração livre, sem artefatos de respiração expressivos.
Ao término do exame de PTC, as imagens adquiridas e reconstruídas são transferidas para uma estação de trabalho, e utilizando-se o programa CT Perfusion são realizados o seu processamento, a criação dos mapas funcionais coloridos e o cálculo dos parâmetros funcionais.
O programa utilizado é de fácil manuseio e automatizado, sofrendo pouca interferência do usuário na obtenção dos mapas funcionais.
Inicialmente, deve-se fazer uma avaliação da qualidade técnica do exame confirmando a ausência de artefatos respiratórios e de movimento. Em seguida, uma região de interesse (ROI) circular deve ser desenhada na região central de um vaso sanguíneo arterial calibroso (por exemplo: aorta), para ser usado como referência da concentração arterial do meio de contraste e se obter a curva de concentração arterial do contraste em relação ao tempo (
artery input function) (Figura 2). Nos exames da pelve podemos utilizar a artéria ilíaca como o vaso sanguíneo de referência do fluxo arterial.
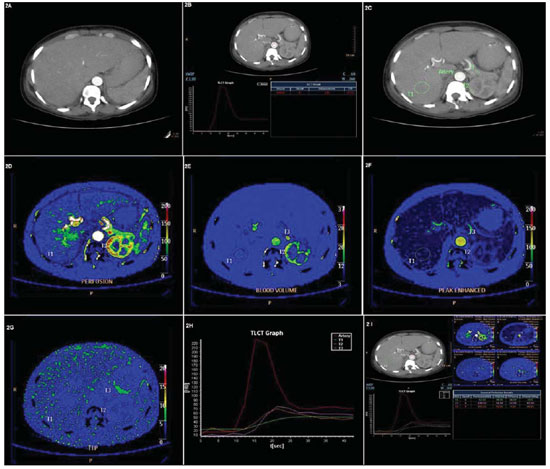
Figura 2. Exame de PTC mostrando passo a passo as principais etapas do processamento das imagens. A: O passo I envolve a escolha das imagens dinâmicas/pós-contraste da área de interesse de estudo. B: O passo II consiste na colocação da ROI na aorta para ser usada como referência da concentração arterial do meio de contraste e se obter a curva de concentração arterial do contraste em relação ao tempo. C: O passo III é a colocação de ROIs na área de interesse a serem estudadas; neste caso foram colocadas de forma aleatória no fígado, cortical renal e pâncreas. D,E,F,G,H: Em seguida (passo IV) são obtidos de forma automática os parâmetros perfusionais (perfusão, BV, PE e TTP), com representação em forma de mapas coloridos, gráficos e valores absolutos. I: Display geral do exame, com todos os parâmetros perfusionais e suas diversas formas de representação (mapas coloridos, gráficos e valores absolutos).
A seguir, desenham-se as ROIs, à mão livre, ao redor das lesões/área de interesse, coincidindo exatamente com os limites externos das mesmas para a quantificação dos parâmetros funcionais (Figura 2). Depois de definidas as ROIs nas lesões em estudo, o programa CT Perfusion calcula automaticamente os valores perfusionais, de acordo com o equipamento e o modelo matemático utilizado(1).
CONCLUSÃO
A PTC possui indicações bastante variadas, tais como a diferenciação entre processos inflamatórios e tumorais, comprometimento funcional de certos órgãos, diagnóstico de recidiva tumoral após terapêuticas minimamente invasivas, entre outras.
O seu principal diferencial sobre as outras técnicas reside na capacidade de caracterizar comportamentos perfusionais distintos e que traduzem alterações biológicas de determinadas lesões e tecidos doentes.
Após ampla revisão da literatura e a inserção do exame na nossa rotina de atendimento, podemos concluir que a PTC é um método de fácil execução, com aplicabilidade em diversas doenças abdominais. Por isso, acreditamos que este método terá espaço não apenas no campo da pesquisa, mas também na prática diária, sendo uma ferramenta adicional ao estudo tomográfico convencional.
No entanto, estratégias de redução de dose de radiação e programas (
softwares) que possam proporcionar um aumento na área de avaliação podem ampliar ainda mais a utilização do método.
REFERÊNCIAS
1. Kambadakone AR, Sahani DV. Body perfusion CT: technique, clinical applications, and advances. Radiol Clin North Am. 2009;47:161—78.
2. Miles KA. Perfusion CT for the assessment of tumour vascularity: which protocol? Br J Radiol. 2003;76 Spec No 1:S36—42.
3. Yao J, Yang ZG, Chen TW, et al. Perfusion changes in gastric adenocarcinoma: evaluation with 64-section MDCT. Abdom Imaging. 2010;35:195—202.
4. Pandharipande PV, Krinsky GA, Rusinek H, et al. Perfusion imaging of the liver: current challenges and future goals. Radioloy. 2005;234:661—73.
5. Sahani DV, Holalkere NS, Mueller PR, et al. Advanced hepatocellular carcinoma: CT perfusion of liver and tumor tissue — initial experience. Radiology. 2007;243:736—43.
6. Bellomi M, Petralia G, Sonzogni A, et al. CT perfusion for the monitoring of neoadjuvant chemotherapy and radiation therapy in rectal carcinoma: initial experience. Radiology. 2007;244:486—93.
7. Goh V, Halligan S, Taylor SA, et al. Differentiation between diverticulitis and colorectal cancer: quantitative CT perfusion measurements versus morphologic criteria — initial experience. Radiology. 2007;242:456—62.
8. Koenig M, Klotz E, Luka B, et al. Perfusion CT of the brain: diagnostic approach for early detection of ischemic stroke. Radiology. 1998;209:85—93.
9. d’Assignies G, Courvelard A, Bahrami S, et al. Pancreatic endocrine tumors: tumor blood flow assessed with perfusion CT reflects angiogenesis and correlates with prognostic factors. Radiology. 2009;250:407—16.
10. Miles KA, Charnsangavej C, Lee FT, et al. Application of CT in the investigation of angiogenesis in oncology. Acad Radiol. 2000;7:840—50.
11. Van Beers BE, Leconte I, Materne R, et al. Hepatic perfusion parameters in chronic liver disease: dynamic CT measurements correlated with disease severity. AJR Am J Roentgenol. 2001;176:667—73.
12. Dawson P. Functional imaging in CT. Eur J Radiol. 2006;60:331—40.
13. Tsuji Y, Yamamoto H, Yazumi S, et al. Perfusion computerized tomography can predict pancreatic necrosis in early stages of severe acute pancreatitis. Clin Gastroenterol Hepatol. 2007;5:1484—92.
14. Miles KA. Tumour angiogenesis and its relation to contrast enhancement on computed tomography: a review. Eur J Radiol. 1999;30:198—205.
15. Miles KA, Griffiths MR. Perfusion CT: a worthwhile enhancement? Br J Radiol. 2003;76:220—31.
16. Miles KA. Functional computed tomography in oncology. Eur J Cancer. 2002;38:2079—84.
17. Cao J, Yang A, Long XY, et al. CT hepatic volume measurement combined with CT perfusion imaging in evaluating the hepatic functional reserve. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2007;32:422—6.
18. Miles KA, McPherson SJ, Hayball MP. Transient splenic inhomogeneity with contrast-enhanced CT: mechanism and effect of liver disease. Radiology. 1995;194:91—5.
19. Miles KA, Hayball MP, Dixon AK. Functional images of hepatic perfusion obtained with dynamic CT. Radiology. 1993;188:405—11.
20. Blomley MJ, Coulden R, Dawson P, et al. Liver perfusion studied with ultrafast CT. J Comput Assist Tomogr. 1995;19:424—33.
21. Tsushima Y, Blomley JK, Kusano S, et al. The portal component of hepatic perfusion measured by dynamic CT: an indicator of hepatic parenchymal damage. Dig Dis Sci. 1999;44:1632—8.
22. Bader TR, Herneth AM, Blaicher W, et al. Hepatic perfusion after liver transplantation: noninvasive measurement with dynamic single-section CT. Radiology. 1998;209:129—34.
23. Miles KA, Leggett DA, Bennett GA. CT derived Patlak images of human kidney. Br J Radiol. 1999;72:153—8.
24. Goh V, Halligan S, Daley F, et al. Colorectal tumor vascularity: quantitative assessment with multidetector CT — do tumor perfusion measurements reflect angiogenesis? Radiology. 2008;249:510—7.
25. D’Ippolito G, Medeiros RB. Exames radiológicos na gestação. Radiol Bras. 2005;38:447—50.
1. Médico Especializando em Radiologia do Abdome do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
2. Médico Radiologista do Setor de Abdome do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
3. Médico Colaborador do Setor de Abdome do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
4. Médica Pós-graduanda do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
5. Professor Livre-Docente do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
Endereço para correspondência:
Dr. Giuseppe D’Ippolito
Rua Professor Filadelfo Azevedo, 617, ap. 61, Vila Nova Conceição
São Paulo, SP, Brasil, 04508-011
E-mail: giuseppe_dr@uol.com.br
Recebido para publicação em 13/9/2011.
Aceito, após revisão, em 10/10/2011.
Trabalho realizado no Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
 Vol. 45 nº 1 - Jan. / Fev. of 2012
Vol. 45 nº 1 - Jan. / Fev. of 2012