INTRODUÇÃO
Doença linfoproliferativa pós-transplante (DLPT) é considerada uma complicação potencialmente fatal secundária a imunossupressão farmacológica em pacientes que são submetidos a transplante de órgãos sólidos. Sua incidência varia de acordo com o órgão transplantado e é significativamente maior em crianças(1—3). DLPT representa um largo espectro de alterações caracterizadas por vários graus de proliferação anormal do tecido linfoide, que se diferenciam em relação a patogênese, aparência histológica e comportamento clínico(1—4).
As manifestações clínicas da DLPT ocorrem mais frequentemente no primeiro ano após o transplante e podem afetar virtualmente qualquer órgão do corpo, focal ou difusamente(2—4). O espectro desta doença envolve lesões hiperplásicas, doença polimórfica ou monomórfica, sendo que esta última forma inclui os linfomas, que são a forma mais grave de acometimento(5).
Os achados de imagem também são variáveis, refletindo a possibilidade de envolvimento de múltiplos órgãos e sistemas, típico da doença. Além de suspeitar do diagnóstico, baseado nos aspectos de imagem, o radiologista tem papel importante na obtenção de material para análise histopatológica por biópsias percutâneas guiadas por métodos de imagem e na avaliação da resposta ao tratamento(4,6,7).
Apesar de alguns estudos já terem avaliado a incidência e apresentação clínica da DLPT(8—11), poucos pesquisadores avaliaram os achados de imagem associados a esta doença. O objetivo do presente estudo foi avaliar a incidência e os aspectos de imagem do linfoma após o transplante hepático em crianças.
MATERIAIS E MÉTODOS
Após aprovação do Comitê de Ética em Pesquisa, foi realizado um estudo retrospectivo dos prontuários de todas as crianças submetidas a transplante hepático entre 2000 e 2008 no Hospital A. C. Camargo, São Paulo, SP.
Um questionário padrão foi preenchido para todos os participantes, incluindo as seguintes variáveis: gênero, idade, data do transplante, tipo de doador (vivo ou cadáver), doença hepática que levou ao transplante, tipo de imunossupressão utilizada e tempo de acompanhamento após o transplante. Para os pacientes que desenvolveram linfoma durante o acompanhamento pós-transplante, foi preenchido também outro formulário com os seguintes dados: tempo entre o transplante e o diagnóstico de linfoma, apresentação clínica, tipo histológico, locais de acometimento, achados dos exames de imagem e desfecho clínico.
Os relatórios dos exames de imagem foram recuperados do arquivo impresso ou digital do Departamento de Imagem e incluíram ultrassonografia (US), tomografia computadorizada (TC), ressonância magnética (RM) e tomografia por emissão de pósitrons (PET-CT). Algumas imagens foram selecionadas para ilustrar os casos de linfoma pós-transplante.
A análise estatística foi realizada utilizando-se o
software SPSS for Windows, versão 17.0 (SPSS Inc.; Chicago, IL, EUA). Dados categóricos foram apresentados como porcentagens. Variáveis contínuas foram expressas como média e desvio-padrão quando a distribuição fosse normal. Os seguintes testes estatísticos foram utilizados para comparar as variáveis: teste do qui-quadrado quando ambas as variáveis eram categóricas; teste t de Student ou teste de Mann-Whitney quando uma das variáveis fosse contínua com distribuição normal ou não, respectivamente. O valor de
p adotado foi de 0,05.
RESULTADOS
No período avaliado, 241 crianças foram submetidas a transplante hepático. A média de idade no momento do transplante foi de 36,9 ± 47,5 meses, variando de 4,5 a 215,2 meses. Mulheres eram a maioria (
n = 133; 55,2%) e tiveram doador vivo (
n = 215; 89,2%). A doença hepática que mais comumente levou ao transplante foi atresia biliar (
n = 162; 67,2%) e o agente imunossupressivo mais utilizado foi o tacrolimus (
n = 203; 84,2%).
Num período médio de acompanhamento de 41,4 ± 26,4 meses, variando de 0 a 125 meses, 16 crianças (6,6%) desenvolveram linfoma. A média de idade no momento do diagnóstico do linfoma foi de 61,1 ± 32,0 meses, variando de 12,1 a 147,0 meses, e a maioria dessas crianças era do sexo masculino (
n = 9; 56,3%). A média de idade no transplante hepático das crianças que desenvolveram linfoma foi inferior à das crianças que não desenvolveram (23,9 ± 18,9
vs. 38,0 ± 48,9 meses;
p = 0,02). Não houve diferença estatisticamente significante na incidência de linfoma de acordo com o gênero, tipo de doador, doença hepática que levou ao transplante ou tipo de imunossupressão.
O tempo entre o transplante hepático e o diagnóstico de linfoma variou de 6,8 a 103,5 meses, com média de 37,2 ± 26,9 meses. Apenas três crianças (18,8%) tiveram diagnóstico no primeiro ano após o transplante (Figura 1).
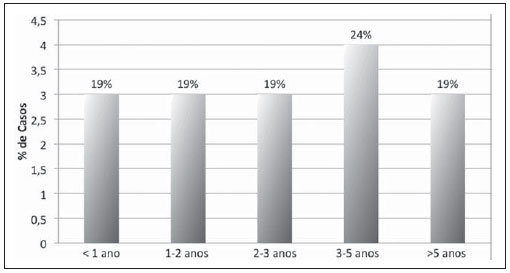
Figura 1. Distribuição dos casos de linfoma em crianças submetidas a transplante hepático de acordo com o tempo entre o transplante e o diagnóstico do linfoma.
Os sintomas mais frequentes foram dor abdominal, aumento do volume abdominal e aumento de linfonodos cervicais, presentes em quatro casos cada, seguidos por febre prolongada em três casos. Dois pacientes eram assintomáticos e foram diagnosticados em exames de rotina.
A localização mais frequente dos tumores foi no abdome (
n = 13; 81,3%), seguido por tórax e cabeça e pescoço (
n = 4; 25,0% cada). Os achados de imagem no abdome incluíram massas ou linfonodomegalias mesentéricas e/ou retroperitoneais em sete casos (Figura 2), espessamento da parede intestinal em três (Figura 3), lesões hepáticas focais em dois e massa renal em um caso (Figura 4). O envolvimento torácico foi caracterizado por massa ou linfonodomegalias mediastinais em três casos e massa pulmonar em um caso. Todos os quatro casos de envolvimento da região da cabeça e pescoço foram caracterizados por linfonodomegalias cervicais.
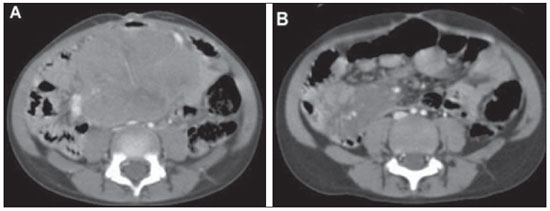
Figura 2. Menina de 6 anos apresentando massa abdominal heterogênea envolvendo os vasos mesentéricos, com diagnóstico histológico de linfoma não Hodgkin. A: TC com contraste pré-tratamento. B: TC com contraste pós-tratamento evidenciando redução das dimensões da lesão.
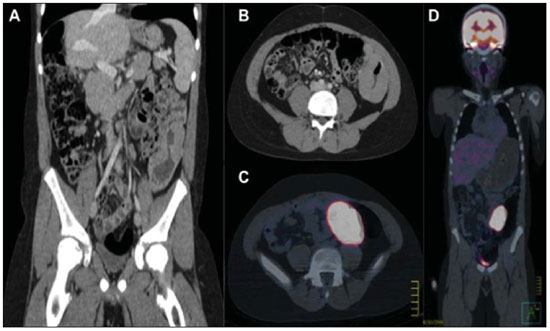
Figura 3. Menino de 12 anos apresentando espessamento parietal do cólon esquerdo, com aumento da concentração de FDG no PET-CT, cujo diagnóstico histológico foi de linfoma não-Hodgkin. A: Corte coronal de TC com contraste. B: Corte axial de TC com contraste. C: Corte axial do PET-CT. D: Corte coronal do PET-CT.
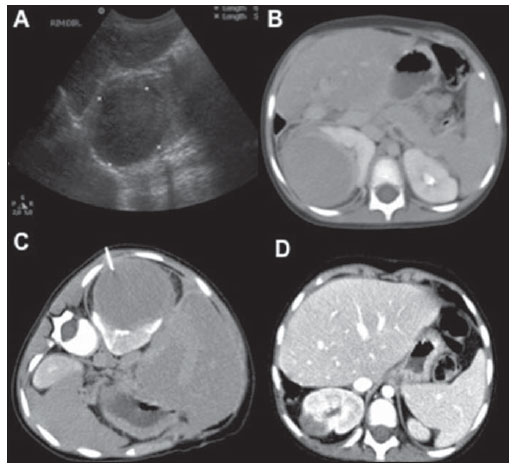
Figura 4. Menino de 3 anos apresentando massa bem definida no polo superior do rim direito, com diagnóstico histológico de linfoma não-Hodgkin. A: US. B: TC com contraste. C: Biópsia guiada por TC. D: TC com contraste após 3 meses do tratamento evidenciando redução das dimensões da lesão.
O tipo histológico mais comum foi linfoma não Hodgkin (
n = 14; 86,7%), com sete casos de linfoma de Burkitt ou Burkitt-
like, cinco casos de linfoma difuso de grandes células B e um não específico. O tipo histológico nos outros dois casos (13,3%) foi linfoma de Hodgkin.
Até a finalização da coleta de dados, três crianças (18,8%) estavam em tratamento, nove (56,3%) foram curadas com o tratamento e quatro (25,0%) faleceram por complicações do linfoma.
DISCUSSÃO
Estudos em pacientes submetidos a transplante hepático demonstraram que o linfoma é a neoplasia maligna mais comum nesta população e que existe uma relação inversa entre a incidência de DLPT e a idade no momento do transplante(9,10). A incidência da DLPT nos pacientes pediátricos após transplante hepático varia de 4% a 15% na literatura(11,12).
DLPT pode se desenvolver a qualquer momento após o transplante, apesar de ser relatada na literatura uma maior incidência nos primeiros 12 meses(13). No presente trabalho, a média foi de 37 meses, com um tempo máximo de 8 anos e 7 meses. No estudo de Fernandez et al., que também avaliou crianças submetidas a transplante hepático, o tempo médio entre o transplante e o desenvolvimento da doença foi de 25 meses, variando de 7 a 47 meses(11).
O único fator de risco encontrado neste estudo para o desenvolvimento de linfoma foi a idade no momento do transplante, o que pode estar associado ao contato prévio com o vírus Epstein-Barr (EBV). Acredita-se que a etiologia da DLPT está relacionada à proliferação de células B induzida pelo EBV e facilitada pela imunossupressão farmacológica do hospedeiro. Crianças menores têm menor taxa de soro-positividade para EBV e, por isso, são mais suscetíveis ao desenvolvimento de novas infecções após o transplante, o que está associado a um elevado risco de desenvolver DLPT(14). Devido ao caráter retrospectivo deste estudo, não foi possível avaliar o
status sorológico para o vírus EBV em todos os pacientes antes e após o transplante.
A apresentação clínica e radiológica da doença é variável(15). A maioria dos pacientes é assintomática nas fases iniciais e os sintomas são inespecíficos nos estágios mais tardios, tornando difícil o diagnóstico diferencial com infecções oportunistas e rejeição ao enxerto baseando-se apenas em dados clínicos(4).
A distribuição anatômica da DLPT é influenciada pelo enxerto. Alguns autores têm enfatizado a propensão do linfoma pós-transplante ocorrer na mesma região anatômica do órgão transplantado, incluindo envolvimento do próprio enxerto(13,16). Na literatura, o envolvimento abdominal se dá em 50% a 75% dos pacientes com DLPT após transplante renal, hepático ou cardíaco(4). No nosso trabalho, o abdome também foi o sítio mais comum de envolvimento, seguido pelo tórax e região cervical. O envolvimento do sistema nervoso central já foi descrito, no entanto, nenhum caso foi observado na nossa casuística.
Os aspectos de imagem das desordens linfoproliferativas incluem linfonodomegalias, massas focais e infiltração difusa de órgãos(16,17). A diferença mais importante das manifestações radiológicas do linfoma ocorrendo na população geral e nos pacientes transplantados é a frequência relativamente maior de doença extranodal no último grupo. Sítios abdominais extranodais incluem fígado, intestino delgado, rim, mesentério, adrenal, parede abdominal, cólon, estômago e bexiga(18). As manifestações torácicas mais comuns são nódulos ou massas pulmonares e linfonodomegalias mediastinais. Envolvimento da cabeça e pescoço se caracteriza mais frequentemente por massa focal no anel de Waldeyer e linfonodomegalias cervicais(4).
Como a DLPT frequentemente ocorre em sítios extranodais, o PET-CT pode ser muito útil na sua avaliação(4). O PET-CT tem
performance comparável aos métodos axiais no estadiamento inicial da DLPT e demonstra potencial para avaliar mais precocemente a resposta ao tratamento que os estudos convencionais(19). Nos últimos anos, outro método que vem se destacando é a RM de corpo inteiro, com a sequência em difusão, que fornece informações funcionais que podem ser utilizadas na detecção e caracterização de tumores malignos. Este método tem como vantagem a ausência de radiação ionizante, que mesmo em pequenas doses pode aumentar o risco de neoplasias secundárias em crianças, e já demonstrou bons resultados na avaliação de linfomas em pacientes pediátricos(20).
Apesar do tratamento apropriado ser efetivo e ter boa resposta na maioria dos casos, a doença pode levar ao óbito se não for diagnosticada e tratada precocemente. Na nossa casuística, a mortalidade foi de 25%. Fernandez et al. encontraram uma taxa de mortalidade de 18% em uma população similar(11).
Em conclusão, os linfomas são complicações relativamente incomuns e potencialmente fatais que podem ocorrer em qualquer momento após o transplante hepático em crianças e que apresentam achados clínicos e de imagem variáveis. Os radiologistas devem conhecer as manifestações desta doença para permitir o diagnóstico precoce, o que pode modificar o seu manejo e desfecho clínico. Os principais objetivos dos métodos de imagem são detectar a doença, avaliar sua extensão, guiar biópsias percutâneas e avaliar a resposta ao tratamento.
REFERÊNCIAS
1. Zafar SY, Howell DN, Gockerman JP. Malignancy after solid organ transplantation: an overview. Oncologist. 2008;13:769—78.
2. Taylor AL, Marcus R, Bradley JA. Post-transplant lymphoproliferative disorders (PTLD) after solid organ transplantation. Crit Rev Oncol Hematol. 2005;56:155—67.
3. Pickhardt PJ, Siegel MJ, Hayashi RJ, et al. Posttransplantation lymphoproliferative disorder in children: clinical, histopathologic, and imaging features. Radiology. 2000;217:16—25.
4. Borhani AA, Hosseinzadeh K, Almusa O, et al. Imaging of posttransplantation lymphoproliferative disorder after solid organ transplantation. Radiographics. 2009;29:981—1002.
5. Harris NL, Swerdlow SH, Frizzera G, et al. Post-transplant lymphoproliferative disorders. In: Jaffe ES, Harris NL, Stein H, et al., editors. World Health Organization Classification of Tumours: pathology and genetics of tumours of haematopoietic and lymphoid tissues. Lyon: IARC; 2001. p. 264—9.
6. Scarsbrook AF, Warakaulle DR, Dattani M, et al. Post-transplantation lymphoproliferative disorder: the spectrum of imaging appearances. Clin Radiol. 2005;60:47—55.
7. Burney K, Bradley M, Buckley A, et al. Posttransplant lymphoproliferative disorder: a pictorial review. Australas Radiol. 2006;50:412—8.
8. Dhillon MS, Rai JK, Gunson BK, et al. Post-transplant lymphoproliferative disease in liver transplantation. Br J Radiol. 2007;80:337—46.
9. Aberg F, Pukkala E, Höckerstedt K, et al. Risk of malignant neoplasms after liver transplantation: a population-based study. Liver Transplant. 2008;14:1428—36.
10. Jain A, Nalesnik M, Reyes J, et al. Posttransplant lymphoproliferative disorders in liver transplantation: a 20-year experience. Ann Surg. 2002;236:429—37.
11. Fernández MC, Bes D, De Dávila M, et al. Post-transplant lymphoproliferative disorder after pediatric liver transplantation: characteristics and outcome. Pediatr Transplant. 2009;13:307—10.
12. Jeon TY, Kim JH, Eo H, et al. Posttransplantation lymphoproliferative disorder in children: manifestations in hematopoietic cell recipients in comparison with liver recipients. Radiology. 2010;257:490—7.
13. Opelz G, Döhler B. Lymphomas after solid organ transplantation: a collaborative transplant study report. Am J Transplant. 2004;4:222—30.
14. Wu JF, Ho MC, Ni YH, et al. Timing of Epstein-Barr virus acquisition and the course of posttransplantation lymphoproliferative disorder in children. Transplantation. 2009;87:758—62.
15. Caldas FAA, Motomiya CT, Silva HC. Análise de achados de imagem e alterações clínicas em pacientes com linfoma. Radiol Bras. 2002;35:71—5.
16. Donnelly LF, Frush DP, Marshall KW, et al. Lymphoproliferative disorders: CT findings in immunocompromised children. AJR Am J Roentgenol. 1998;171:725—31.
17. Borba AMV, Monteiro AMV, Lima CMAO, et al. Aspectos da tomografia computadorizada no linfoma em pacientes abaixo de 20 anos de idade. Radiol Bras. 2007;40:87—92.
18. Pickhardt PJ, Siegel MJ. Posttransplantation lymphoproliferative disorder of the abdomen: CT evaluation in 51 patients. Radiology. 1999;213:73—8.
19. von Falck C, Maecker B, Schirg E, et al. Post transplant lymphoproliferative disease in pediatric solid organ transplant patients: a possible role for [18F]-FDG-PET(/CT) in initial staging and therapy monitoring. Eur J Radiol. 2007;63:427—35.
20. Nava D, Oliveira HCO, Luisi FA, et al. Aplicação da ressonância magnética de corpo inteiro para o estadiamento e acompanhamento de pacientes com linfoma de Hodgkin na faixa etária infanto-juvenil: comparação entre diferentes sequências. Radiol Bras. 2011;44:29—34.
1. Médicos Residentes do Hospital A. C. Camargo, São Paulo, SP, Brasil.
2. Médica, Mestre, Titular do Hospital A. C. Camargo, São Paulo, SP, Brasil.
3. Médico, Doutor, Titular e Diretor do Departamento de Imagem do Hospital A. C. Camargo, São Paulo, SP, Brasil.
Endereço para correspondência:
Dr. Almir Galvão Vieira Bitencourt
Hospital A. C. Camargo, Departamento de Imagem
Rua Professor Antônio Prudente, 211, Liberdade
São Paulo, SP, Brasil, 01509-010
E-mail: almirgvb@yahoo.com.br
Recebido para publicação em 4/12/2011.
Aceito, após revisão, em 6/2/2012.
Trabalho realizado no Departamento de Imagem do Hospital A. C. Camargo, São Paulo, SP, Brasil.
 Vol. 45 nº 1 - Jan. / Fev. of 2012
Vol. 45 nº 1 - Jan. / Fev. of 2012



