INTRODUÇÃO
A cancerização de lóbulos associada com carcinoma ductal
in situ (CDIS) é um padrão patológico que pode ser definido como a maior extensão do CDIS para lóbulos e ductos interlobulares(1). A identificação da cancerização de lóbulos é importante, já que é considerada como fator preditivo relevante e independente de invasão em pacientes com CDIS diagnosticado por biópsia(2).
De nosso conhecimento, nenhum estudo anterior avaliou os aspectos mamográficos da cancerização de lóbulos por CDIS. O objetivo do presente estudo foi descrever os aspectos mamográficos da cancerização de lóbulos por CDIS, correlacionando achados de imagem e histológicos.
MATERIAIS E MÉTODOS
Este estudo retrospectivo foi baseado em uma revisão de laudos histopatológicos de 135 pacientes submetidas a biópsia de mama em dois hospitais, no período entre 1998 e 2006, e que receberam diagnóstico final de CDIS. O diagnóstico de cancerização de lóbulos por CDIS foi confirmado pela biópsia em 12 das 135 pacientes. Dois casos foram excluídos em razão de os cortes histológicos não estarem disponíveis para correlação da patologia com os achados mamográficos. O estudo foi aprovado pelo comitê de revisão institucional dos dois hospitais.
As imagens mamográficas foram obtidas em incidências mediolateral e craniocaudal com diferentes sistemas de tela-filme de alta resolução (GE 600T e GE DMR; GE Medical Systems, Milwaukee, WI, EUA) dos dois hospitais. Incidências adicionais foram obtidas com técnica de magnificação, a critério do radiologista. Em todos os casos, radiografias dos espécimes foram obtidas para confirmar a excisão das microcalcificações e para orientar a análise histológica. Todas as mamografias foram retrospectivamente analisadas e classificadas por dois experientes radiologistas especialistas em mama, sem prévio conhecimento dos achados histológicos. À mamografia, as microcalcificações foram classificadas em termos de morfologia, distribuição e número, e foram correlacionadas com o padrão histopatológico. A forma das calcificações foi classificada em: 1) calcificações redondas – neste grupo incluem-se as calcificações puntiformes, redondas e ovais, e aquelas que são nitidamente definidas; 2) calcificações amorfas, indistintas, em forma de flocos e de aparência imprecisa; 3) calcificações pleomórficas ou heterogêneas, com forma irregular, variando em tamanho e formato, e com diâmetro inferior a 0,5 mm; 4) calcificações finas, lineares e ramificadas, incluindo calcificações irregulares, finas (< 1 mm)(3,4). Em relação ao padrão de distribuição, as calcificações foram classificadas em: 1) ductais – distribuídas linearmente com uma forma triangular/trapezoidal; 2) lobulares – agrupamentos de calcificações redondas; 3) indefinidas – este grupo define a distribuição de calcificações que não pode ser classificada como dentro dos padrões ductal ou lobular( 3,5). Os grupos de calcificações foram classificados em: até 10 calcificações; de 10 a 20; e mais do que 20 calcificações.
Os espécimes histológicos originados de uma combinação de
core-biópsias e excisões cirúrgicas foram corados com hematoxilina-eosina para avaliação patológica e estadiamento. Os espécimes patológicos foram analisados por um experiente patologista especializado em mamas, sem conhecimento prévio dos achados mamográficos, e que os classificou segundo seu subtipo histológico predominante. A classificação histopatológica do CDIS foi baseada nas descrições de Tavassoli(6) e Rosen( 7), a saber: micropapilar, cribriforme, comedo, sólido e papilar. Cancerização de lóbulos foi definida como envolvimento parcial de um grupo de lóbulos por células de CDIS, dentro de uma unidade ductolobular terminal, de tal forma que tais lóbulos sejam reconhecíveis como parte de uma única unidade(6,8).
RESULTADOS
Nove casos (90%) apresentaram agrupamentos de microcalcificações redondas e um (10%) apresentou calcificações redondas e lineares. A distribuição das calcificações foi definida como lobular em todos os casos.
Nos nove casos com agrupamentos de microcalcificações redondas, o estudo histopatológico demonstrou: quatro casos de CDIS cribriforme (Figura 1), dois casos de comedocarcinoma (Figura 2), um caso de CDIS sólido, um caso de CDIS cribriforme associado com sólido (Figura 3) e um caso de CDIS cribriforme associado com sólido e comedocarcinoma. O caso com calcificações redondas lineares foi histologicamente classificado como CDIS cribriforme. Com relação ao número de microcalcificações, nove casos apresentaram mais do que 20 e apenas um caso revelou menos do que 10 microcalcificações.
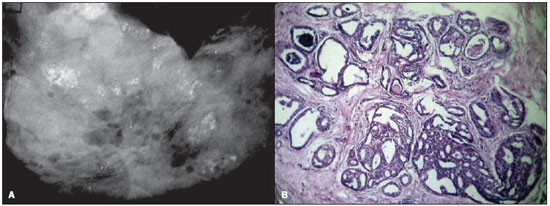
Figura 1. A: Mamografia de uma mulher de 41 anos de idade com CDIS. A imagem mostra múltiplos agrupamentos de microcalcificações redondas com um padrão lobular de distribuição. B: Fotomicrografia de alta resolução (magnificação original, 40×, coloração com hematoxilina-eosina) demonstra estrutura tubular com células atípicas e ácino dilatado apresentando secreções e calcificações. Os achados histopatológicos foram consistentes com cancerização do lóbulo por CDIS cribriforme.
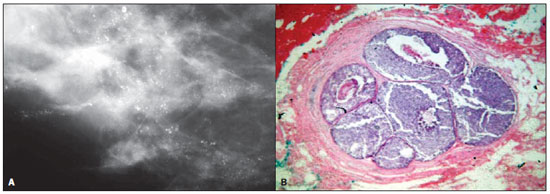
Figura 2. A: Mamografia de uma mulher de 57 anos de idade com CDIS. A imagem mostra agrupamentos de microcalcificações puntiformes de tamanhos
variados, formando grupos de calcificações. B: Fotomicrografia de alta resolução (magnificação original, 40×, coloração com hematoxilina-eosina) demonstra uma estrutura lobular bem definida com ductos dilatados, células atípicas e necrose central, consistente com cancerização do lóbulo por comedocarcinoma.
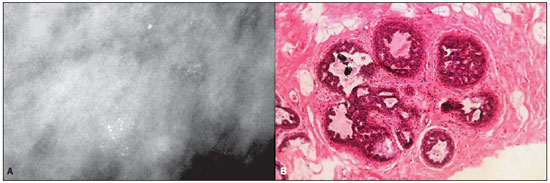
Figura 3. A: Mamografia de uma mulher de 38 anos de idade com CDIS. A imagem demonstra um agrupamento de microcalcificações redondas, em sua
maioria finas e granulares, com morfologia lobular. B: Fotomicrografia de alta resolução (magnificação original, 40×, coloração com hematoxilina-eosina) demonstra estrutura lobular com células atípicas e padrão cribriforme, apresentando calcificações dentro de ácino dilatado. Os achados histopatológicos foram consistentes com cancerização de lóbulo por CDIS cribriforme e sólido.
A cancerização de lóbulos é um padrão histopatológico descrito quando um CDIS afeta parcialmente unidades ducto-lobulares terminais, que se tornam progressivamente dilatadas e distendidas. A expansão continuada de células malignas para os lóbulos resulta em destruição da arquitetura normal e, finalmente, afetando estruturas ductais do CDIS(1,8). A cancerização de lóbulos é considerada como importante fator preditivo de invasão e pode estar associada a um aumento no risco de CDIS residual em casos de re-excisão e recidiva(2). Além disso, o reconhecimento de possíveis padrões mamográficos indicando a presença de CDIS com cancerização de lóbulos pode ajudar no diagnóstico diferencial de microcalcificações mamárias.
Como as calcificações com distribuição linear, nos casos de CDIS, são formadas dentro dos ductos, microcalcificações mamárias geralmente seguem a arquitetura do sítio onde elas se formam(3,4,8). Entretanto, também se sabe que o CDIS se estende para os lóbulos, causando sua cancerização. As calcificações do CDIS são normalmente concreções finas lineares que se ramificam com o ducto(4); no entanto, no presente estudo, todas as imagens mamográficas demonstraram agrupamentos de microcalcificações com distribuição lobular. A morfologia das microcalcificações nelas observadas é provavelmente resultado de calcificações formadas nos resíduos de lóbulos destruídos pela cancerização. Com base nesses resultados, levanta-se a hipótese de que, com a invasão dos lóbulos pelo CDIS, a forma da calcificação segue a arquitetura dos ácinos lobulares, constituindo agrupamentos de calcificações redondas. Geralmente, agrupamentos de pequenas calcificações redondas ou ovais com um padrão lobular de distribuição são associados com processos benignos, tais como adenose, papilomas intraductais periféricos e outras doenças benignas da mama. Entretanto, os resultados do presente estudo demonstram que esse padrão também pode estar associado com CDIS com cancerização lobular.
Huo et al.(2) avaliaram 200 pacientes consecutivos submetidos a
core-biópsia e diagnosticados com CDIS, para determinar os fatores preditivos de invasão tumoral. Eles observaram que os mais importantes preditores de invasão em pacientes com CDIS são a presença de massa tumoral, uma lesão com diâmetro maior que 1,5 cm e a presença de cancerização lobular. Além disso, concluíram que cada uma dessas variáveis, exceto o grau nuclear, constitui um preditor independente de invasão tumoral. Corroborando essas conclusões, Renshaw( 9) relatou que pacientes com CDIS medindo mais do que 4 mm em sua maior dimensão, juntamente com extensão lobular, apresentaram risco aumentado de invasão na excisão final.
O presente estudo tem algumas limitações: é uma análise retrospectiva, não aleatória de uma pequena coorte de pacientes. Além disso, os casos de cancerização lobular foram selecionados por meio de análises histopatológicas e a população do estudo incluiu apenas as pacientes cujo diagnóstico histopatológico foi confirmado. Não obstante tais limitações, este é o primeiro estudo avaliando os achados mamográficos da cancerização de lóbulos por CDIS.
No presente estudo, a avaliação mamográfica de pacientes com CDIS apresentando cancerização de lóbulos demonstrou agrupamentos de microcalcificações com um padrão lobular de distribuição em todos os casos. Embora agrupamentos de calcificações redondas sejam normalmente associados com um processo benigno, a cancerização de lóbulos pode produzir um padrão similar, mimetizando assim uma condição benigna.
REFERÊNCIAS
1. Azzopardi JG. Underdiagnosis of malignancy. In: Bennington JL, editor. Problems in breast pathology. London: WB Saunders; 1979. p. 192–239.
2. Huo L, Sneige N, Hunt KK, et al. Predictors of invasion in patients with core-needle biopsy-diagnosed ductal carcinoma in situ and recommendations for a selective approach to sentinel lymph node biopsy in ductal carcinoma in situ. Cancer. 2006;107:1760–8.
3. Lanyi M. Diagnosis and differential diagnosis of breast calcifications. Berlin: Springer-Verlag; 1986.
4. Kopans DB. Breast imaging. Philadelphia: Lippincott Williams & Wilkins; 2007.
5. Lanyi M, Neufang KF. Possibilities and limitations of the differential diagnosis of grouped intramammary microcalcifications. Rofo. 1984:141:430–8.
6. Tavassoli FA. Ductal intraepithelial neoplasia: risk factors for subsequent development of invasive carcinoma. In: Tavassoli FA, editor. Pathology of the breast. Stanford: Appleton & Lange; 1999. p.205–312.
7. Rosen PP. Rosen’s breast pathology. New York: Lippincott-Raven; 1978.
8. Vicini FA, Goldstein NS, Kestin LL. Pathologic and technical considerations in the treatment of ductal carcinoma in situ of the breast with lumpectomy and radiation therapy. Ann Oncol. 19910:883–90.
9. Renshaw AA. Predicting invasion in the excision specimen from breast core needle biopsy specimens with only ductal carcinoma in situ. Arch Pathol Lab Med. 2002;126:39–41.
1. Professor Adjunto do Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil.
2. Doutoranda em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
3. Médica Radiologista do Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil.
4. Médico Patologista do Departamento de Patologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil (In memoriam).
5. Professor Titular do Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Coordenador Adjunto do Curso de Pós-graduação em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
Endereço para correspondência:
Dra. Taísa Davaus Gasparetto
Rua Lopes Trovão, 88, ap. 1702-B, Icaraí
Niterói, RJ, Brasil, 24220-071
E-mail: taisadavaus@gmail.com
Recebido para publicação em 23/2/2011.
Aceito, após revisão, em 14/5/2011.
Trabalho realizado na Universidade Federal Fluminense (UFF), Niterói, RJ, e na Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
 Vol. 44 nº 5 - Set. / Out. of 2011
Vol. 44 nº 5 - Set. / Out. of 2011


