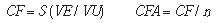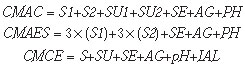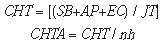INTRODUÇÃO
O desenvolvimento ocorrido a partir de 1960, nas áreas da instrumentação e dos radiofármacos, fez com que a medicina nuclear se tornasse um método de diagnóstico dos mais importantes nos dias atuais, principalmente devido a acurácia, precisão e precocidade no processo de diagnóstico de importantes doenças, como câncer, disfunções neurológicas e cardíacas. Além disso, a utilização de radiofármacos também tem ganhado importância nos processos terapêuticos, com o uso de radioisótopos emissores de partículas alfa e beta.
Todavia, os benefícios da técnica somente podem ser alcançados quando todos os agentes envolvidos no processo (equipamentos, radiofármacos e profissionais) apresentem alto grau de qualidade. Para isso, e devido aos riscos associados ao uso das radiações ionizantes, foram estabelecidos internacionalémente várias normas e procedimentos relacionados à implementação de ações de proteção radiológica nos serviços de medicina nuclear e de controle de qualidade de equipamentos(1–3) e dos radiofármacos(4–6).
No Brasil, as questões sobre a proteção radiológica e o controle de qualidade dos equipamentos já têm regulamentação(7–9) e fiscalização constante. Entretanto, o mesmo não ocorre com relação aos radiofármacos, embora essa seja uma questão crucial, uma vez que a grande maioria dos radiofármacos utilizados nas clínicas de medicina nuclear é obtida,
in situ, pela reação entre o pertecnetato de sódio (Na[
99mTc]O4) com diversos reagentes químicos contidos em um
kit liofilizado, o que pode levar à formação de impurezas(10).
Problemas com baixa eficiência de marcações desses
kits foram relatados por diversos autores(11–13), e a realização do controle de qualidade serve para garantir que produtos inadequados não sejam utilizados em pacientes ou para garantir que padrões de imagem não usuais possam ser correlacionados com algum tipo de doença não corriqueira, em vez de serem considerados falhas no processo de preparação dos radiofármacos. Em ambos os casos, os pacientes seriam submetidos a novo exame, levando a uma exposição desnecessária do paciente à radiação. Exemplos desses casos são a síndrome de Rotor e a síndrome de Dubin-Johnson, em que as imagens apresentadas na Figura 1 (obtidas do banco de imagens do Centro de Medicina Nuclear do Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo) mostram a distribuição do radiofármaco [
99mTc]DISIDA com características que podem ser confundidas, respectivamente, com a administração do próprio [
99mTc]O
4– ou de coloide de [
99mTc]tecnécio, impureza que pode ocorrer durante a preparação dos radiofármacos marcados com [
99mTc]tecnécio.
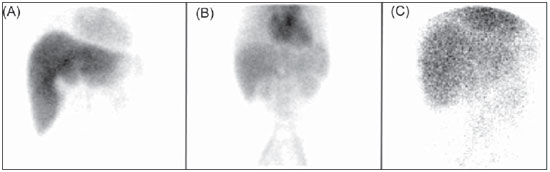
Figura 1. Cintilografias de vias biliares utilizando o radiofármaco
99mTc-DISIDA. A: Estudo dentro dos padrões da normalidade, com radiofármaco apresentando pureza radioquímica (PRQ) = 98,5%. B: Estudo indicativo de síndrome de Rotor (PRQ = 98,3%). C: Estudo indicativo de síndrome de Dubin-Johnson (PRQ = 98,7%).
Em 4 de junho de 2008 foi publicada a resolução RDC nº 38, da Agência Nacional de Vigilância Sanitária (Anvisa)(14), que dispõe sobre a instalação e funcionamento de serviços de medicina nuclear i
n vivo. Nesta resolução foi instituída a primeira legislação brasileira que torna obrigatória, para os serviços de medicina nuclear, a realização do controle de qualidade dos eluatos dos geradores e radiofármacos. Recentemente, a Anvisa editou a resolução RDC nº 63, de 18 de dezembro de 2009, que classifica as áreas de preparação e manipulação de radiofármacos em clínicas de medicina nuclear como unidades produtoras de radiofármacos, e estas devem seguir os regulamentos estabelecidos nessa resolução(15).
Uma vez que a realização de controle de qualidade dos radiofármacos irá implicar investimento e aumento de custos, são expostos, neste trabalho, os resultados da análise sobre implantação de um programa de controle de qualidade de geradores e radiofármacos marcados com [
99mTc]tecnécio.
MATERIAIS E MÉTODOS
O custo da implantação do programa de controle de qualidade foi determinado a partir dos custos de todo o material de consumo e permanente necessário para sua implantação, cotados em moeda nacional ou, quando se tratou de material importado, foi tomada com base a taxa de câmbio de US$ 1.00 = R$ 1,90.
Material permanente
Foram considerados materiais permanentes os com vida útil superior a 24 meses e que pudessem ser utilizados repetidamente em várias análises. Assim, o contador de poço W (Capintec Inc.; Ramsey, NJ, EUA), a blindagem de chumbo de 6 mm Capmac (Capintec Inc; Ramsey, NJ, EUA), o agitador tipo vórtex e as pinças metálicas tiveram a vida útil considerada em 120 meses, as micropipetas, em 60 meses, e a vida útil de vidraria, secador de cabelo e material plástico, em 48 meses.
Material de consumo
Foram considerados materiais de consumo os solventes metanol, acetato de etila, clorofórmio e solução fisiológica, e as placas de cromatografia do tipo ITLC-SG (
instant thin-layer chromatography-silica gel) (Pall Coorporation; New York, NY, EUA), TLC-SG (
thin-layer chromatography-silica gel) (Merck KgaA; Darmstadt, Alemanha), papel Whatman 3MM (Whatman International Ltd; Maidstone, Inglaterra), papel indicador de pH e indicador para alumínio (Merck KgaA; Darmstadt, Alemanha).
Mão de obra
Como profissionais responsáveis pela execução dos controles foram selecionados dois grupos: o técnico em radiologia, que cumpre jornada de trabalho de 96 horas, e os profissionais com nível superior em farmácia, biomedicina ou biologia, com jornada de 176 horas. Além do salário base dos profissionais, ainda foram somados o adicional de periculosidade (40% para os técnicos de radiologia e 30% para profissionais com nível superior) e encargos trabalhistas (50% do salário base), a fim de que se pudesse determinar o valor da hora de trabalho.
Equações para cálculos
As equações utilizadas para a determinação dos custos na implantação do programa de controle de qualidade de radiofármacos são apresentadas a seguir.
a) Custos fixos
O custo fixo foi determinado a partir da lista de material permanente, considerando as respectivas vidas úteis.
onde:
CF = custo fixo;
VE = valor de equipamentos e utensílios;
VU = número de meses de vida útil dos materiais;
CFA = custo fixo por análise;
n = número de análises por mês.
b) Custos variáveis
Os custos variáveis foram determinados a partir da relação de material de consumo utilizado para cada análise, considerando a quantidade de material usada em apenas um teste. Neste trabalho, levou-se em conta a realização dos controles de qualidade dos radiofármacos lipofílicos [
99mTc]MIBI e [
99mTc]ECD pelo método de extração por solvente(16). Os demais radiofármacos, assim como o controle radioquímico do [
99mTc]O4– eluído do gerador, foram realizados utilizando o método de cromatografia em papel ou camada delgada(6).
As equações para o cálculo dos custos de cada análise, para cada radiofármaco, são apresentadas a seguir.
onde:
CMAC = custo dos materiais para análise cromatográfica dos radiofármacos;
CMAES = custo dos materiais para análise por extração por solvente;
CMCE = custo dos materiais para controle do eluato;
S1 = valor unitário do solvente 1 (1 ml);
S2 = valor unitário do solvente 2 (1 ml);
SU = valor do suporte cromatográfico ou fase estacionária;
SE = valor da seringa;
AG = valor da agulha;
pH = valor unitário do papel indicador de pH;
IAL = valor unitário do indicador de alumínio.
c) Custos trabalhistas
Os custos trabalhistas foram determinados tomando como base as referências salariais de profissionais com formação tecnológica em radiologia ou com nível superior em farmácia, biomedicina ou biologia, adicionando ao salário outros direitos trabalhistas, como férias, fundo de garantia por tempo de serviço, adicional de insalubridade ou periculosidade.
onde:
CHT = custo da hora trabalhada;
SB = salário base;
AP = adicional de periculosidade;
EC = encargos trabalhistas;
JT = jornada de trabalho;
CHTA = custo da hora trabalhada por análise;
nh = número de análises por hora.
d) Custos das análises
Para o cálculo do custo final de cada tipo de análise foram somados os valores do custo fixo, do custo variável e do custo trabalhista, para o respectivo método. As equações para o cálculo do custo final do controle de qualidade são apresentadas a seguir.
onde:
CAC = custo da análise cromatográfica;
CAES = custo da análise por extração por solvente;
CAE = custo da análise do eluato;
CMAC = custo dos materiais para análise cromatográfica dos radiofármacos;
CMAES = custo dos materiais para análise por extração por solvente;
CMCE = custo dos materiais para controle do eluato;
CFA = custo fixo por análise;
CHTA = custo da hora trabalhada por análise.
RESULTADOS
Para o cálculo do custo das análises de controle de qualidade foram considerados os custos da taxa de depreciação mensal dos materiais permanentes, o que forneceu um valor mensal de R$ 273,01. Para determinar quanto o custo fixo impacta em cada análise, foi considerado que no serviço de medicina nuclear são realizados, mensalmente, em torno de 140 controles de qualidade, e o valor da depreciação por análise foi calculado em R$ 1,95.
O controle de qualidade do eluato do gerador também deve ser considerado, sendo que o controle de pureza radionuclídica depende de uma blindagem de chumbo, cujo valor está apresentado na Tabela 1, e para o qual foi estabelecido o valor de depreciação mensal de R$ 31,67. Considerando que o gerador seja eluído duas vezes ao dia, com uma média de 40 eluições por mês, o custo do equipamento para este tipo de análise é de R$ 0,79.
No cálculo do custo trabalhista foram considerados os salários e encargos de dois grupos de profissionais que atuam na área da medicina nuclear: o tecnólogo em radiologia (T), cujo valor atingiu a cifra de R$ 1.767,00, e os profissionais com nível superior em farmácia, biomedicina ou biologia (S), para os quais o valor encontrado foi de R$ 3.600,00. Considerando que cada grupo profissional determina jornadas de trabalho de 96 e 176 horas mensais, respectivamente, o valor da hora de trabalho calculada para cada categoria foi de R$ 18,40 e R$ 20,25. Foi considerado que, como na prática muitos
kits são marcados simultaneamente, os profissionais vão despender uma hora de trabalho para a realização de seis controles de qualidade, incluindo controles do eluato do gerador, cromatografias e extração por solvente. Assim, o custo profissional por análise foi de R$ 3,06 para o tecnólogo e de R$ 3,40 para o profissional com nível superior.
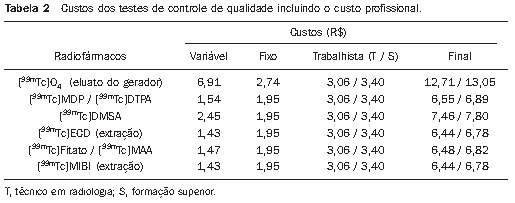
Na Tabela 2 é apresentado o valor final do controle de qualidade dos radiofármacos e eluatos de [
99mTc]tecnécio, baseados no custo do material de consumo, material fixo e custo profissional.
DISCUSSÃO
Para a implantação de um programa de controle de qualidade foi considerado que a clínica de medicina nuclear deveria adquirir todos os materiais para execução do programa. O investimento inicial é de aproximadamente R$ 33.000,00 para materiais permanentes, sendo que o maior investimento está relacionado com a aquisição do contador gama (contador de poço), representando 85% do valor total, seguido da blindagem para determinação de (
99Mo) presente no eluato do gerador, representando 10%. Embora o investimento inicial seja aparentemente alto, esse valor representa, aproximadamente, 9% do valor de uma câmara de cintilação tomográfica com um detector, e a taxa mensal de depreciação para os materiais permanentes, de R$ 273,01, equivale a aproximadamente o valor recebido por um exame de cintilografia óssea (R$ 190,99 – Tabela SUS ou R$ 259,12 – Tabela AMB).
A cintilografia óssea foi tomada como exemplo para valor, pois é um dos exames realizados em maior número nas clínicas de medicina nuclear. O outro exame também realizado em grande número é a cintilografia do miocárdio com [
99mTc]MIBI, que é remunerado em R$ 791,59 (Tabela SUS) ou R$ 955,61 (Tabela AMB). Nesse caso, o valor de depreciação mensal dos equipamentos equivale a 1/3 do valor de uma cintilografia de perfusão de miocárdio.
Na avaliação dos custos, o material permanente foi considerado como custo fixo, ou seja, o custo da análise está relacionado à taxa de utilização dos equipamentos e utensílios. Os valores encontrados, entre R$ 1,43 e R$ 2,54, podem variar para mais em clínicas de baixo número de exames ou para menos em clínicas com um maior número de exames.
Na análise do custo do controle por extração por solvente, cujas medidas são realizadas em um calibrador de dose, não foi considerado o valor despendido com a aquisição do equipamento, uma vez que este já é item obrigatório para instalação dos serviços de medicina nuclear, para medição das atividades de marcação e de injeção em pacientes.
No outro item que compõe o custo final, o investimento inicial para a aquisição dos materiais de consumo é da ordem de R$ 2.500,00, sendo que este valor é suficiente para aquisição de materiais em quantidade para utilização em até dois anos. Com as recentes resoluções da Anvisa(14,15) e a obrigatoriedade da realização de controle de qualidade em todos os radiofármacos, é possível que companhias privadas sejam estimuladas a produzir e vender sistemas para controle de qualidade em quantidade suficiente para o consumo mensal, diminuindo o dispêndio inicial dos materiais de consumo.
A seleção dos materiais para cada controle foi baseada na compilação de procedimentos descritos em compêndios oficiais, como determinado pela Anvisa, ou em artigos científicos publicados, comparando diferentes procedimentos de controle.
Nos dois métodos de análise utilizados, cromatografia e extração por solvente, não foi encontrada diferença significativa entre os valores (Tabela 2). Como o controle de extração é muito mais rápido (em torno de 3 minutos) que o controle por cromatografia (em torno de 15 minutos), o primeiro foi utilizado para o controle dos radiofármacos [
99mTc]MIBI e [
99mTc]ECD, que são lipofílicos, uma condição necessária para a realização do processo. Todavia, deve-se salientar que o método não é dos mais seguros, devido à possibilidade de quebra dos tubos de análise e derrame dos solventes durante a manipulação.
Para a avaliação da qualidade dos outros radiofármacos marcados com [
99mTc]tecnécio, obrigatoriamente foi utilizado o método cromatográfico. Neste caso, existem diversas possibilidades de combinação entre a fase estacionária e a fase móvel. Os sistemas descritos nas farmacopeias americana(4) e europeia(5) são muitas vezes impraticáveis nos controles realizados em clínicas, por serem dispendiosos, consumirem longo tempo para a realização ou utilizarem misturas de solventes pouco usuais em clínicas de medicina nuclear. Na prática, são utilizados sistemas recomendados pelos fabricantes dos radiofármacos ou os consagrados na literatura científica, que descrevem principalmente a utilização de papel Whatman 3MM ou ITLC-SG, como fase estacionária, e solução fisiológica e cetonas (acetona ou metiletilcetona), como fases móveis.
Embora o ITLC-SG e o papel Whatman 3MM possam ser utilizados indistintamente na maioria da análise, o primeiro apresenta qualidades superiores ao segundo, como melhor resolução na separação dos componentes e rapidez da análise (cerca de três minutos). Todavia, essas vantagens diminuem quando se compara o preço de R$ 1,36 para a unidade de ITLC-SG e de R$ 0,06 para a unidade de papel Whatman 3MM. Neste trabalho foi considerado, sempre que possível, o papel Whatman 3MM, exceto na análise do [
99mTc]DMSA, em que obrigatoriamente é necessário utilizar o TLC-SG, ao preço de R$ 1,36.
Com relação ao tempo de análise, o maior limitador é o uso do sistema papel Whatman 3MM/solução fisiológica, que demora em torno de 12 minutos para ser realizado, contra 5 minutos para o sistema Whatman 3MM/acetona. Quando o tempo da análise tiver que ser considerado na instituição, e este for tão ou mais importante que o custo, é possível utilizar um sistema misto de ITLC-SG/solução fisiológica e Whatman 3MM/acetona.
O custo trabalhista é um componente importante que representa entre 40% e 50% do custo final das análises. Observamos que, dentro do modelo analisado, a utilização de profissionais com formação distinta e sob diferentes regimes de trabalho apresenta pouca diferença no valor final da análise (Tabela 2), desde que sejam considerados os pisos bases de cada categoria e que os profissionais dediquem o tempo estabelecido para a realização dos controles de qualidade. Variações dos valores apresentados vão depender de acordos trabalhistas setoriais ou regionais.
Por fim, analisando a Tabela 2, é possível verificar que os custos para a realização do controle de qualidade dos radiofármacos marcados com [
99mTc]tecnécio são relativamente pequenos, considerando as condições mais extremas de custo, variando de R$ 6,44 a R$ 7,80, em função do produto ou método a ser adotado. A exceção ocorre para o controle do eluato do gerador, cujos valores atingem a cifra de R$ 13,05, o que se justifica pelo maior número de análises que precisam ser realizadas para garantir a qualidade do eluato.
Na prática, o custo efetivo pode ser reduzido, considerado que um
kit marcado é utilizado em mais de um paciente.
CONCLUSÕES
Para o atendimento das resoluções RDC no 38/2008 e RDC no 63/2009 da Anvisa, com relação à implantação de programas de controle de qualidade para os radiofármacos utilizados em serviços de medicina nuclear, chegamos à conclusão de que o investimento em equipamentos, embora alto, representa uma pequena fração do custo de implantação e operação de uma clínica de medicina nuclear, e deverá ser automaticamente considerados na instalação de novos serviços.
O custo final para o controle de qualidade dos radiofármacos marcados com [
99mTc]tecnécio, entre R$ 6,44 e R$ 7,80, pode ser absorvido no custo da maioria dos exames de medicina nuclear, principalmente porque o produto de um frasco é utilizado em diversos pacientes, e o custo aqui apresentado pode ser dividido pelo número de pacientes usuários. Além disso, é possível que a otimização do trabalho do profissional envolvido na tarefa e a múltipla utilização dos equipamentos em outras funções nas clínicas possam levar o custo efetivo de cada análise a ser suficientemente baixo para não impactar nos resultados financeiros de uma clínica de medicina nuclear.
REFERÊNCIAS
1. National Electrical Manufacturers Association. Performance measurements of scintillation cameras. NEMA Standards Publication NU 1-2001. Washington, DC: National Electrical Manufacturers Association; 2001.
2. International Atomic Energy Agency. Quality assurance for SPECT systems. IAEA Human Health Series No. 6. Vienna, Austria: International Atomic Energy Agency; 2009.
3. International Atomic Energy Agency. Quality control of nuclear medicine instruments. IAEA-TECDOC-602. Vienna, Austria: International Atomic Energy Agency; 1991.
4. United States Pharmacopeia. USP 33-NF-28. Rockville, MD: The United States Pharmacopeial Convention; 2010.
5. European Pharmacopoeia – 6th edition. Strasbourg, France: Council of Europe; 2007.
6. Comité de Radiofarmacia ALASBIMN, Mitta AEA, Robles AM. Manual de control de calidad de radiofármacos. Montevideo, Uruguay: Asociación Latinoamericana de Sociedades de Biología y Medicina Nuclear (ALASBIMN); 1986.
7. Brasil. Ministério da Ciência e Tecnologia. Comissão Nacional de Energia Nuclear. CNEN-NN-3.05: Requisitos de radioproteção e segurança para serviços de medicina nuclear. Rio de Janeiro, RJ: Comissão Nacional de Energia Nuclear; 1996.
8. Brasil. Ministério da Ciência e Tecnologia. Comissão Nacional de Energia Nuclear. CNEN-NE-3.01: Diretrizes básicas de radioproteção. Rio de Janeiro, RJ: Comissão Nacional de Energia Nuclear; 1988.
9. Brasil. Ministério da Ciência e Tecnologia. Comissão Nacional de Energia Nuclear. CNEN-NN-6.01: Requisitos para o registro de pessoas físicas para o preparo, uso e manuseio de fontes radioativas. Rio de Janeiro, RJ: Comissão Nacional de Energia Nuclear; 1998.
10. Marques FLN, Okamoto MRY, Buchpiguel CA. Alguns aspectos sobre geradores e radiofármacos de tecnécio-99m e seus controles de qualidade. Radiol Bras. 2001;34:233–9.
11. Ponto JA, Ponto LLB. Cost-effectiveness of routine radiochemical quality assurance testing of technetium Tc 99m radiopharmaceuticals. Am J Hosp Pharm. 1986;43:1218–22.
12. Decristoforo C, Chen F, Riccabona G. Qualitätskontrolle von Radiopharmaka in der Klinik – eine Notwendigkeit? Nuklearmedizin. 1993;32:144–8.
13. Faria DP, Marques FLN, Okamoto MRY, et al. Quality control of 99Mo/99mTc generator in two nuclear medicine laboratories in Brazil. In: V Scientific Meeting of the Brazilian Society of Nuclear Biosciences/I Encuentro Cientifico Hispanobrasileño; 2005 Ago 26–29; Belo Horizonte, MG, Brasil. Belo Horizonte: Anais do Evento (CD ROM).
14. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução no 38, de 4 de junho de 2008. Dispõe sobre a instalação e funcionamento de serviços de medicina nuclear “in vivo”. Brasília, DF: Diário Oficial da União, 18 de dezembro de 2008. Sec. 1, p. 175.
15. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução no 63, de 18 de dezembro de 2009. Dispõe sobre as boas práticas de fabricação de radiofármacos. Brasília, DF: Diário Oficial da União, 23 de dezembro de 2009. Sec. 1, p. 73.
16. Proulx A, Ballinger JR, Gulenchyn KY. Routine determination of radiochemical purity of 99mTc-MIBI. Int J Rad Appl Instrum A. 1989;40:95–7.
1. Farmacêutica da Farmácia Escola da Universidade Positivo, Curitiba, PR, Brasil.
2. Doutor, Químico do Departamento de Radiologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil.
3. Médico Especialista em Medicina Nuclear, Diretor da Cermen – Medicina Nuclear, Curitiba, PR, Brasil.
4. Doutor, Professor da Universidade Tecnológica Federal do Paraná (UTFPR), Curitiba, PR, Brasil.
Endereço para correspondência:
Daniele de Paula Faria
Edifício Centro de Medicina Nuclear, Laboratório de Radiofarmácia
Rua Doutor Ovídio Pires de Campos, s/nº, Cerqueira César
São Paulo, SP, Brasil, 05403-010
E-mail: danielefaria1@gmail.com
Recebido para publicação em 11/6/2010.
Aceito, após revisão, em 29/10/2010.
 Vol. 44 nº 1 - Jan. / Fev. of 2011
Vol. 44 nº 1 - Jan. / Fev. of 2011