INTRODUÇÃO
O linfoma representa a terceira neoplasia maligna mais comum da infância, superado apenas pelas leucemias e tumores do sistema nervoso central. De acordo com a média das taxas brutas encontradas nos registros de câncer de base populacional do Brasil, o número de casos novos de linfomas de Hodgkin para o Brasil em 2009 foi de aproximadamente 1.600 para o sexo masculino e 1.270 para o sexo feminino(1).
A avaliação da extensão da doença (estadiamento) é importante para o planejamento adequado do tratamento e determinação do prognóstico. Os métodos de imagem desempenham papel fundamental no estadiamento dos linfomas. além disso, a imagem é de grande importância no monitoramento da resposta à terapia e na detecção de recorrência do tumor(2–6).
O exame de corpo inteiro em crianças é geralmente realizado utilizando-se o escaneamento de todo o esqueleto, a cintilografia e a tomografia por emissão de pósitrons (PET), este último também combinado com tomografia computadorizada (TC). Um denominador comum a todos esses exames é a exposição a radiações ionizantes. Isto tem um efeito negativo mais significativo para crianças do que para adultos. Assim, métodos alternativos que não utilizam radiação ionizante são de extrema importância na radiologia pediátrica(7).
Ao longo dos últimos anos, observou-se um aumento da aplicação da ressonância magnética (RM) de corpo inteiro em adultos, principalmente na radiologia oncológica. Esta situação foi favorecida pela combinação de rápidas sequências associadas à movimentação da mesa de exame e à bobina de corpo, ou uma plataforma especial projetada com múltiplas bobinas.
A principal indicação deste método em pediatria tem sido na detecção de lesões da medula óssea(5,8). O potencial para estender esta aplicação a outras doenças sistêmicas está evoluindo.
A difusão por RM fornece informações funcionais que podem ser utilizadas na detecção e caracterização dos processos patológicos, incluindo tumores malignos(9–12). Portanto, pode ser de grande valor no estadiamento e acompanhamento de tumores malignos. Apesar dos avanços acima mencionados na difusão, a apneia era considerada necessária pelo fato de que o movimento respiratório era impeditivo para a aquisição das imagens de difusão(13–17). Em 2004, Takahara et al.(18) descreveram um conceito de difusão de corpo inteiro chamado
diffusion-weighted whole-body imaging with background body signal suppression (DWIBS) (difusão de corpo inteiro com supressão do sinal de fundo). Esta técnica utiliza intencionalmente a livre respiração, em vez da apneia, para a visualização dos órgãos viscerais e suas lesões. Em um artigo publicado mais tarde por Ballon et al.(19) também foi descrita a DWIBS durante a respiração. O estudo realizado por Ballon et al. era dirigido para a visualização de lesões metastáticas em tecidos estáticos (medula óssea), o que estava de acordo com a teoria aceita na época. No entanto, esses autores constataram que os órgãos viscerais, como o baço e os rins, também puderam ser analisados.
Levando-se em consideração a hipótese de que as diferenças na citoarquitetura histológica é mais bem refletida pela diferença da livre passagem das molculas de água, a difusão por RM deve ser a sequência mais sensível para o estadiamento de metástases, com a vantagem de ser mais rápida e poder avaliar maiores volumes do que as outras sequências(12).
Recentemente, foi relatado que a difusão por RM tem alta sensibilidade na detecção de doenças malignas. Assim, a difusão de corpo inteiro tem sido proposta como uma poderosa ferramenta de triagem(11).
MATERIAIS E MÉTODOS
Entre março de 2009 e novembro de 2009, realizamos trabalho prospectivo estudando o estadiamento do linfoma de Hodgkin em 12 pacientes de procedência ambulatorial, por meio da técnica de RM de corpo inteiro. O protocolo foi aprovado pelo Comitê de Ética em Pesquisa da nossa Instituição, sendo obtido consentimento por escrito do paciente e acompanhante, após a leitura de documento informativo e explicação do procedimento. Os resultados obtidos neste estudo não interferiram na conduta clínica.
Foram incluídos pacientes com diagnóstico confirmado de linfoma de Hodgkin em estádio inicial ou com suspeita clínica de recidiva. Foram excluídos os pacientes sem confirmação diagnóstica ou sem condições clínicas adequadas para a realização do exame.
O grupo estudado foi constituído por 7 homens e 5 mulheres, com idade entre 12 e 24 anos (média de 17,75 anos). Entre os 12 pacientes estudados, 6 eram casos novos e 6 apresentavam suspeita de recidiva.
Os exames foram realizados em equipamento de RM Achieva (Philips Medical Systems; Cleveland, OH, EUA), utilizando-se bobina de corpo para transmissão e recepção de sinais. Os pacientes foram posicionados em decúbito dorsal com os braços paralelos ao corpo e as sequências obtidas com respiração livre. Não foi necessário o uso de contraste intravenoso paramagnético e nenhum paciente precisou de sedação. Com base nas imagens sagitais e coronais de localização, o volume de aquisição foi planejado, em quatro seções, cobrindo todo o corpo, sendo realizadas as sequências ponderadas em T1 (tempo de repetição (TR) = 465 ms; tempo de eco (TE) = 17 ms;
field-of-view (FOV) = 515 mm; matriz = 512 × 512), T2 (TR = 1842 ms; TE = 80 ms; FOV = 515 mm; matriz = 512 × 512), STIR (TR = 5420 ms; TE = 66 ms; FOV = 515 mm; matriz = 512 × 512) e DWIBS (TR = 6348 ms; TE = 70 ms; FOV = 515 mm; matriz = 336 × 336). As sequências ponderadas em T1, T2 e STIR foram realizadas no plano coronal, com cortes de 7,0 mm de espessura, e a sequência DWIBS foi realizada no plano transversal, com cortes de 5,0 mm de espessura. As sequências T1, T2 e STIR foram reconstruídas pela técnica Mobiview, obtendo-se a fusão das seções no plano coronal, e a sequência DWIBS foi reconstruída pelas técnicas MIP e Mobiview, também se obtendo a fusão das seções no plano coronal.
A interpretação das imagens foi feita em estações de trabalho por dois examinadores independentes com experiência em RM e radiologia pediátrica. Os exames foram distribuídos aleatoriamente, sendo que a análise das sequências de um mesmo paciente foi realizada em dias diferentes. Estabeleceram-se locais de possível acometimento pelo linfoma, sendo quatro nodais (pescoço, tórax, abdome e pelve) e oito extranodais (pulmão, parede torácica, fígado, baço, rins, pâncreas, alças intestinais e medula óssea). Os sítios foram classificados como positivo quando os linfonodos fossem maiores que 1,0 cm nos seus menores eixos ou quando houvesse alteração de sinal (hipo/isossinal em T1 e T2 e hipersinal em STIR e DWIBS) e/ou fossem visualizadas massas. O número e a localização dos sítios envolvidos foram comparados entre as diversas sequências obtidas, assim como o estadiamento de cada um deles.
Foram realizadas as seguintes análises estatísticas:
– comparação dos resultados obtidos em relação às cadeias linfonodais entre os dois examinadores;
– comparação dos resultados obtidos em relação aos órgãos parenquimatosos entre os dois examinadores;
– comparação dos resultados obtidos em relação à medula óssea entre os dois examinadores;
– comparação dos resultados entre as quatro sequências, para verificar qual identifica um maior número de lesões decorrente do linfoma, para cada examinador.
RESULTADOS
Todos os exames realizados foram tecnicamente adequados, sem complicações relacionadas à técnica. Todas as imagens obtidas foram de boa qualidade, algumas apresentando artefatos sem prejuízo diagnóstico. Esses artefatos ocorreram predominantemente no tórax e abdome, sendo causados pela respiração, batimentos cardíacos e/ou movimentos (Figura 1).
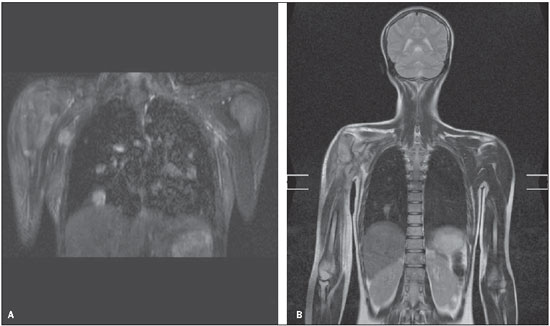
Figura 1. Artefatos de batimento cardíaco (A) e respiratório (B), que não impediram a detecção dos nódulos pulmonares.
Para a execução do exame, as sequências mais rápidas foram as ponderadas em T1 e T2, com duração de 4 minutos e 16 segundos. O tempo de duração da sequência STIR foi um pouco superior (7 minutos e 4 segundos). A sequência DWIBS foi a mais demorada, com duração de 12 minutos e 52 segundos.
Foi cronometrado o tempo necessário, de cada examinador, para a avaliação dos exames. A análise mais demorada foi encontrada na sequência DWIBS, com tempo médio de 133 segundos para o examinador 1 e 140 segundos para o examinador 2. As demais sequências apresentaram resultados semelhantes, com tempo médio variando entre 109 e 116 segundos.
O número de sítios linfonodais caracterizados como acometidos pela doença nas sequências ponderadas em T1 e T2 apresentaram resultados semelhantes (8 sítios para ambas as sequências), mas inferiores às sequências STIR e DWIBS (11 e 12 sítios, respectivamente). A diferença entre estes métodos foi em razão de um linfonodo axilar interpretado como acometido pela doença, visualizado na sequência DWIBS, que não foi identificado na sequência STIR (Figura 2), tendo sido realizada a avaliação complementar por ultrassom, que identificou linfonodo axilar com dimensões aumentadas, associado a perda da morfologia habitual e a hiperfluxo vascular ao Doppler. Na análise do acometimento de órgãos parenquimatosos, todas as sequências apresentaram resultados semelhantes. Quanto ao acometimento da medula óssea pelo linfoma, observaram-se os mesmos valores para as sequências T1, T2 e DWIBS (17 lesões), superiores ao valor encontrado na sequência STIR (13 lesões).
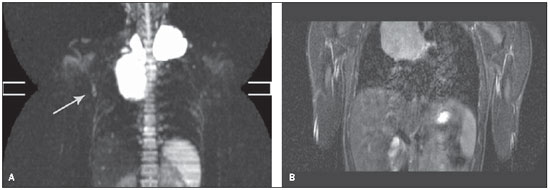
Figura 2. A: Linfonodo axilar à direita (seta) visualizado na sequência DWIBS, que não havia sido indentificado na sequência STIR (B).
Em alguns casos foram identificados hipersinais na sequência DWIBS, classificados como não representativos. Em um paciente foi detectado hipersinal na crista ilíaca direita, secundário à biópsia (Figura 3). Em dois pacientes foi visualizado hipersinal moderado difuso da medula óssea (Figura 4). Em todos os casos o baço apresentou hipersinal (Figura 4), fato que, devido à sua vascularização, este é um achado normal(18,20).
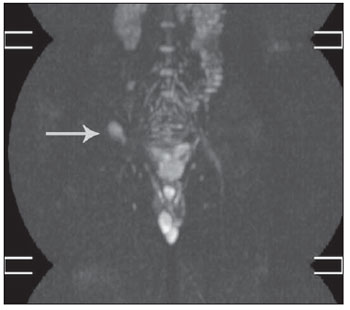
Figura 3. Hipersinal na crista ilíaca direita (seta), secundário à biópsia.
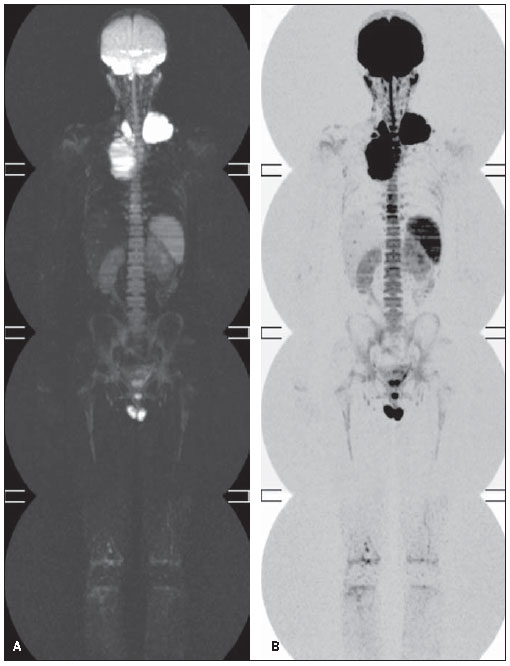
Figura 4. A: Hipersinal difuso da medula óssea. B: Inversão da escala de branco e preto.
Após a análise das imagens, os pacientes foram estadiados em cada sequência, segundo os critérios de Ann Arbor. Não foi observada diferença no estadiamento entre os dois examinadores, porém em dois casos houve divergência do estadiamento entre as sequências, ou seja, as sequências STIR e DWIBS apresentaram estadiamento maior (estádios II e III) que as sequências T1 e T2 (estádio I).
Na avaliação da concordância de resultados entre os diferentes examinadores foi utilizado o teste kappa, a um nível de significância de 5%. Para a comparação dos resultados obtidos pelos dois examinadores em relação à sequência STIR, observou-se que houve altíssimo grau de concordância (kappa variando de 0,816 a 1). Resultados semelhantes foram obtidos na análise da sequência T2, com kappa variando de 0,80 a 1. Em relação à sequência DWIBS, houve concordância (
p < 0,05) entre os resultados dos examinadores, porém não da mesma forma que os métodos anteriores (kappa variando de 0,571 a 1). Para a comparação dos resultados obtidos pelos dois examinadores em relação à sequência T1, os resultados foram semelhantes à sequência DWIBS (kappa variando de 0,625 a 1).
DISCUSSÃO
Existem diversas vantagens potenciais da RM de corpo inteiro sobre as modalidades convencionais para o estadiamento do linfoma de Hodgkin. Como a exposição a at mesmo pequenas doses de radiação ionizante pode aumentar o risco de neoplasias secundárias em crianças(21–23), a RM de corpo inteiro, isenta de radiação ionizante, poderia ser utilizada como um método alternativo no estadiamento do linfoma. também não há necessidade da administração de contraste por via oral ou intravenosa. além disso, a avaliação da extensão da doença parece ser possível com a utilização de um único método de imagem, resultando na redução do custo, sedações e número de visitas do paciente ao serviço de imagem.
A viabilidade da RM de corpo inteiro já foi demonstrada para uma srie de doenças(24–28). Alguns estudos em pacientes adultos portadores de linfoma têm avaliado a utilização da RM, tendo a TC como referência padrão. Usando esta comparação, Brennan et al.(29) relataram que a sequência STIR poderia ser usada com precisão na identificação dos linfonodos maiores que 1,2 cm.
A RM de corpo inteiro no acompanhamento e estadiamento do linfoma permite a detecção do envolvimento da medula óssea, linfonodos e órgãos parenquimatosos por esta doença. Em virtude da potencialidade do método, decidimos comparar quatro sequências de RM de corpo total (T1, T2, STIR e DWIBS), avaliando-se o tempo para a aquisição das imagens, qualidade das imagens, identificação das lesões, concordância entre os examinadores e tempo médio na análise de cada sequência.
O menor tempo para a interpretação das imagens nas sequências T1, T2 e STIR foi atribuído à maior resolução espacial destas. A sequência STIR apresentou melhor concordância entre os observadores, graças ao maior contraste entre as lesões e o tecido normal adjacente.
Os dois pacientes que apresentaram hipersinal moderado difuso da medula óssea estavam fazendo uso de Granulokine
® na época da realização do exame. Talvez a utilização desta medicação tenha sido a causa do hipersinal encontrado, pois nos exames de controle não foi evidenciado qualquer sinal de acometimento destas regiões pelo linfoma.
Embora na literatura tenha sido descrito que a difusão por RM seja mais sensível para o estadiamento de metástases, assim como na monitoração da resposta ao tratamento quimioterápico em alguns tumores, neste trabalho não encontramos diferenças significativas em relação à sequência STIR.
O presente estudo apresenta algumas limitações, como o número reduzido de pacientes e a impossibilidade de comprovação histológica das alterações caracterizadas à RM.
A RM utiliza como critrio diagnóstico de presença e atividade tumoral a alteração de sinal e/ou tamanho da lesão. Já o PET-CT estuda o metabolismo tumoral, avaliando o aumento da atividade glicolítica. Como estas duas modalidades diagnósticas são utilizadas no estadiamento e acompanhamento de pacientes oncológicos, o prosseguimento deste estudo deverá ser realizado correlacionando as imagens de RM de corpo inteiro com o PET-CT.
CONCLUSÕES
Na análise dos sítios linfonodais caracterizados como acometidos pela doença, as sequências STIR e DWIBS detectaram um maior número de lesões. Todas as sequências analisadas apresentaram resultados semelhantes na avaliação dos órgãos parenquimatosos e medula óssea. A concordância entre os examinadores foi alta em todas sequências analisadas, sendo que os melhores resultados foram obtidos na sequência STIR.
REFERÊNCIAS
1. Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Estimativa 2010: incidência de câncer no Brasil. [acessado em 20 de maio de 2010]. Disponível em: http://www.inca.gov.br/estimativa/2010/
2. Carty H, Martin J. Staging of lymphoma in childhood. Clin Radiol. 1993;48:151–9.
3. Halliday T, Baxter G. Lymphoma: pictorial review. II. Eur Radiol. 2003;13:1224–34.
4. Halliday T, Baxter G. Lymphoma: pictorial review. I. Eur Radiol. 2003;13:1154–64.
5. Hamrick-Turner JE, Saif MF, Powers CI, et al. Imaging of childhood non-Hodgkin lymphoma: assessment by histologic subtype. Radiographics. 1994;14:11–28.
6. Weinstein HJ, Tarbell NJ. Leukemias and lymphomas of childhood. In: DeVita VT, Hellman S, Rosenberg SA, editors. Cancer: principles and practice of oncology. Philadelphia: Lippincott Williams & Wilkins; 2001. p. 2235–56.
7. Kellenberger CJ, Miller SF, Khan M, et al. Initial experience with FSE STIR whole-body MR imaging for staging lymphoma in children. Eur Radiol. 2004;14:1829–41.
8. Rosenthal H, Kolb R, Gratz KF, et al. Bone manifestations in non-Hodgkin’s lymphoma in childhood and adolescence. Radiologe. 2000;40:737–44.
9. Golder WA. Lymph node diagnosis in oncologic imaging: a dilemma still waiting to be solved. Onkologie. 2004;27:194–9.
10. Pieterman RM, van Putten JW, Meuzelaar JJ, et al. Preoperative staging of non-small-cell lung cancer with positron-emission tomography. N Engl J Med. 2000;343:254–61.
11. Schmidt GP, Reiser MF, Baur-Melnyk A. Whole-body MRI for the staging and follow-up of patients with metastasis. Eur J Radiol. 2009;70:393–400.
12. Kwee TC, Takahara T, Ochiai R, et al. Diffusion-weighted whole-body imaging with background body signal suppression (DWIBS): features and potential applications in oncology. Eur Radiol. 2008;18:1937–52.
13. Low RN, Gurney J. Diffusion-weighted MRI (DWI) in the oncology patient: value of breathhold DWI compared to unenhanced and gadolinium-enhanced MRI. J Magn Reson Imaging. 2007;25:848–58.
14. Nasu K, Kuroki Y, Kuroki S, et al. Diffusion-weighted single shot echo planar imaging of colorectal cancer using a sensitivity-encoding technique. Jpn J Clin Oncol. 2004;34:620–6.
15. Nasu K, Kuroki Y, Nawano S, et al. Hepatic metastases: diffusion-weighted sensitivity-encoding versus SPIO-enhanced MR imaging. Radiology. 2006;239:122–30.
16. Taouli B, Martin AJ, Qayyum A, et al. Parallel imaging and diffusion tensor imaging for diffusion-weighted MRI of the liver: preliminary experience in healthy volunteers. AJR Am J Roentgenol. 2004;183:677–80.
17. Yoshikawa T, Kawamitsu H, Mitchell DG, et al. ADC measurement of abdominal organs and lesions using parallel imaging technique. AJR Am J Roentgenol. 2006;187:1521–30.
18. Takahara T, Imai Y, Yamashita T, et al. Diffusion weighted whole body imaging with background body signal suppression (DWIBS): technical improvement using free breathing, STIR and high resolution 3D display. Radiat Med. 2004;22:275–82.
19. Ballon D, Watts R, Dyke JP, et al. Imaging therapeutic response in human bone marrow using rapid whole-body MRI. Magn Reson Med. 2004;52:1234–8.
20. Koh DM, Collins DJ. Diffusion-weighted MRI in the body: applications and challenges in oncology. AJR Am J Roentgenol. 2007;188:1622–35.
21. Pierce DA, Preston DL. Radiation-related cancer risks at low doses among atomic bomb survivors. Radiat Res. 2000;154:178–86.
22. Brenner D, Elliston C, Hall E, et al. Estimated risks of radiation-induced fatal cancer from pediatric CT. AJR Am J Roentgenol. 2001;176:289–96.
23. Kleinerman RA. Cancer risks following diagnostic and therapeutic radiation exposure in children. Pediatr Radiol. 2006;36 Suppl 2:121–5.
24. Daldrup-Link HE, Franzius C, Link TM, et al. Whole-body MR imaging for detection of bone metastases in children and young adults: comparison with skeletal scintigraphy and FDG PET. AJR Am J Roentgenol. 2001;177:229–36.
25. Goo HW, Choi SH, Ghim T, et al. Whole-body MRI of paediatric malignant tumours: comparison with conventional oncological imaging methods. Pediatr Radiol. 2005;35:766–73.
26. Kellenberger CJ, Epelman M, Miller SF, et al. Fast STIR whole-body MR imaging in children. Radiographics. 2004;24:1317–30.
27. Kumar J, Seith A, Kumar A, et al. Whole-body MR imaging with the use of parallel imaging for detection of skeletal metastases in pediatric patients with small-cell neoplasms: comparison with skeletal scintigraphy and FDG PET/CT. Pediatr Radiol. 2008;38:953–62.
28. Laffan EE, O’Connor R, Ryan SP, et al. Whole-body magnetic resonance imaging: a useful additional sequence in paediatric imaging. Pediatr Radiol. 2004;34:472–80.
29. Brennan DD, Gleeson T, Coate LE, et al. A comparison of whole-body MRI and CT for the staging of lymphoma. AJR Am J Roentgenol. 2005;185:711–6.
1. Médico Radiologista, Pós-graduando (Mestrado) do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
2. Doutor, Professor Adjunto, Chefe da Disciplina de Diagnóstico por Imagem em Pediatria do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
3. Doutor, Médico Oncologista do Instituto de Oncologia Pediátrica (IOP/GRAACC) da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
4. Médica Radiologista da Clínica Centrus, Campinas, SP, Brasil.
5. Doutor, Professor Titular de Radiologia do Departamento de Diagnóstico por Imagem, Chefe do Centro de Diagnóstico por Imagem do Instituto de Oncologia Pediátrica (IOP/GRAACC) da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil.
Endereço para correspondência:
Dr. Daniel Nava
Avenida Francisco Glicério, 2132, Vila Itapura
Campinas, SP, Brasil, 13023-100
E-mail: daniel@centrus.com.br
Recebido para publicação em 25/8/2010.
Aceito, após revisão, em 10/11/2010.
* Trabalho realizado no Instituto de Oncologia Pediátrica da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, e no Lúmen – Centro de Diagnósticos, São Bernardo do Campo, SP, Brasil.
 Vol. 44 nº 1 - Jan. / Fev. of 2011
Vol. 44 nº 1 - Jan. / Fev. of 2011



