INTRODUÇÃO
O vírus da imunodeficiência humana (HIV) é um retrovírus que penetra nas células do sistema nervoso, produzindo lesões(1) que causam prejuízos cognitivos, motores e comportamentais, podendo levar o paciente à demência(2). Os avanços no desenvolvimento da terapia antirretroviral de alta eficácia (HAART) têm proporcionado uma redução significativa na mortalidade dos pacientes infectados pelo HIV e, consequentemente, têm auxiliado esses pacientes a chegarem à fase do envelhecimento do ciclo vital(3,4). Segundo a Organização Mundial da Saúde(5,6), a prevalência dos casos de HIV/AIDS ainda permanece bastante alta; em 2008, atingiu cerca de 730 mil, apenas no Brasil. Estes dados indicam maior longevidade desses pacientes, mas também demonstram maior favorecimento de complicações neurocognitivas, que são muito comuns em populações idosas. Essas complicações associadas ao envelhecimento passam a ser um problema significativo para os pacientes com HIV(3,7–9). Assim, a presente realidade salienta a necessidade de melhores avaliações clínicas e por imagem de pacientes com HIV/AIDS e suspeita clínica de declínio cognitivo(10).
Técnicas avançadas de aquisição e processamento de imagens de ressonância magnética (RM) têm sido utilizadas para a avaliação de pacientes com declínios cognitivos em estágios avançados, principalmente aqueles que já evoluíram para um quadro demencial(11). Estas técnicas buscam encontrar alterações morfológicas ou funcionais em pacientes que apresentam RM convencional sem alterações significativas. Estudos dessas técnicas de imagens têm mostrado importante correlação com testes neuropsicológicos(11,12), validando clinicamente as alterações encontradas. Investigações com métodos de imagens já foram conduzidas com algumas amostras de pacientes com HIV/AIDS(12,13). Thompson et al.(12) encontraram atrofia cortical importante na substância cinzenta em pacientes com AIDS nas seguintes áreas: primária sensorimotora, pré-motora, frontopolar, linguísticas frontal e temporal, pré-frontal e parietal, com correlações significativas entre essas duas últimas áreas e o desempenho nos testes neuropsicológicos aplicados. Em complementaridade, Chiang et al.(13) observaram atrofias severas em ambos os hemisférios, tanto na área primária como na de associação sensorimotora. Estas alterações encontradas nas imagens, principalmente as na substância branca, também apresentaram correlações significativas com os resultados dos testes neuropsicológicos aplicados. Nesse estudo, além desses achados, também foi observada redução volumétrica nas regiões frontal, medial e basal, parte média do giro do cíngulo e joelho do corpo caloso(13).
O HIV também pode lesar de forma precoce regiões cerebrais frontoestriatais. Lesões nestas áreas estão em geral associadas a déficits nas funções executivas(14,15). Além disso, o córtex frontal apresenta uma grande relação com o processamento das funções executivas, especialmente o sistema dorsolateral pré-frontal, bem como os gânglios da base e o córtex parietal posterior(16). A literatura tem sugerido que déficits nas funções executivas têm sido um dos comprometimentos neurocognitivos centrais no paciente HIV positivo(17). Essas funções abrangem vários processos cognitivos, que em conjunto controlam e monitoram as demais funções cerebrais, para que metas comportamentais sejam alcançadas. Elas facilitam o planejamento e a adaptação a novas situações(18,19) e servem como base para o funcionamento adequado de outros domínios cognitivos (a elas) relacionadas, como a memória.
Apesar dos possíveis prejuízos causados pelo HIV nas funções executivas, ainda se encontram poucos estudos que tenham investigado a relação entre a espessura cortical dessas regiões e o desempenho em testes neuropsicológicos que examinam componentes cognitivos destas funções em pacientes com HIV/AIDS(20,21).
Frente à importância desse tipo de investigação, este estudo teve como objetivo correlacionar a espessura cortical frontal com o desempenho em testes neuropsicológicos de exame das funções executivas em pacientes HIV-positivos. Como hipótese, esperava-se que pacientes com HIV apresentassem correlações entre a espessura cortical de áreas frontais e o desempenho principalmente em testes de avaliação da inibição.
MATERIAIS E MÉTODOS
Participantes
Foram avaliados 22 pacientes HIV-positivos (5 mulheres e 17 homens; idade média de 52,91 anos [desvio-padrão = 5,87]) com, em média, 11,95 anos de escolaridade (desvio-padrão = 4,541). Os pacientes apresentaram-se em acompanhamento clínico no Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ). Foram considerados como critérios de inclusão idade entre 45 e 65 anos, diagnóstico de infecção pelo HIV há pelo menos cinco anos, ausência de história prévia de qualquer tipo de doença neurológica, tratamento atual com HAART, ausência de alterações auditivas e/ou visuais não corrigidas, escore no Mini Exame do Estado Mental
> 17 pontos, para pacientes com escolaridade igual ou abaixo de quatro anos, ou
> 24 pontos, para pacientes com cinco anos ou mais de escolaridade.
Em conformidade com os aspectos éticos, todos os indivíduos que participaram deste estudo o fizeram de forma voluntária não remunerada e assinaram termo de consentimento livre e esclarecido. O estudo foi aprovado pelo Comitê de Ética em Pesquisa do HUCFF-UFRJ sob o n° 151/08.
Coleta dos dados
A avaliação dos pacientes foi realizada em duas partes: exame de RM e avaliação neuropsicológica. Os exames de RM foram realizados no HUCFF em aparelho de 1,5 T (Avanto; Siemens Medical Systems, Erlangen, Alemanha) com bobina de crânio de oito canais. Foram adquiridas as sequências: FLAIR axial (tempo de repetição (TR): 9000 ms; tempo de eco (TE): 83 ms; tempo de inversão (TI): 2500 ms;
flip angle: 180°; matriz: 256 × 256;
field-of-view (FOV): 230 mm), T1 3D sagital (TR: 2530 ms; TE: 3,39 ms; TI: 1100 ms;
flip angle: 7°;
voxel: 1,33 mm
3), T2 coronal (TR: 3500 ms; TE: 99 ms;
flip angle: 136°; matriz: 256 × 256; FOV: 210 mm), imagens por tensor de difusão (TR: 1900 ms; TE: 81 ms; matriz: 256 × 256; FOV: 230 mm; B = 0 s/mm
2 e B = 1000 s/mm
2, seis direções de gradiente). Todas as imagens de RM convencionais foram avaliadas como normais por dois radiologistas experientes, exceto por diferentes graus de atrofia cortical.
O processamento das imagens de RM pesadas em T1, para o estudo da espessura cortical, foi realizado pelo programa Freesurfer v4.0.5 (Martinos Center, Boston, EUA). Os detalhes técnicos de pós-processamento foram descritos em publicações anteriores(22,23). De modo resumido, o processamento incluiu correção de movimento, remoção de tecido não cerebral, transformação automática de Talairach, normalização de intensidade, segmentação de substância branca subcortical e substância cinzenta profunda, reconstrução cortical e parcelamento cortical, insuflação do cérebro e determinação de mapas da espessura cortical. Para este estudo, especificamente foram avaliadas as médias das espessuras corticais das seguintes regiões de ambos os hemisférios: pré-frontal, orbitofrontal lateral, frontal superior e cíngulo anterior caudal (Figura 1).
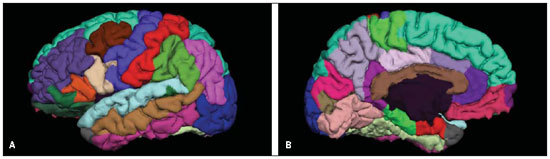
Figura 1. Vista lateral (A) e medial (B) do hemisfério cerebral esquerdo, tendo sido realizada a segmentação dos diferentes giros cerebrais pelo programa Freesurfer.
Os instrumentos da bateria neuropsicológica foram administrados por neuropsicólogos experientes e treinados nos paradigmas clínicos selecionados. A avaliação foi efetuada em uma única sessão, com duração aproximada de 90 minutos. Os instrumentos padronizados aplicados foram escolhidos por mensurarem os componentes cognitivos das funções executivas mais referidos na literatura como acometidos no quadro de HIV(24), tais como, velocidade de processamento, inibição, fluência verbal (iniciação e planejamento verbais), executivo central da memória de trabalho, flexibilidade cognitiva, organização, seleção e manutenção de estratégias, entre outros. A sequência de aplicação dos instrumentos neuropsicológicos foi planejada de forma a reduzir o efeito de interferência entre eles, sendo intercaladas tarefas verbais com não verbais, conforme segue.
1. Teste de Trilhas(25) – É composto por duas partes: (A) examina coordenação visuomotora, velocidade de processamento e atenção concentrada; (B) investiga, além dos componentes da parte A, atenção alternada, flexibilidade cognitiva e inibição.
2. Teste Wisconsin de Classificação de Cartas(26) – Avalia organização, planejamento, categorização, inibição, flexibilidade cognitiva e aprendizagem de regras.
3. Teste Hayling(27) – Avalia iniciação (parte A) e inibição (parte B) verbais, e velocidade de processamento.
4. Subteste Dígitos das Escalas Wechsler de Inteligência para Adultos (WAIS-III)(28) – Examina atenção concentrada e memória de curto prazo (ordem direta), além do componente executivo central da memória de trabalho (ordem indireta).
5. Subteste fluência verbal ortográfica da Bateria Montreal de Avaliação da Comunicação (Bateria MAC)(29) – Investiga iniciação verbal, inibição, memória lexical e linguagem.
6. Teste Stroop de Cores e Palavras(30) – Examina atenção concentrada, inibição, velocidade de processamento e flexibilidade cognitiva.
7. Mini Exame do Estado Mental(31) – É um teste de rastreamento cognitivo de sinais sugestivos de demência cortical, que foi empregado para a caracterização da amostra.
Análise estatística
Os dados obtidos por neuroimagem e por avaliação neuropsicológica foram correlacionados a partir do coeficiente de correlação de Pearson,
p < 0,05. Usou-se o Statistical Package for the Social Sciences (SPSS), 16.0.
RESULTADOS
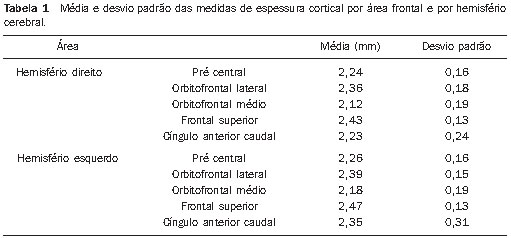
Os valores médios e o desvios-padrão da espessura cortical nas diferentes regiões estudadas são apresentados na Tabela 1.
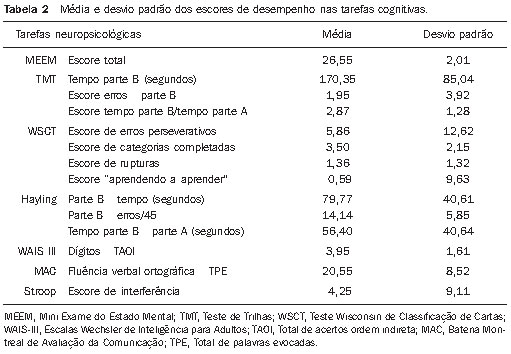
Na Tabela 2 são apresentados os escores médios e desvios-padrão do desempenho neuropsicológico obtido nos testes de funções executivas.
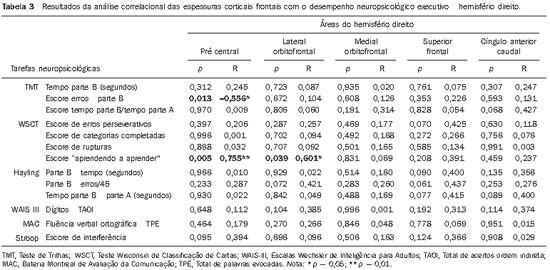
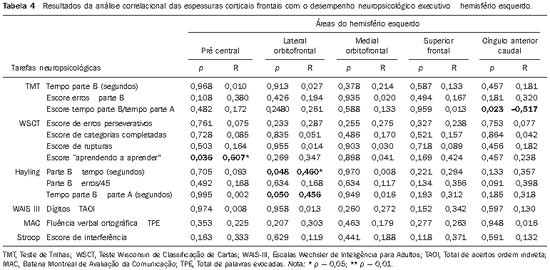
Os resultados da correlação entre os dados da espessura cortical e o desempenho nos instrumentos neuropsicológicos de funções executivas são apresentados nas Tabelas 3 (hemisfério direito) e 4 (hemisfério esquerdo).
Observa-se, nas Tabelas 3 e 4, que houve correlação positiva significativa de moderada a forte entre escores do Wisconsin e espessura cortical das regiões pré-central e orbitofrontal lateral à direita, e pré-central esquerda. Foi encontrada também uma correlação negativa significativa entre os escores do Teste de Trilhas e espessura da área pré-central direita e do cíngulo anterior caudal esquerdo. Finalmente, foram demonstradas correlações positivas significativas moderadas entre escores do Hayling e espessura da área orbitofrontal lateral esquerda.
DISCUSSÃO
O presente estudo investigou a associação entre medidas de espessura cortical de regiões frontais e pré-frontais e escores de desempenho em tarefas cognitivas que avaliaram funções executivas de pacientes HIV-positivos. A hipótese de que haveria uma associação entre as medidas morfológicas cerebrais avaliadas pela RM e medidas neuropsicológicas foi confirmada, e correlações significativas tanto positivas como negativas foram encontradas.
No que diz respeito às correlações encontradas com o Teste de Trilhas, o escore que se associou negativamente à espessura cortical do cíngulo anterior caudal esquerdo foi o tempo de execução da parte B. Este índice representa a mensuração da velocidade de processamento ligado a inibição, flexibilidade cognitiva e atenção alternada. Dessa forma, quanto mais tempo foi necessário aos pacientes HIV-positivos para fazerem a parte B desse teste, menor foi a espessura cortical desta região, sugerindo que uma lentificação de processamento da informação desses pacientes pode estar relacionada à redução da espessura do terço anterior do giro do cíngulo. Tal região vem sendo associada ao funcionamento executivo, principalmente à inibição(32). Em complementaridade, o escore do número de erros na parte mais complexa do Teste de Trilhas também se correlacionou negativamente com a espessura da região pré-central direita, indicando que quanto maior a quantidade de erros, menor é a espessura cortical desta área nos pacientes examinados. Tal região também vem sendo muito associada a componentes executivos, principalmente em pacientes com transtornos de personalidade(33).
As correlações referentes ao teste Wisconsin reforçam os achados acima discutidos sobre o Teste de Trilhas, na medida em que seu escore de aprendizagem de estratégias se correlacionou positivamente com a espessura pré-central bilateral. Isto sugere que a dificuldade dos pacientes HIV-positivos em aprender com a estratégia empregada anteriormente, assim como de resolver problemas (escore aprendendo a aprender(34)), deve estar relacionada à diminuição da espessura cortical desta região. Além deste correlato, houve associação positiva ainda entre este escore e a espessura orbitofrontal lateral direita, região relacionada aos componentes executivos medidos pelo escore aprendendo a aprender(35).
No que concerne às correlações entre os escores de tempo da parte B do teste Hayling, estas ocorreram predominantemente com o hemisfério esquerdo, com a região orbitofrontal lateral. Tal achado corrobora aquele mencionado sobre o escore do Wisconsin. Entretanto, sua interpretação implica a relação entre maior tempo nesta parte complexa da tarefa cognitiva e maior espessura cortical nas áreas examinadas. Tais dados de correlação dos escores do Hayling não foram esperados e nem foram previamente descritos, indicando, possivelmente, um aumento da espessura cortical das regiões mencionadas, para que os pacientes HIV-positivos pudessem desempenhar-se com melhores resultados, demonstrando uma possível plasticidade neural.
As correlações negativas entre o desempenho no Teste de Trilhas, parte B, e as áreas pré-frontal do hemisfério direito e cíngulo anterior caudal no hemisfério esquerdo encontradas no presente estudo assemelham-se a alguns achados na literatura de relação entre diminuição da espessura cortical e piora na velocidade de processamento(20,21). No que diz respeito ao teste Stroop, que avalia atenção concentrada, inibição, velocidade de processamento e flexibilidade cognitiva, o presente estudo não verificou nenhuma correlação entre espessura cortical, especificamente no córtex frontal, e funções executivas. No entanto, este tipo de correlação foi encontrado em um estudo com pacientes HIV-positivos sem uso de terapia antirretroviral(36).
De um modo geral, este estudo pode ser considerado relativamente pioneiro em nível nacional, com investigações tangenciais na literatura internacional. No entanto, seus achados têm um caráter preliminar e ainda exploratório. Assim, devem-se considerar as limitações do tamanho reduzido da amostra, do delineamento correlacional que não inclui grupo controle de indivíduos saudáveis ou comparativos de pacientes HIV-positivos sem tratamento antirretroviral. Outra implicação é o desenho transversal do estudo, que, por sua vez, restringe comparações da evolução de déficits cognitivos ao longo do tempo, podendo restringir, assim, a rica fonte de informação de comparar a evolução desses déficits associados ao HIV com a linha de base do próprio paciente. Investigações longitudinais são necessárias para verificar como as terapias antirretrovirais atuam nas lesões da substância branca em portadores do HIV(37), podendo também verificar com maior clareza a associação entre atrofia no córtex frontal e o funcionamento executivo. Por fim, outra limitação envolveu a correlação de muitas variáveis cognitivas e neuroanatômicas, que para este estudo preliminar mostram relações promissoras a serem mais aprofundadas e especificadas em futuros estudos. Pelo fato de que esses processos cognitivos são essenciais no funcionamento do indivíduo no dia-a-dia, mais estudos nessa área podem orientar profissionais não só na clínica, como também na pesquisa em como desenvolver tratamentos mais eficazes na redução de déficits cognitivos em indivíduos HIV-positivos. Tais ações de intervenção, tanto medicamentosas quanto cognitivas, podem contribuir para prevenir ou reduzir comprometimentos nas funções executivas antes que evoluam para demências associadas ao HIV.
Concluindo, de acordo com os resultados deste estudo com 22 pacientes infectados pelo HIV, pode-se observar que há uma correlação entre a espessura cortical frontal e o desempenho em testes neuropsicológicos de funções executivas. As correlações demonstradas neste estudo sugerem que os déficits executivos nos pacientes HIV-positivos relacionam-se a uma diminuição da espessura cortical em diversas regiões frontais, com maior importância no hemisfério esquerdo. As correlações positivas indicando aumento da espessura em algumas regiões podem estar relacionadas à plasticidade neuronal nos pacientes com infecção pelo HIV(38). Estudos futuros são necessários para corroborar estes resultados, mostrando de forma mais clara evidências da interface entre neurorradiologia e neuropsicologia em quadros neurodegenerativos relacionados à infecção pelo HIV.
Agradecimentos
Às instituições de fomento à pesquisa Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (Faperj).
REFERÊNCIAS
1. Christo PP. Alterações cognitivas na infecção pelo HIV e AIDS. Rev Assoc Med Bras. 2010;56:242–7.
2. Bottiggi KA, Chang JJ, Schmitt FA, et al. The HIV dementia scale: predictive power in mild dementia and HAART. J Neurol Sci. 2007;260:11–5.
3. Cysique LA, Brew BJ. Neuropsychological functioning and antiretroviral treatment in HIV/AIDS: a review. Neuropsychol Rev. 2009;19:169–85.
4. Woods SP, Moore DJ, Weber E, et al. Cognitive neuropsychology of HIV-associated cognitive disorders. Neuropsychol Rev. 2009;19:152–68.
5. World Health Organization. Global summary of the HIV/AIDS epidemic, December 2008. [acessado em 26 de outubro de 2010]. Disponível em: http://www.who.int/hiv/data/2009_global_summary.gif
6. World Health Organization. Epidemological fact sheet on HIV and AIDS: core data on epidemiology and response – Brazil, December 2008. [acessado em 26 de outubro de 2010]. Disponível em: http://www.who.int/countries/bra/en/
7. Tozzi V, Balestra P, Bellagamba R, et al. Persistence of neuropsychologic deficits despite long-term highly active antiretroviral therapy in patients with HIV-related neurocognitive impairment: prevalence and risk factors. J Acquir Immune Defic Syndr. 2007;45:174–82.
8. Deeks SG. HIV infection, inflammation, immunosenescence, and aging. Annu Rev Med. 2011;62:141–55.
9. Brew BJ, Crowe SM, Landay A, et al. Neurodegeneration and ageing in the HAART era. J Neuroimmune Pharmacol. 2009;4:163–74.
10. Kochunov P, Robin DA, Royall DR, et al. Can structural MRI indices of cerebral integrity track cognitive trends in executive control function during normal maturation and adulthood? Hum Brain Mapp. 2009;30:2581–94.
11. Sjöbeck M, Elfgren C, Larsson EM, et al. Alzheimer's disease (AD) and executive dysfunction. A case-control study on the significance of frontal white matter changes detected by diffusion tensor imaging (DTI). Arch Gerontol Geriatr. 2010;50:260–6.
12. Thompson PM, Dutton RA, Hayashi KM, et al. Thinning of the cerebral cortex visualized in HIV/AIDS reflects CD4+ T lymphocyte decline. Proc Natl Acad Sci U S A. 2005;102:15647–52.
13. Chiang MC, Dutton RA, Hayashi KM, et al. 3D pattern of brain atrophy in HIV/AIDS visualized using tensor-based morphometry. Neuroimage. 2007;34:44–60.
14. Gunning-Dixon FM, Murphy CF, Alexopoulos GS, et al. Executive dysfunction in elderly bipolar manic patients. Am J Geriatr Psychiatry. 2008;16:506–12.
15. Melrose RJ, Tinaz S, Castelo JMB, et al. Compromised fronto-striatal functioning in HIV: an fMRI investigation of semantic event sequencing. Behav Brain Res. 2008;188:337–47.
16. Stuss DT, Levine B. Adult clinical neuropsychology: lessons from studies of the frontal lobes. Annu Rev Psychol. 2002;53:401–33.
17. Dawes S, Suarez P, Casey CY, et al. Variable patterns of neuropsychological performance in HIV-1 infection. J Clin Exp Neuropsychol. 2008;30:613–26.
18. Collette F, Van der Linden M, Laureys S, et al. Exploring the unity and diversity of the neural substrates of executive functioning. Hum Brain Mapp. 2005;25:409–23.
19. Collette F, Hogge M, Salmon E, et al. Exploration of the neural substrates of executive functioning by functional neuroimaging. Neuroscience. 2006;139:209–21.
20. Harrison MJG, Newman SP, Hall-Craggs MA, et al. Evidence of CNS impairment in HIV infection: clinical, neuropsychological, EEG, and MRI/MRS study. J Neurol Neurosurg Psychiatry. 1998;65:301–7.
21. Poutiainen E, Elovaara I, Raininko R, et al. Cognitive performance in HIV-1 infection: relationship to severity of disease brain atrophy. Acta Neurol Scand. 1993;87:88–94.
22. Fischl B, Salat DH, Busa E, et al. Whole brain segmentation: automated labeling of neuroanatomical structures in the human brain. Neuron. 2002;33:341–55.
23. Desikan RS, Sgonne F, Fischl B, et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. Neuroimage. 2006;31:968–80.
24. Rippeth JD, Heaton RK, Carey CL, et al. Methamphetamine dependence increases risk of neupsychological impairment in HIV infected persons. J Int Neuropsychol Soc. 2004;10:1–14.
25. Fonseca RP, Grassi-Oliveira R, Oliveira CR, et al. Instruments of executive functions assessment: preliminary normative data and sociodemographic studies. Dement Neuropsychol. In Press.
26. Cunha JA, Trentini CM, Argimon IL, et al. Teste Wisconsin de classificação de cartas – adaptação e padronização brasileira. São Paulo, SP: Casa do Psicólogo; 2005.
27. Fonseca RP, Oliveira CR, Gindri G, et al. Teste Hayling: um instrumento de avaliação de componentes das funções executivas. In: Hutz CS, organizador. Avanços em avaliação psicológica e neuropsicológica de crianças e adolescentes. 1ª ed. São Paulo, SP: Casa do Psicólogo; 2010. p. 337–64.
28. Nascimento E. Adaptação, validação e normatização do WAIS-III para uma amostra brasileira. In: Wechsler D. WAIS-III: manual para administração e avaliação. São Paulo, SP: Casa do Psicólogo; 2004. p. 161–92.
29. Fonseca RP, Parente MAMP, Cote H, et al. Bateria Montreal de avaliação da comunicação – Bateria MAC. Barueri, SP: Pró-Fono; 2008.
30. Strauss E, Sherman EMS, Spreen O. Executive functions. In: Strauss E, Sherman EMS, Spreen O, editors. A compendium of neuropsychological tests: administration, norms, and commentary. 3rd ed. New York, NY: Oxford University Press; 2006. p. 401–545.
31. Almeida OP. Mini exame do estado mental e o diagnóstico de demência no Brasil. Arq Neuropsiquiatr. 1998;56:605–12.
32. Hoerst M, Weber-Fahr W, Tunc-Skarka N, et al. Correlation of glutamate levels in the anterior cingulate cortex with self-reported impulsivity in patients with borderline personality disorder and healthy controls. Arch Gen Psychiatry. 2010;67:946–54.
33. Swick D, Jovanovic J. Anterior cingulate cortex and the Stroop task: neuropsychological evidence for topographic specificity. Neuropsychologia. 2002;40:1240–53.
34. Szbot CM, Eizirik M, Cunha RD, et al. Neuroimagem no transtorno de déficit de atenção/hiperatividade. Rev Bras Psiquiatr. 2001;23(Supl I):32–5.
35. Keller M, Werlang BSG. Flexibilidade na resolução de problemas em tentadores de suicídio. J Bras Psiquiatr. 2005;54:128–36.
36. Chang L, Ernst T, Witt MD, et al. Relationships among brain metabolites, cognitive function, and viral loads in antiretroviral-naïve HIV patients. Neuroimage. 2002;17:1638–48.
37. Li X, Lu ZL, D'Argembeau A, et al. The Iowa Gambling Task in fMRI images. Human Brain Mapp. 2010;31:410–23.
38. Vance DE. Implications of positive and negative neuroplasticity on cognition in HIV. Med Sci Monit. 2010;16:HY3–5.
1. Doutora, Psicóloga, Pós-doutoranda do Programa de Pós-Graduação em Medicina (Radiologia) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
2. Psicóloga, Mestranda do Programa de Pós-Graduação em Medicina (Radiologia) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
3. Médicos Radiologistas, Mestrandos do Programa de Pós-Graduação em Medicina (Radiologia) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
4. Aluno do Curso de Graduação em Medicina da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil.
5. Mestre, Doutorando do Programa de Pós-Graduação em Medicina (Radiologia) da Universidade Federal do Rio de Janeiro (UFRJ), Físico Médico da Clínica de Diagnóstico Por Imagem (CDPI), Rio de Janeiro, RJ, Brasil.
6. Físico Médico da Clínica de Diagnóstico Por Imagem (CDPI), Rio de Janeiro, RJ, Brasil.
7. Doutor, Professor Adjunto do Departamento de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Chefe do Serviço de Radiodiagnóstico do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), Médico Radiologista da Clínica Menezes da Costa, Rio de Janeiro, RJ, Brasil.
8. Doutora, Psicóloga, Professora Adjunta da Faculdade de Psicologia e Coordenadora do Grupo Neuropsicologia Clínica e Experimental da Pontifícia Universidade Católica do Rio Grande do Sul (PUCRS), Porto Alegre, RS, Brasil, Pós-Doutoranda no Centro de Neuroimagem da Universidade de Montreal, Quebec, Canadá.
9. Doutor, Professor Adjunto do Departamento de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Coordenador do Setor de Ressonância Magnética do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), Médico Neurorradiologista da Clínica de Diagnóstico Por Imagem (CDPI), Rio de Janeiro, RJ, Brasil.
Endereço para correspondência:
Dr. Emerson L. Gasparetto
Estrada da Barra da Tijuca, 1006, ap. 1106, Bloco 5
Barra da Tijuca. Rio de Janeiro
RJ, Brasil, 22641-003
E-mail: egasparetto@gmail.com
Recebido para publicação em 28/10/2010.
Aceito, após revisão, em 19/11/2010.
* Trabalho realizado no Serviço de Radiodiagnóstico do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), Rio de Janeiro, RJ, Brasil.
 Vol. 44 nº 1 - Jan. / Fev. of 2011
Vol. 44 nº 1 - Jan. / Fev. of 2011