Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 6 - Nov. / Dez. of 2010
Vol. 43 nº 6 - Nov. / Dez. of 2010
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Vanessa Granado Alves Itagiba1; Rafael Borges2; Luiz Celso Hygino da Cruz Jr3; Andre Dietz Furtado4; Romeu Côrtes Domingues5; Emerson Leandro Gasparetto6 |
|
|
Descritores: Tensor de difusão; Substância branca; Tumores cerebrais. |
|
|
Resumo: INTRODUÇÃO
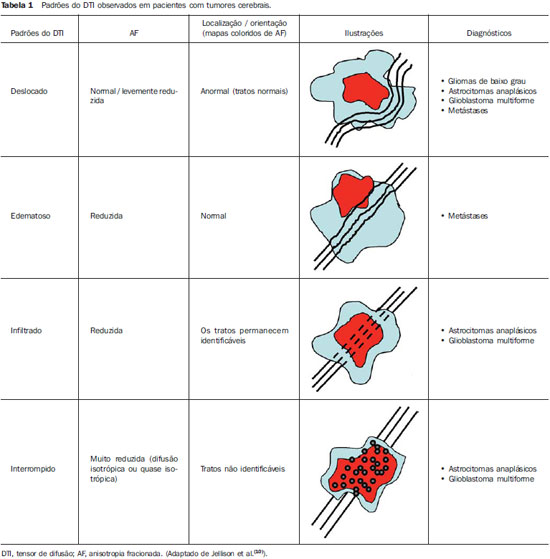
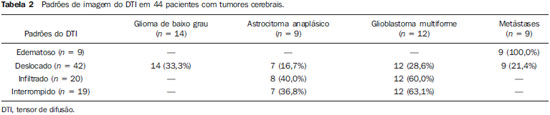
A ressonância magnética (RM) tem sido amplamente utilizada para a avaliação de pacientes com tumores cerebrais(1,2). No entanto, em muitos casos, os achados de imagem da RM convencional não são suficientes para a definição precisa do diagnóstico diferencial(1,3,4). Recentemente, técnicas avançadas de RM, incluindo espectroscopia, tensor de difusão (DTI), perfusão e blood oxygen level dependent (BOLD), vêm acrescentando informações importantes a respeito não só do diagnóstico dos tumores, mas também sobre as opções de tratamento, acompanhamento e prognóstico(1,3,5). Atualmente, o DTI tem alcançado uma maior importância no estudo de pacientes com tumores cerebrais(1,3,6). Com o DTI é possível descrever a direção do movimento das moléculas de água no interior dos tecidos(1,3,7,8). Em estruturas, tais como os tratos de substância branca, a difusão das moléculas será mais restrita perpendicular do que paralela às fronteiras da microestrutura, o que é chamado de difusão anisotrópica(1,3,7,9). Esta informação pode gerar um mapa esquemático colorido dos tratos de substância branca, em que a intensidade da cor é diretamente proporcional à anisotropia fracionada (AF)(1,7). O pós-processamento do DTI (tractografia) permite a avaliação da relação anatômica entre o tumor e os tratos de substância branca adjacentes, tornando possível realizar a ressecção máxima do tumor e ao mesmo tempo minimizar a morbidade cirúrgica associada a esses procedimentos(1,3). Alguns autores sugeriram uma classificação que padroniza os tipos de envolvimento da substância branca em pacientes com tumores cerebrais, de acordo com os achados de imagem do DTI, visando à melhor avaliação pré-operatória dessas lesões(1,2,6,10). Eles consideraram os padrões de envolvimento da substância branca cerebral em torno do tumor como edematoso, deslocado, infiltrado e interrompido(1,6,10). A classificação dos diferentes padrões foi baseada nos valores da AF, na direção e na integridade do trato de substância branca adjacente ao tumor(1,2,6). Todavia, de acordo com nosso conhecimento, esta classificação só foi aplicada em pequenas séries de pacientes, o que limita sua avaliação. O objetivo deste estudo foi avaliar os resultados do DTI de 44 pacientes com tumores cerebrais, que foram submetidos a RM pré-operatória. Tentamos reproduzir, em uma série maior de pacientes com tumor cerebral, os diferentes padrões de DTI relatados anteriormente(1,6,10), com o objetivo de avaliar o papel do DTI no estudo do acometimento dos tratos de substância branca em pacientes com tumores cerebrais e a utilidade desta técnica para o diagnóstico diferencial dessas neoplasias. MATERIAIS E MÉTODOS O estudo de coorte incluiu 44 pacientes com neoplasias intracranianas (24 do sexo masculino e 20 do sexo feminino, faixa etária entre 3 e 88 anos, idade média de 44 anos) submetidos a RM para avaliação pré-cirúrgica. Os diagnósticos finais dos tumores foram baseados na avaliação histológica do material obtido com a ressecção cirúrgica (n = 37) ou biópsia estereotáxica (n = 7). A série incluiu gliomas de baixo grau (n = 14), glioblastomas multiformes (n = 12), astrocitomas anaplásicos (n = 9) e metástases (n = 9). Todos os pacientes assinaram termo de consentimento informado e o Comitê de Ética e Pesquisa da nossa Instituição aprovou o estudo. Aquisição de imagens pela RM Os estudos de RM foram realizados em aparelho de 1.5 T Avanto (Siemens Medical Systems; Erlangen, Alemanha), utilizando bobina de crânio de 8 canais. Os pacientes foram submetidos a protocolo de RM convencional, incluindo as sequências: imagens ponderadas em T2 no plano coronal (TR: 4410 ms, TE: 98 ms, FOV: 240 mm, matriz: 320 Χ 320 e 3 mm de espessura de corte, com 30% de intervalo), imagens em FLAIR no plano axial (TR: 9950 ms, TE: 100 ms, FOV: 220 mm, matriz: 256 Χ 256 e 5 mm de espessura de corte, com 35% de intervalo) e imagens ponderadas em T1 nos planos axial e sagital (TR: 375 ms, TE: 11 ms, FOV: 240 mm, matriz: 212 Χ 256 e 5 mm de espessura de corte, com 30% de intervalo) antes e após administração intravenosa de 0,1 mmol/kg de gadolínio. Aquisição de imagens com o DTI As imagens do DTI foram realizadas através de uma sequência single-shot eco-planar com fator de aceleração dos dois e com os seguintes parâmetros: TR: 3100 ms, TE: 90 ms, FOV: 250 Χ 250 mm, matriz: 192 Χ 192, espessura de corte: 5 mm, intervalo: 1,5 mm, largura de banda: 1346 kHz, fator de EPI: 128, eco-spacing: 0,83, ângulo de inclinação: 90°, NEX: 3, codificação de difusão em 12 direções diferentes e valores de b iguais a zero e 1000 s/mm2. Pós-processamento e análise das imagens do DTI Todas as imagens foram transferidas para uma estação de trabalho Leonardo (Siemens Medical Solutions; Erlangen, Alemanha) e pós-processadas com o software DTI Task Card (Centro MGH-Martino; Boston, EUA). Valores de b, AF e mapas coloridos de AF foram calculados automaticamente de acordo com protocolos descritos anteriormente na literatura(7). O mapa colorido de AF foi gerado pelo mapeamento dos principais componentes eigenvector x, y e z, em cores vermelho, verde e azul, que foram pesados pela AF. Nos mapas coloridos, por definição, os tratos de substância branca em vermelho têm orientação na direção direita/esquerda, os tratos em verde na direção anterior/posterior e os tratos em azul na direção superior/inferior(1). Definimos a AF como o índice de anisotropia para permitir a comparação com outros estudos, pois a maioria tem utilizado este índice(11–14). Para a análise das imagens, os tratos de substância branca adjacentes aos tumores foram comparados visualmente com os tratos contralaterais correspondentes e caracterizados da seguinte forma (Tabela 1): a) deslocados, se mantiveram anisotropia normal ou levemente diminuída em relação ao trato correspondente no hemisfério contralateral, mas situavam-se em posição e/ou orientação anormal no mapa colorido de AF; b) edematosos, se mostraram anisotropia reduzida, mas mantiveram posição e orientação normais no mapa colorido de AF; c) infiltrados, se demonstraram redução da anisotropia, porém se mantiveram identificáveis nos mapas de orientação coloridos, mas exibiram tonalidades alteradas, que não foram atribuídas ao efeito de massa; d) interrompidos, se a anisotropia foi drasticamente reduzida, de tal forma que o trato não pôde ser identificado nos mapas de orientação(1,6). Dois experientes neurorradiologistas analisaram inicialmente todos os resultados do DTI antes de avaliar as imagens estruturais de RM e chegaram, em consenso, às decisões definitivas em relação aos diferentes padrões de envolvimento da substância branca cerebral. RESULTADOS Os achados mais comuns do DTI, evidenciados nesta série de pacientes com tumores cerebrais, são listados na Tabela 1. Em pacientes com gliomas de baixo grau, apenas o padrão deslocado foi observado (14/14; 100%) (Figura 1). Os casos de astrocitoma anaplásico mostraram os padrões infiltrado (9/8; 88,9%), deslocado (9/7; 77,8%) e interrompido (9/7; 77,8%), geralmente em associação (Figura 2). Todos os pacientes com glioblastoma multiforme apresentaram os padrões deslocado, interrompido e infiltrado (12/12; 100%) (Figura 3). Em relação aos pacientes com metástase, todos demonstraram os padrões deslocado e edematoso (9/9; 100%) (Figura 4). 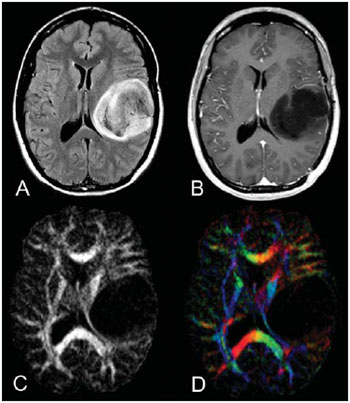 Figura 1. Paciente do sexo feminino, 32 anos de idade, com glioma de baixo grau na região frontotemporal esquerda. Em A, imagem em FLAIR axial mostra uma massa bem circunscrita, heterogênea, com intensidade de sinal elevada, localizada na região frontotemporal esquerda. Em B, imagem em T1 axial pós-contraste não demonstra realce da lesão. Em C, mapa de AF mostra a parte posterior da cápsula interna deslocada medialmente. Em D, mapa direcional colorido axial demonstra anisotropia normal e localização anormal do braço posterior da cápsula interna (padrão deslocado). 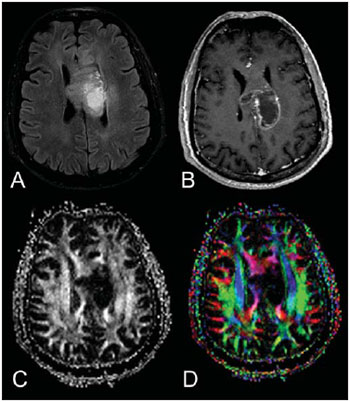 Figura 2. Paciente do sexo feminino, 49 anos de idade, com astrocitoma anaplásico no centro semioval esquerdo com extensão para o corpo caloso. Em A, imagem em FLAIR axial mostra uma massa heterogênea, hiperintensa, envolvendo o corpo do corpo caloso. Em B, imagem em T1 axial pós-contraste demonstra realce periférico no tumor. Em C, mapa AF mostra redução significativa da AF no corpo do corpo caloso. Deslocamento da coroa radiada esquerda também é visto. Em D, mapa direcional colorido no plano axial demonstra completa destruição das fibras do corpo do corpo caloso (padrão interrompido). A coroa radiada no hemisfério esquerdo é deslocada (padrão deslocado) e mostra anisotropia reduzida e desorientação das fibras (tonalidades assimétricas) (padrão infiltrado). 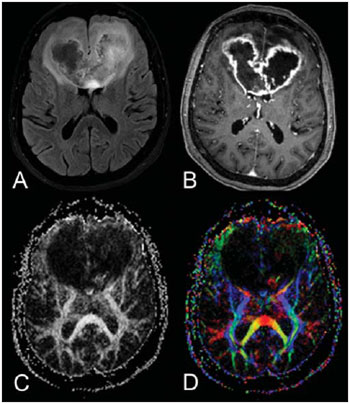 Figura 3. Paciente do sexo masculino, 62 anos de idade, com glioblastoma multiforme envolvendo o corpo caloso e ambos os lobos frontais (asa de borboleta). Em A, imagem em FLAIR axial mostra uma massa heterogênea envolvendo o joelho do corpo caloso e ambos os lobos frontais, circundado por uma área de hipersinal (edema peritumoral/infiltração). Em B, imagem em T1 axial pós-contraste demonstra realce periférico do tumor. Em C, mapa AF mostra baixo sinal difuso do joelho do corpo caloso e dos tratos de substância branca em ambos os lobos frontais. Em D, mapa direcional de cores no plano axial mostra a destruição completa do joelho do corpo caloso e dos tratos de substância branca dos lobos frontais (padrão interrompido). Os braços anteriores das cápsulas internas são deslocados (padrão de deslocado) e ambos têm anisotropia reduzida e desorientação das fibras de substância branca (refletida em tonalidades assimétricas) (padrão infiltrado). 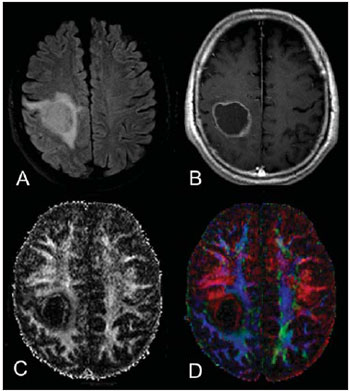 Figura 4. Paciente do sexo masculino, 59 anos de idade, com metástase pulmonar na região frontoparietal. Em A, imagem em FLAIR axial mostra uma massa hiperintensa na região frontoparietal direita rodeada de edema vasogênico. Em B, imagem em T1 axial pós-contraste demonstra realce periférico na lesão. Em C, mapa AF mostra redução da anisotropia na substância branca em torno do tumor. Em D, mapa direcional de cores no plano axial mostra anisotropia reduzida na área circunjacente à metástase (refletida pela perda do brilho), mas com a localização e orientação normais (tonalidades normais em relação ao hemisfério contralateral) (padrão edematoso). Além disso, há um desvio medial da coroa radiada (padrão deslocado). Alternativamente, comparando-se os padrões do DTI com cada diagnóstico histológico, observa-se que houve uma significativa sobreposição entre eles, uma vez que diferentes tumores demonstraram os mesmos padrões de envolvimento da substância branca cerebral adjacente aos tumores (Tabela 2). O padrão deslocado (n = 42) foi demonstrado em casos de gliomas de baixo grau (33,3%), glioblastomas multiformes (28,6%), metástases (21,4%) e astrocitomas anaplásicos (16,7%). O padrão interrompido (n = 19) foi encontrado em pacientes com glioblastomas multiformes (63,2%) e astrocitomas anaplásicos (36,8%). Finalmente, o padrão infiltrado (n = 20) foi demonstrado em casos de glioblastomas multiformes (60%) e astrocitomas anaplásicos (40%). DISCUSSÃO Um grande desafio para o planejamento cirúrgico dos tumores cerebrais é identificar o grau de infiltração de células malignas nos tratos de substância branca. As células tumorais podem invadir e modificar as estruturas das fibras da substância branca, alargando, deslocando, e/ou interrompendo os feixes de fibras(15). O tratamento cirúrgico dos tumores cerebrais tem por objetivo alcançar a máxima ressecção possível, causando o menor dano possível ao cérebro intacto não afetado pelo tumor, reduzindo, assim, os déficits neurológicos decorrentes do procedimento. Isso requer o mapeamento tumoral pré- e intraoperatório, bem como sua relação com estruturas funcionais, de modo que estas estruturas possam ser preservadas durante a ressecção cirúrgica(10). No presente estudo foram avaliados os resultados do DTI de 44 pacientes com tumores cerebrais que realizaram RM pré-operatória, com o objetivo de descrever os padrões de envolvimento tumoral dos tratos de substância branca. Nossos resultados demonstraram os padrões de envolvimento da substância branca pelo DTI descritos anteriormente, denominados de edematoso, deslocado, infiltrado e interrompido(1,6). Observou-se considerável sobreposição entre os diferentes padrões do DTI e os tipos histológicos mais comuns. O padrão interrompido foi encontrado em astrocitomas anaplásicos e glioblastomas multiformes, enquanto o padrão deslocado foi visto em metástases e gliomas de baixo e alto graus, e o padrão edematoso apenas em casos de metástases. A RM convencional não é capaz de demonstrar detalhes anatômicos relevantes de forma satisfatória e não fornece informações suficientes sobre a localização e a integridade dos feixes de fibras(15,16). Recentemente, técnicas avançadas de RM, incluindo espectroscopia, DTI, perfusão e BOLD, acrescentaram informações importantes a respeito não só do diagnóstico dos tumores, mas também sobre as opções de tratamento, acompanhamento e prognóstico(1,3,5,9). O estudo dos tratos de substância branca com o uso do DTI permite a investigação não invasiva das fibras neuronais, com base nas características de imagem da difusão anisotrópica da água. A anisotropia da difusão da água na substância branca cerebral é decorrente da sua organização em fibras axonais mielinizadas, em que a difusão é mais rápida paralela do que perpendicular aos tratos de fibras(1,7,15,17). Estudos anteriores avaliaram os achados do DTI em pacientes com tumores cerebrais, com o objetivo de analisar os diferentes padrões de envolvimento da substância branca cerebral(1,6,18). A classificação sugerida considera os valores da AF e a integridade e a direção dos tratos de substância branca nos mapas coloridos de AF. Os tratos foram classificados como deslocados nos casos em que a anisotropia é normal ou levemente diminuída, situada em posição e/ou orientação anormal. O padrão infiltrado caracteriza-se por anisotropia reduzida, sem deslocamento da arquitetura normal da substância branca, permanecendo identificável nos mapas codificados em cores de AF, porém apresentam tonalidades anormais. Os tratos com anisotropia reduzida, mas com localização e/ou orientação normal, foram chamados de edematosos. Os padrões infiltrado e edematoso parecem estar associados à infiltração dos tratos pelo tumor e/ou edema, e a diferenciação entre eles nem sempre é possível. Ambos os padrões foram caracterizados por redução substancial da AF, entretanto, na maioria dos casos, eles diferem em sua aparência nos mapas direcionais coloridos(6). Os tratos com padrão edematoso apresentaram localização e/ou direção normais (tonalidades normais nos mapas coloridos), já os tratos que apresentaram o padrão infiltrado demonstraram tonalidades anormais nos mapas coloridos, não imputáveis ao efeito de massa, o que reflete uma forma mais grave de desorganização(6, 10,19). Finalmente, os tratos com acentuada redução da anisotropia e não identificáveis nos mapas coloridos direcionais foram classificados como interrompidos. No entanto, as pequenas séries incluídas nesses estudos limitam a aplicação clínica desses padrões de envolvimento da substância branca em torno dos tumores cerebrais. Witwer et al.(1) estudaram os resultados do DTI em nove pacientes com tumores cerebrais, aplicando a classificação previamente descrita. Eles avaliaram seis casos de gliomas de baixo grau, dois de gliomas de alto grau e um caso de metástase. Os autores verificaram que o padrão deslocado somente foi evidenciado em pacientes com gliomas de baixo grau. O padrão edematoso foi demonstrado em um caso de glioma de alto grau e em um paciente com metástase. Os padrões infiltrado e interrompido foram encontrados em um caso de glioma de alto e baixo graus, respectivamente. O mesmo grupo publicou, dois anos mais tarde, um estudo com 13 casos de tumores cerebrais (primários e secundários, baixo e alto graus) que foram avaliados com uma abordagem semelhante(6). Os resultados foram quase idênticos ao primeiro estudo, com os padrões deslocado e edematoso vistos em tumores malignos e benignos; o padrão infiltrado foi demonstrado em gliomas infiltrativos e o padrão interrompido foi observado em tumores de baixo e alto graus. Em nossa série encontramos resultados conflitantes quando comparados com os resultados de Witwer et al.(1). O padrão deslocado foi inespecífico, uma vez que foi encontrado em casos de metástases e gliomas de baixo e alto graus. O padrão edematoso foi demonstrado apenas em casos de metástases, diferindo dos resultados anteriores, que apresentaram este padrão também em casos de gliomas de alto grau. Além disso, os padrões infiltrado e interrompido, já demonstrados anteriormente em pacientes com gliomas de baixo e alto graus, foram vistos apenas em casos de gliomas de alto grau. Em nossa série, os casos de gliomas de baixo grau apresentaram apenas o padrão deslocado, no entanto, este padrão não é específico para esses tumores, já que foi descrito anteriormente em astrocitomas anaplásicos, glioblastomas multiformes e metástases cerebrais(1,6). Todos os nove casos de metástases apresentaram ambos os padrões, deslocado e edematoso. Como mencionado, o padrão deslocado também foi encontrado em gliomas de baixo e alto graus, o que torna este padrão não específico. Embora nossos resultados tenham demonstrado que o padrão edematoso só foi visto em metástases, este padrão também foi descrito anteriormente em gliomas(1,6). Em nosso estudo, o padrão interrompido foi demonstrado somente em casos de gliomas de alto grau, no entanto, foi descrito anteriormente(1) em um caso de glioma de baixo grau. Em nossa série, alguns padrões do DTI tiveram boa correlação com os diagnósticos histológicos, tais como o padrão edematoso visto nas metástases e os padrões infiltrado e interrompido observados apenas em gliomas de alto grau, o que poderia sugerir que o DTI fosse capaz de fazer a distinção entre gliomas de alto e baixo graus e metástases. Embora nossos dados tenham sido relevantes, notamos que houve considerável sobreposição entre os diferentes padrões e os diagnósticos finais, o que não permite o diagnóstico diferencial da maioria desses tumores usando os padrões de envolvimento da substância branca cerebral pelo DTI. Nosso estudo tem algumas limitações. Embora os estudos iniciais tenham sugerido as vantagens do DTI no planejamento pré-cirúrgico de tumores cerebrais, esses estudos, tais como nossos resultados, são conclusões preliminares. Outro problema é a suscetibilidade da sequência DTI a artefatos que podem causar distorções nas imagens. Além disso, a definição dos diferentes padrões de envolvimento da substância branca cerebral é basicamente visual e, portanto, suscetível a discordâncias interobservadores. Por último, embora nós tenhamos apresentado uma das maiores séries de tumores cerebrais avaliados com o DTI, o número de indivíduos incluídos no estudo ainda é pequeno, especialmente em relação ao número de pacientes nos diferentes subgrupos. CONCLUSÃO Os padrões de envolvimento dos tratos de substância branca cerebral analisados pelo DTI auxiliam no mapeamento dos tratos adjacentes aos tumores e fornecem informações relevantes sobre a extensão tumoral. Embora tenhamos observado que esses padrões podem auxiliar no diagnóstico diferencial de algumas neoplasias, tais como o padrão edematoso visto nas metástases e os padrões infiltrado e interrompido encontrados em gliomas de alto grau, quando comparamos nossos resultados com estudos anteriores percebemos que há uma considerável sobreposição entre os padrões e os diagnósticos histológicos finais. Portanto, de acordo com estudos anteriores, sugerimos que, embora o DTI tenha papel relevante na avaliação pré-cirúrgica dos pacientes com tumores cerebrais, esta ainda não é uma técnica útil para o diagnóstico diferencial desses tumores. Embora o DTI tenha algumas limitações, esta técnica está ganhando força como um método pré-operatório para avaliar tumores cerebrais intimamente relacionados a áreas eloquentes, otimizando as estratégias cirúrgicas. No entanto, no futuro, com aperfeiçoamentos técnicos, o DTI pode vir a ser uma importante ferramenta para o diferencial entre os tumores cerebrais. REFERÊNCIAS 1. Witwer BP, Moftakhar R, Hasan KM, et al. Diffusion-tensor imaging of white matter tracts in patients with cerebral neoplasm. J Neurosurg. 2002;97:568–75. 2. Yu CS, Li KC, Xuan Y, et al. Diffusion tensor tractography in patients with cerebral tumors: a helpful technique for neurosurgical planning and postoperative assessment. Eur J Radiol. 2005;56:197–204. 3. Sundgren PC, Dong Q, Gómez-Hassan D, et al. Diffusion tensor imaging of the brain: review of clinical applications. Neuroradiology. 2004;46:339–50. 4. Beppu T, Inoue T, Shibata Y, et al. Measurement of fractional anisotropy using diffusion tensor MRI in supratentorial astrocytic tumors. J Neurooncol. 2003;63:109–16. 5. Holodny AI, Ollenschleger MD, Liu WC, et al. Identification of the corticospinal tracts achieved using blood-oxygen-level-dependent and diffusion functional MR imaging in patients with brain tumors. AJNR Am J Neuroradiol. 2001;22:83–8. 6. Field AS, Alexander AL, Wu YC, et al. Diffusion tensor eigenvector directional color imaging patterns in the evaluation of cerebral white matter tracts altered by tumor. J Magn Reson Imaging. 2004;20:555–62. 7. Melhem ER, Mori S, Mukundan G, et al. Diffusion tensor MR imaging of the brain and white matter tractography. AJR Am J Roentgenol. 2002;178:3–16. 8. Laundre BJ, Jellison BJ, Badie B, et al. Diffusion tensor imaging of the corticospinal tract before and after mass resection as correlated with clinical motor findings: preliminary data. AJNR Am J Neuroradiol. 2005;26:791–6. 9. Inoue T, Ogasawara K, Beppu T, et al. Diffusion tensor imaging for preoperative evaluation of tumor grade in gliomas. Clin Neurol Neurosurg. 2005;107:174–80. 10. Jellison BJ, Field AS, Medow J, et al. Diffusion tensor imaging of cerebral white matter: a pictorial review of physics, fiber tract anatomy, and tumor imaging patterns. AJNR Am J Neuroradiol. 2004;25:356–69. 11. Lu S, Ahn D, Johnson G, et al. Peritumoral diffusion tensor imaging of high-grade gliomas and metastatic brain tumors. AJNR Am J Neuroradiol. 2003;24:937–41. 12. Tsuchiya K, Fujikawa A, Nakajima M, et al. Differentiation between solitary brain metastasis and high-grade glioma by diffusion tensor imaging. Br J Radiol. 2005;78:533–7. 13. Lu S, Ahn D, Johnson G, et al. Diffusion-tensor MR imaging of intracranial neoplasia and associated peritumoral edema: introduction of the tumor infiltration index. Radiology. 2004;232:221–8. 14. Sinha S, Bastin ME, Whittle IR, et al. Diffusion tensor MR imaging of high-grade cerebral gliomas. AJNR Am J Neuroradiol. 2002;23:520–7. 15. Stadlbauer A, Nimsky C, Buslei R, et al. Diffusion tensor imaging and optimized fiber tracking in glioma patients: histopathologic evaluation of tumor-invaded white matter structures. Neuroimage. 2007;34:949–56. 16. Price SJ, Jena R, Burnet NG, et al. Improved delineation of glioma margins and regions of infiltration with the use of diffusion tensor imaging: an image-guided biopsy study. AJNR Am J Neuroradiol. 2006;27:1969–74. 17. Puig J, Pedraza S, Blasco G, et al. Wallerian degeneration in the corticospinal tract evaluated by diffusion tensor imaging correlates with motor deficit 30 days after middle cerebral artery ischemic stroke. AJNR Am J Neuroradiol. 2010;31:1324–30. 18. Price SJ, Peña A, Burnet NG, et al. Tissue signature characterisation of diffusion tensor abnormalities in cerebral gliomas. Eur Radiol. 2004;14:1909–17. 19. Wang S, Kim S, Chawla S, et al. Differentiation between glioblastomas and solitary brain metastases using diffusion tensor imaging. Neuroimage. 2009;44:653–60. 1. Mestranda, Médica Radiologista da CDPI – Clínica de Diagnóstico Por Imagem, do Hospital Central do Exército e da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. 2. Médico Residente em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. 3. Doutorando, Médico Radiologista da CDPI – Clínica de Diagnóstico Por Imagem, Clínica Multi-Imagem e Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. 4. Médico Radiologista, Clinical Fellow em Neurorradiologia no Children’s Hospital of Pittsburgh, Pittsburgh, PA, EUA. 5. Médico Radiologista, Diretor da CDPI – Clínica de Diagnóstico Por Imagem e Clínica Multi-Imagem, Rio de Janeiro, RJ, Brasil. 6. Doutor, Professor Adjunto da Universidade Federal do Rio de Janeiro (UFRJ), Médico Radiologista da CDPI – Clínica de Diagnóstico Por Imagem e Clínica Multi-Imagem, Rio de Janeiro, RJ, Brasil. Endereço para correspondência: Dr. Emerson L. Gasparetto Avenida das Américas, 4666, sala 325, Barra da Tijuca Rio de Janeiro, RJ, Brasil, 22640-102 E-mail: egasparetto@gmail.com Recebido para publicação em 16/9/2010. Aceito, após revisão, em 16/11/2010. * Trabalho realizado na CDPI – Clínica de Diagnóstico Por Imagem e Clínica Multi-Imagem, Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554