Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 5 - Set. / Out. of 2010
Vol. 43 nº 5 - Set. / Out. of 2010
|
QUAL O SEU DIAGNÓSTICO?
|
|
|
|
|
Autho(rs): Marcelo Souto Nacif1; Radwa A.A. Noureldin2; Christopher T. Sibley3; Evrim B. Turkbey2; João A.C. Lima4; David A. Bluemke5 |
|
|
Mulher de 41 anos de idade com insuficiência cardíaca foi encaminhada para avaliação por ressonância magnética (RM).
Descrição das imagens Figura 1. Aquisição acoplada ao ECG em cine-RM no plano quatro câmaras (A,B) e realce tardio no plano quatro câmaras (C) e eixo curto (D). Sístole (A) e diástole (B) mostrando cardiomiopatia discretamente dilatada e regurgitação moderada da valva tricúspide. Nas imagens com realce tardio (C,D) não se observam fibroses ou cicatriz focal. 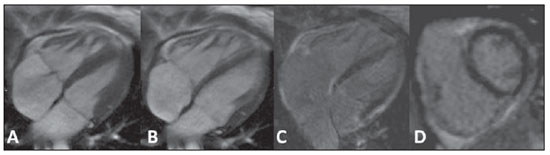 Figura 1. Aquisição acoplada ao ECG em cine-RM no plano quatro câmaras (A,B) e realce tardio no plano quatro câmaras (C) e eixo curto (D). Figura 2. Imagem de RM, aquisição acoplada ao ECG com a técnica tagging (A,B,D,E) e mapa T1 com look-locker (C,F). A análise da sequência com tagging (A,B,D,E) demonstrou reduzida fração de ejeção (FE = 27%). Os picos de strain circunferencial na parede medial na base, cavidade média e no ápice foram de –16%, –13% e –11%. A análise do mapa T1 (C,F) mostrou um tempo de T1 de 320 ms. Valor de referência: a faixa normal para (%) para pico de Ecc na parede medial é de –0,23 ± 0,04(1). Dados de voluntários saudáveis avaliados em nossos laboratórios mostraram que 492,2 ± 44,7 ms (média ± desviopadrão) é a faixa normal para a sequência look-locker 15 minutos após injeção de gadolínio(2,3). 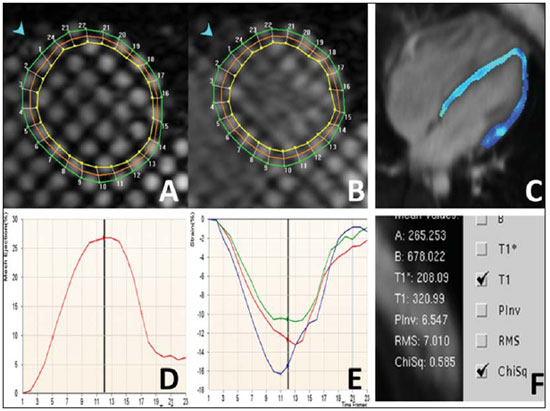 Figura 2. Imagem de RM, aquisição acoplada ao ECG com a técnica de tagging (A,B,D,E) e mapa T1 com look-locker (C,F). Diagnóstico: Insuficiência cardíaca com análise de strain e caracterização de tecido fibrótico (mapa T1). COMENTÁRIOS A insuficiência cardíaca (IC) está associada a significante morbidade e mortalidade, com elevado impacto econômico sobre os sistemas de saúde. Nos Estados Unidos, cerca de 5,7 milhões de pessoas, representando 2,5% da população americana acima dos 20 anos de idade, foram diagnosticadas com a doença. O envelhecimento da população e a melhora do prognóstico dos pacientes com eventos coronários agudos intensificam ainda mais a epidemia de IC. Consequentemente, dispêndios hospitalares com casos de IC têm aumentado nos Estados Unidos e no Brasil(4,5). O diagnóstico precoce e a identificação da etiologia subjacente da insuficiência cardíaca são de extrema importância. Embora, em geral, o tratamento seja o mesmo para muitos pacientes, as condições de alguns deles exigem um tratamento específico e a doença pode ser corrigida(4). A RM cardiovascular (RMC) é uma tecnologia que vem evoluindo rapidamente e vem sendo cada vez mais utilizada para a investigação por meio de imagens não invasivas na crescente população com insuficiência cardíaca(4). Os futuros desenvolvimentos nos cuidados de doenças cardíacas em estágios avançados, incluindo a terapia com células-tronco, tratamento com dispositivo para controlar a remodelagem e implante percutâneo de válvula, assim como a necessidade de se identificar doença cardíaca subclínica, provavelmente expandirão essa utilização(6). Imagem de RMC A avaliação da função ventricular global e regional por cine-RM em equilíbrio estável, de fibroses ou cicatrizes pela técnica de realce tardio, do volume e da velocidade de fluxo por contraste de fase, e também da morfologia por double ou triple IR com ou sem supressão de gordura são técnicas estabelecidas(7). A RMC com tagging é uma poderosa ferramenta diagnóstica não invasiva para avaliação quantitativa da função miocárdica sistólica e diastólica regional(8–10). A RMC com tagging é capaz de revelar componentes de função mecânica miocárdica regional que não tenham sido detectados anteriormente e, portanto, auxilia na detecção precoce e controle de uma ampla gama de doenças do miocárdio. Além disso, os contínuos avanços na tecnologia, técnicas de imagem e ferramentas analíticas utilizadas para implementar a RMC com a técnica de tagging trarão melhorias nas análises da função miocárdica regional(10). Os métodos de RMC podem ser úteis na quantificação de fibrose, mesmo em imagens com realce tardio em condições visuais negativas. O tempo de T1 é encurtado pela fibrose e o mapeamento em T1 é um marcador potencialmente quantificável da extensão e gravidade da fibrose quando validado por biópsia de amostras e aplicado em situações clínicas associadas à fibrose não sistêmica(6). O presente caso reflete, na prática, a importância do mapa T1 (Figura 3). O tempo de relaxamento T1 é baixo para uma aquisição realizada após 10 minutos da administração do gadolínio, demonstrando o aumento do espaço extracelular e a permanência do gadolínio, com um washout mais lento. 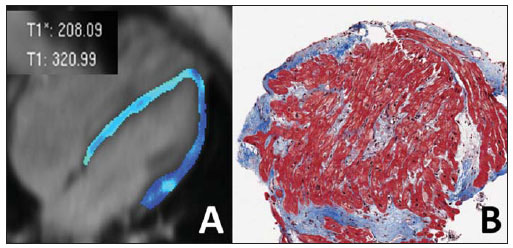 Figura 3. Mapa T1 (A) mostrando curto tempo de T1 (320 ms) para ventrículo esquerdo global na análise quantitativa, e a cor azul na análise qualitativa (verde corresponde a normal). Espécime de biópsia do mesmo paciente (B) mostrando substituição por fibrose e desarranjo dos miócitos cardíacos. Considerações importantes O sucesso na aplicação dessas técnicas será determinado não só pelo progresso metodológico, mas também pela integração dessas informações nos tratamentos clínicos. Isto exige não só uma validação clínica rigorosa em estudos prospectivos que cumpram critérios baseados em evidências clínicas, mas também o treinamento apropriado de especialistas cardiovasculares para um uso efetivo em termos de custo das tecnologias de imagem(6,7). Além desses benefícios clínicos, as novas tecnologias de imagem mudarão a investigação cardiovascular, fornecendo ferramentas únicas para avaliação quantitativa do processo da doença em modelos animais e humanos. Isto não só aumentará a nossa compreensão do processo da doença, mas também vai acelerar a pesquisa de novas drogas e sua disponibilização aos pacientes(11). REFERÊNCIAS 1. Moore CC, Lugo-Olivieri CH, McVeigh ER, et al. Three-dimensional systolic strain patterns in the normal human left ventricle: characterization with tagged MR imaging. Radiology. 2000;214: 453–66. 2. Nacif MS, Turkbey EB, Gai N, et al. Myocardial T1 mapping with MRI: what is necessary to know about relationship of clinically used look-locker to MOLLI sequences. Am Heart J. [in press]. 3. Gai N, Turkbey E, Nazarian S, et al. T1 mapping of the gadolinium enhanced myocardium: adjustment for factors affecting inter-patient comparison. Magn Reson Med. [in press]. 4. Karamitsos TD, Francis JM, Myerson S, et al. The role of cardiovascular magnetic resonance imaging in heart failure. J Am Coll Cardiol. 2009;54: 1407–24. 5. Moutinho MA, Colucci FA, Alcoforado V, et al. Heart failure with preserved ejection fraction and systolic dysfunction in the community. Arq Bras Cardiol. 2008;90:132–7. 6. Marwick TH, Schwaiger M. The future of cardiovascular imaging in the diagnosis and management of heart failure, part 1: tasks and tools. Circ Cardiovasc Imaging. 2008;1:58–69. 7. American College of Cardiology Foundation Task Force on Expert Consensus Documents, Hundley WG, Bluemke DA, et al. ACCF/ACR/AHA/NASCI/SCMR 2010 expert consensus document on cardiovascular magnetic resonance: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. Circulation. 2010;121:2462–508. 8. Han Y, Chan J, Haber I, et al. Circumferential myocardial strain in cardiomyopathy with and without left bundle branch block. J Cardiovasc Magn Reson. 2010;12:2. 9. Leong DP, De Pasquale CG, Selvanayagam JB. Heart failure with normal ejection fraction: the complementary roles of echocardiography and CMR imaging. J Am Coll Cardiol Img. 2010;3: 409–20. 10. Shehata ML, Cheng S, Osman NF, et al. Myocardial tissue tagging with cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2009;11:55. 11. Marwick TH, Schwaiger M. The future of cardiovascular imaging in the diagnosis and management of heart failure, part 2: clinical applications. Circ Cardiovasc Imaging. 2008;1:162–70. 1. Médico, Doutor, Professor do Departamento de Radiologia da Faculdade de Medicina da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil, Pós-graduando em Radiologia e Ciências de Imagem no Centro Clínico do National Institutes of Health (NIH), Bethesda, MD, EUA, Pós-graduando em Cardiologia na Johns Hopkins School of Medicine, Baltimore, MD, EUA. 2. Médico, Pós-graduando em Radiologia e Ciências de Imagem no Centro Clínico do National Institutes of Health (NIH), Bethesda, MD, EUA. 3. Médico, Membro do Corpo Clínico do Departamento de Radiologia e Ciências de Imagem do Centro Clínico do National Institutes of Health (NIH), Bethesda, MD, EUA. 4. Médico, Divisão de Cardiologia da Johns Hopkins University School of Medicine, Baltimore, MD, EUA. 5. Médico, Doutor, Diretor do Departamento de Radiologia e Ciências de Imagem do Centro Clínico do National Institutes of Health (NIH), National Institute of Biomedical Imaging and Bioengineering, Bethesda, MD, EUA. Endereço para correspondência: Dr. Marcelo Souto Nacif Cordell Avenue 4583 20814 Bethesda, MD, EUA E-mail: msnacif@yahoo.com.br Website: www.msnacif.med.br Trabalho realizado no Departamento de Radiologia e Diagnóstico por Imagem do Centro Clínico do National Institutes of Health (NIH), Bethesda, MD, EUA. |
|
GN1© Copyright 2025 - All rights reserved to Colégio Brasileiro de Radiologia e Diagnóstico por Imagem
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554