Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 4 - Jul. / Ago. of 2010
Vol. 43 nº 4 - Jul. / Ago. of 2010
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Marília Tavares Christóvão1; Tarcísio Passos Ribeiro de Campos2 |
|
|
Descritores: Próton terapia; Geant4; SISCODES; Radioterapia ocular; Prótons. |
|
|
Resumo: INTRODUÇÃO
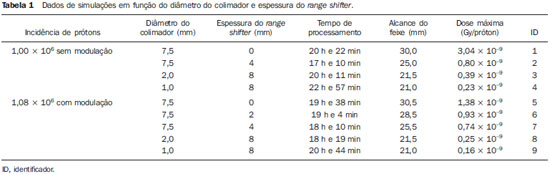
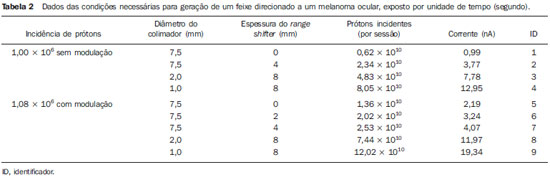
A utilização da radioterapia por feixe de prótons vem, cada vez mais, sendo executada por um número crescente de instituições internacionais. Numerosos estudos dosimétricos e clínicos vêm sendo elaborados, com o intuito de avaliar os benefícios desta técnica, principalmente no tratamento de pacientes com câncer. Segundo estatísticas do Particle Therapy Co-Operative Group (PTCOG), existem 30 instalações em operação, totalizando 67.097 pacientes tratados por prótons, sendo 18.055 pacientes com tumores oculares. Estão previstas 22 novas instalações até 2013, somando cerca de 70 novas salas de tratamento(1). Entre as principais aplicações da radioterapia por prótons está o controle de neoplasias oculares, principalmente melanoma uveal. Tais protocolos preservam estruturas sensíveis do olho (nervo óptico, córnea, lente, retina e cristalino), além de reduzir a taxa de enucleação. A preservação dos olhos atinge 90% a 95% dos casos, sendo que cerca de 50% dos pacientes mantêm visão útil após cinco anos(2). Melanoma é um tumor maligno que tem origem nas células de pigmentação. Nos olhos, o local de maior incidência é a úvea (coróide), sendo este o mais comum dos tumores oculares primários. A incidência anual da doença na Europa é de 2 a 8 casos/milhão(3) e nos EUA é de aproximadamente 4,3 casos/milhão(4). A avaliação das doses absorvidas em planejamentos em teleterapia ocular por prótons é de restrita investigação dos centros internacionais que oferecem tal tratamento. A avaliação das doses absorvidas nas estruturas oculares, quando expostas a feixes de prótons, não tem sido um tema corrente da literatura científica. Entretanto, durante qualquer avaliação clínica ou mesmo comparativa entre distintas modalidades terapêuticas, como braquiterapia por placas oftalmológicas e teleterapia por prótons, há a necessidade de conhecer a distribuição de doses absorvidas nas estruturas oculares. Neste sentido, o presente artigo aborda a dosimetria por feixes de prótons em modelo ocular. Serão aqui apresentados resultados de simulações computacionais provenientes de aplicações de terapia por prótons em instalação pré-existente. A radioterapia por prótons, na região ocular, é recomendada para a irradiação de tumores posicionados na região posterior à linha do equador ocular, com restrição às regiões onde se localizam estruturas sensíveis, como o nervo ótico, a glândula lacrimal e o cristalino. O código Geant4 (GEometry ANd Tracking) é de interesse, pois avalia o processo de transporte de partículas pesadas com carga na matéria, por exemplo, prótons ou íons pesados. O Geant4 Toolkit, pacote de software livre, é composto de ferramentas que podem ser utilizadas para simular a passagem de partículas pesadas com carga através da matéria, pelo método de Monte Carlo. O método Monte Carlo é amplamente reconhecido pela sua precisão na simulação de transporte de partículas nucleares em geometrias complexas, como modelos computacionais em voxels e instalações de irradiações. O presente artigo propõe avaliar os perfis de dose em profundidade e as distribuições espaciais de dose para protocolos de radioterapia ocular por prótons baseandose em uma típica instalação, a partir de simulações computacionais empregando o código Geant4 e o código SISCODES (Sistema Computacional para Dosimetria em Radioterapia) em um modelo de olho discretizado em voxels. MATERIAIS E MÉTODOS Protocolo e instalação de irradiação tomada como modelo As presentes simulações reproduzem um protocolo de teleterapia por próton, provido de dados de experimento real de uma instalação em operação, constituída de seus principais elementos, que aplica feixe de prótons para controle de doenças oculares. A instalação provém do Centro di AdroTerapia e Applicazioni Nucleari Avanzate (CATANA) do Istituto Nazionale di Fisica Nucleare - Laboratori Nazionali del Sud (INFN-LNS), Catania, Itália - CATANA/INFN-LNS(5). Ferramentas de software e gráficas de análise A ferramenta de software empregada é o código Geant4. Ferramentas interativas gráficas (OpenGL) e de análise de dados (AIDA e JAS3) foram também utilizadas no ambiente de simulação. Os dados resultantes das ferramentas de análise (AIDA e JAS3) são gerados durante a simulação, que apresentam o pico de Bragg e relevantes distribuições de doses oriundas do protocolo. Muitos dos parâmetros necessários para definição do protocolo foram obtidos de processos pré-existentes, carregados na biblioteca do Geant4, denominada hadrontherapy. As bibliotecas do Geant4 da aplicação hadrontherapy foram adaptadas para que as informações de saída do Geant4 fossem integradas ao modelo de olho do SISCODES para geração das curvas de isodoses. Os resultados das simulações foram integrados ao modelo de voxels da região ocular do SISCODES, onde se reproduz a distribuição espacial da dose em curva de isodose. O referido sistema computacional pertence ao grupo de pesquisa Núcleo de Radiações Ionizantes, do Curso de Pós-Graduação em Ciências e Técnicas Nucleares da Universidade Federal de Minas Gerais(6). Modelo ocular simulador Nas presentes simulações, foi empregado um fantoma ocular previamente descrito por Mourão e Campos(7). O modelo de voxel da região ocular é composto por 82 × 100 × 43 voxels. Este é um modelo não isotrópico que corresponde a um volume de 41 × 50 × 38,7 mm3, representando uma matriz cujo elemento de volume tem dimensões de 0,5 × 0,5 × 0,9 mm3, de acordo com Mourão e Campos(7). Esse modelo foi originado do projeto denominado Visible Man Project (VMP)(8), adaptado e importado para o SISCODES. O SISCODES possui módulos de criação de modelos volumétricos de voxels a partir de uma sequência de imagens de corte, e de tratamento de imagem, em que foi convertido para uma matriz de imagem em tons de cinza pelo módulo de tratamento de imagem do SISCODES(7). O modelo tridimensional da região ocular do SISCODES foi composto por voxels pela sobreposição de 43 cortes transversos do modelo VMP(7). No referido modelo, as principais estruturas da região ocular estão representadas, como bulbo ocular, músculos e nervo ótico. O material considerado para o transporte de prótons no fantoma foi a água; entretanto, as isodoses são plotadas em superposição ao material presente no fantoma ocular. Definição do modulador de energia, material absorvedor e colimador Em aplicações clínicas, diversos acessórios são utilizados para formar ou posicionar o feixe de prótons para cada tratamento, que devem ser corretamente configurados e verificados antes do tratamento, pelo sistema de planejamento(9). Na aplicação hadrontherapy do Geant4, ao longo da trajetória do feixe de prótons, são colocados dispositivos que adaptam a irradiação à forma e à distância do tumor e protegem os tecidos sadios adjacentes, a saber: - Material absorvedor (range shifter): degrada a energia do feixe primário para um valor determinado, consequentemente, definindo seu alcance máximo. - Modulador ou sistema de modulação do feixe, para espalhar a deposição de energia e abranger todo o tumor. O modulador, feito de polimetilmetacrilato (PMMA), garante a homogeneidade da distribuição de dose em profundidade, abrangendo todo o volume alvo, propagando o feixe na energia com a modulação determinada e produzindo uma curva denominada spread-out Bragg peak (SOBP). A curva SOBP é produzida pela rotação de um dispositivo (anel) formado por hélices de diferentes espessuras. Esse dispositivo efetua seu movimento rotacional no eixo paralelo ao eixo do feixe de prótons e esse movimento em graus pode ser redefinido a cada execução da simulação(10). - Colimador: define o formato e o diâmetro do feixe de prótons de entrada para moldar lateralmente a forma de deposição de energia. Variações na configuração de colimadores foram aplicadas nos experimentos executados. Energia do feixe de prótons - A dose de irradiação é liberada a uma profundidade que depende da energia incidente dos prótons. As simulações foram executadas configurando a energia do feixe das partículas primárias de prótons em 62,0 MeV, cujo alcance é em torno de 3 cm(10). Avaliação do pico de Bragg puro e modulado A curva de dose absorvida em função da espessura do absorvedor mostra um pico de Bragg típico, cuja largura depende da natureza da radiação, da energia espalhada (straggling) e do material do absorvedor. A região inicial da curva de dose versus profundidade de prótons, antes do pico de Bragg, apresenta uma distribuição de dose praticamente constante que representa cerca de 30% da dose máxima. O pico de Bragg puro é bastante estreito ao atingir o volume alvo. Sua ocorrência em profundidade é dependente da energia do feixe, isto é, se a energia cresce, o pico de Bragg surge mais profundamente no tecido. Para a irradiação de volumes alvos pode-se realizar variação controlada da energia de entrada do próton produzindo a superposição de múltiplos picos de Bragg. Pode-se também incidir um feixe monoenergético de próton e aumentar a espessura de um material absorvedor superposto à entrada do feixe. Esta superposição pode ser reproduzida pela rotação de um anel tipo hélice com variação contínua de espessura, cuja orientação de rotação define a desejada. Desta forma, é também gerado um espectro de dose modulado (curva SOBP) com um pico de Bragg ampliado formado por vários perfis de dose superpostos representativos de espessuras de absorvedores variados, recobrindo a largura do volume alvo. O pico de Bragg puro (sem modulação) será produzido para a energia incidente de prótons. Também serão produzidos os picos de Bragg modulados em função de espessuras específicas de material absorvedor, dito range shifter. Avaliação da dose absorvida em profundidade e perfis espaciais de taxa de dose Os resultados das simulações no Geant4 foram reproduzidos em curvas de distribuição de dose em profundidade. Em adição, o código Geant4 produz informações da energia depositada nas coordenadas X, Y e Z do voxel que foram transferidos ao SIS-CODES. A conversão dos dados de saída do Geant4 para o SISCODES é produzida por um programa específico que faz interface entre os dois ambientes, além de calcular a taxa de dose depositada em cada voxel através da razão entre a energia depositada em MeV pela massa específica de cada voxel convertida em unidades Gray por próton incidente (Gy/p). A taxa de dose total absorvida é avaliada pelo produto da dose por unidade de partícula incidente pela corrente de prótons aplicada, e a dose absorvida, pelo produto da taxa de dose pelo tempo de exposição. A dose absorvida calculada no isocentro do fantoma depende da combinação do sistema de modulação e da espessura do range shifter. A dose liberada pelo feixe de prótons é depositada em uma geometria em voxel de qualquer material e formato, que então pode ser convertida para o sistema SISCODES. Para o tratamento de melanoma uveal, a dose total aplicada é cerca de 60 Gy equivalente (GyE), liberada em quatro frações de 15 Gy(10). RESULTADOS Geração do pico de Bragg puro e modulado As Figuras 1 e 2 representam o pico de Bragg e o pico de Bragg modulado (curva SOBP), sem e com modulação do feixe, aplicando diâmetro do colimador final de 7,5 mm e sem material absorvedor, com incidências de 1,00 × 106 prótons e 1,08 × 106 prótons, respectivamente. Para a produção da curva SOBP, o anel de PMMA foi rotacionado com a resolução de um grau (1º), completando 360º no total, utilizando 3,00 × 103 prótons por grau, de acordo com a recomendação(9) para gerar uma dose representativa. 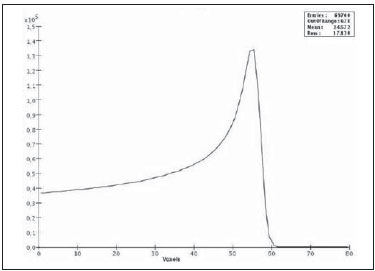 Figura 1. Pico de Bragg produzido sem modulação, tempo de processamento de 20 horas e 22 minutos. 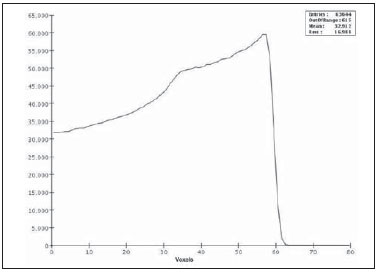 Figura 2. Curva SOBP com rotação 360º, tempo de processamento de 19 horas e 38 minutos. A Tabela 1 apresenta resultados de simulações, produzindo pico de Bragg e SOBP, sem e com modulação, processando 1,00 × 106 prótons e 1,08 × 106 prótons, respectivamente. Os parâmetros, diâmetro do colimador e espessura do material absorvedor (range shifter), foram introduzidos em diferentes configurações. Distribuição espacial de dose no modelo ocular As Figuras 3 a 6 representam as curvas de isodose no modelo de olho gerado no SISCODES, considerando alterações do posicionamento de entrada do feixe de prótons. Os percentuais de dose estão normalizados em função da dose máxima para uma entrada do feixe em posição, número de prótons incidente, modulador e absorvedor especificados. 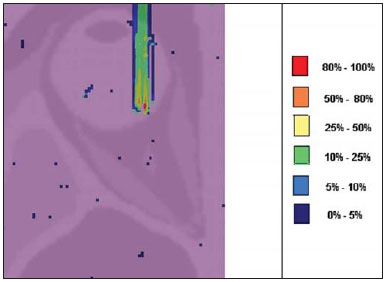 Figura 3. Curva de isodoses superpostas ao modelo de olho geradas no SISCODES referente à simulação executada sem modulação, diâmetro do colimador final de 1 mm e 8 mm de material absorvedor. Distância de 5 mm à direita do centro da lente do olho. 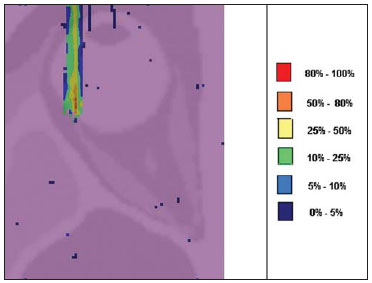 Figura 4. Curva de isodoses superpostas ao modelo de olho geradas no SISCODES referente à simulação executada sem modulação, diâmetro do colimador final de 1 mm e 8 mm de material absorvedor. Distância de 7 mm à esquerda do centro da lente do olho. 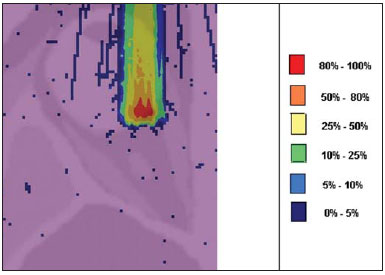 Figura 5. Curva de isodoses superpostas ao modelo de olho geradas no SISCODES referente à simulação executada sem modulação, diâmetro do colimador final de 3,5 mm e 6 mm de material absorvedor. Deslocamento de 5 a 7 mm à direita do centro da lente do olho. 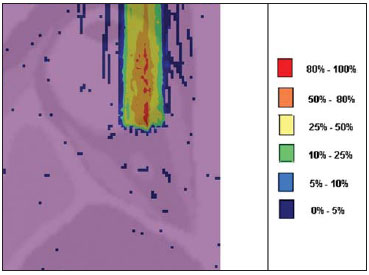 Figura 6. Curva de isodoses superpostas ao modelo de olho geradas no SISCODES referente à simulação executada com modulação, rotação de 360°, diâmetro do colimador final de 3,5 mm e 6,0 mm de material absorvedor. Deslocamento de 5 a 7 mm à direita do centro da lente do olho. Foram efetuadas simulações sem modulação, com feixes incidentes de 1,00 × 106 prótons, resultando em uma dose máxima depositada de 2,69 × 10-10 Gy/próton e 2,49 × 10-10 Gy/próton, em tempos de processamento de 18 horas e 15 minutos e 17 horas e 54 minutos, respectivamente. Estes resultados são apresentados nas Figuras 3 e 4. A Figura 5 apresenta uma situação sem modulação com 3,00 × 106 prótons, que resultou em uma dose máxima depositada de 3,80 × 10-10 Gy/próton, em tempo de processamento de 52 horas e 19 minutos. O resultado da simulação com modulação com 3,24 × 106 prótons incidentes, referente à Figura 6, resultou em dose máxima depositada de 2,06 × 10-10 Gy/próton, em tempo de processamento de 61 horas e 14 minutos. As simulações foram realizadas direcionando-se o feixe de entrada para posições em diferentes quadrantes oculares representados no modelo de voxel, a fim de cobrir alvos a serem irradiados em distintas posições. As Figuras 5 e 6 representam simulações realizadas com número de prótons três vezes superior às simulações apresentadas anteriormente, com a finalidade de melhorar a precisão da dose depositada. Além disso, o feixe foi deslocado durante a simulação em 5 a 7 mm à direita do centro da lente do olho, mantendo o mesmo diâmetro do colimador final e da espessura do material absorvedor, para as incidências de feixes sem e com modulação. DISCUSSÃO Observa-se que nas curvas resultantes de simulações sem e com modulação de feixe (Figuras 1 e 2) o alcance de ambas as curvas foi de 30 mm, sendo que a unidade expressa no eixo X está em voxels, cuja espessura é de 0,5 mm. O ápice da curva SOBP na Figura 2 abrangeu uma extensão de aproximadamente 14 mm quando se utilizou o sistema de modulação, comprovando que a aplicação do modulador amplia a distribuição de dose em extensão na direção do feixe. Na aplicação clínica, a modulação do feixe é utilizada para que o alvo neoplásico ou a região de interesse sejam cobertos com a maior deposição de dose. Para as simulações representadas nas Figuras 1 e 2, as doses máximas expressas em Gy/próton foram calculadas em 3,04 × 10-9 e 1,38 × 10-9, respectivamente. Para atingir a dose clínica para tratamento de melanoma ocular (60 Gy - quatro sessões de 15 Gy), considerando as condições das referidas simulações, seriam necessárias incidências de 6,17 × 109 prótons e 13,59 × 109 prótons, com intensidade de corrente de 0,992 nA e 2,188 nA, respectivamente, em cada sessão de tratamento. As seguintes considerações podem ser levantadas a partir dos dados das simulações representados pelos valores apresentados na Tabela 1: - As curvas SOBP geradas a partir do feixe modulado atingem uma maior profundidade e homogeneidade na distribuição de dose, em relação ao pico de Bragg, sem modulação. Para tratamentos clínicos são utilizados múltiplos feixes modulados para abranger todo o volume tumoral, em um processo de varredura com translação do posicionamento de entrada do feixe com alteração de absorvedor. - O alcance do feixe diminui à medida que a espessura do material absorvedor aumenta. A Tabela 1 apresenta o efeito provocado pela aplicação de variadas espessuras do material absorvedor na profundidade da dose. - Tanto o aumento da espessura do material absorvedor quanto a redução do diâmetro do colimador reduzem o valor da dose depositada, sendo necessário o aumento de prótons incidentes e/ou da corrente aplicada. Porém, as configurações desses parâmetros são de fundamental importância para a personalização do tratamento radioterápico, atendendo adequadamente as características do alvo a ser irradiado. - A redução do diâmetro do colimador em 50% (ID 3, 4, 8 e 9) resultou na redução da dose em 41% e 36%, com feixes sem e com modulação, respectivamente. As dimensões do volume alvo são consideradas na especificação das configurações do colimador. - A comparação entre a não aplicação do material absorvedor e sua utilização com 4 mm (ID 1, 2, 5 e 7) apresentou redução de dose em 74% e 46% para o feixe sem e com modulação, respectivamente. O alcance do feixe reduziu em 5 mm, cerca de 17% em relação ao feixe sem material absorvedor. Aplicando 0 mm, 2 mm e 4 mm de material absorvedor (ID 5, 6 e 7), em feixe modulado, a redução da dose foi de 20% e 33% para cada intervalo. A partir dos dados da Tabela 1, foram realizados cálculos das condições necessárias para atingir a dose clínica de 60 Gy (quatro sessões de 15 Gy) utilizada no tratamento de melanoma ocular. Esses parâmetros são o número de prótons a ser utilizados para a irradiação e a corrente (nA) necessária para a produção da referida dose, apresentados na Tabela 2. Os dados relevantes para aplicação clínica são referentes ao feixe modulado, em que se observa que o menor valor da corrente aplicada é cerca de 10%, do maior valor, em relação à aplicação do material absorvedor. Além disso, os valores de corrente estão compatíveis com valores reais praticados em aceleradores em operação(1). A unidade de tempo estabelecida na Tabela 2 é o segundo. Assim, nas simulações apresentadas, um especificado conjunto de voxels cujo volume recebe a dose absorvida superior a 80% é exposto por período unitário de um segundo. Este volume recoberto por uma única incidência é definido aqui como setor. O volume tumoral deve então ser recoberto com doses absorvidas pré-estabelecidas a partir da irradiação de múltiplos setores. Neste caso, várias incidências são necessárias, e assim o tempo do tratamento deve ser preconizado dependendo da geometria do tumor. Em relação à extração de prótons, a ICRU(11) define que aceleradores para próton terapia têm como requisito a extração de mais de 5,00 × 1010 prótons por segundo. Considerando que o tempo de uma sessão de radioterapia ocular varia de 30 a 60 segundos(11), os valores dos prótons incidentes transcritos na Tabela 2, para o feixe modulado simulado, são exequíveis quando aplicados em múltiplas frações recobrindo o tumor, requerido pela aplicação clínica. Considerando os resultados representados pelas Figuras 3 a 6, para atingir a dose clínica para tratamento de melanoma ocular (60 Gy - quatro sessões de 15 Gy) serão necessárias incidências de 6,98 × 1010 prótons, 7,54 × 1010 prótons, 4,93 × 1010 prótons e 9,09 × 109 prótons, com intensidade de corrente de 11,23 nA, 12,13 nA, 7,93 nA e 14,63 nA, respectivamente, em cada setor do tumor. Para a execução das simulações apresentadas neste artigo, foi utilizado um computador com processador Pentium Dual Core 2 GHz. No caso de aplicações clínicas, é recomendada a utilização de vários processadores paralelos, como um cluster de computadores, para redução do tempo de processamento de maneira viável para a referida aplicação. CONCLUSÃO Aspectos importantes relacionados ao sistema de planejamento radioterápico com feixe de prótons, como material absorvedor, modulação, tamanho do tumor, dimensões do colimador, energia incidente de prótons, corrente de prótons e a formação de curvas de isodose, que garantam cobertura homogênea do tumor, foram avaliados e configurados de acordo com as características do volume alvo de tratamento. Os resultados das simulações demonstraram isodoses típicas produzidas em protocolos de irradiação ocular por prótons. Tais resultados reforçam a necessidade de desenvolvimento de aplicações na área de planejamento radioterápico por prótons. A integração entre diferentes ambientes computacionais, como Geant4 e suas bibliotecas aplicativas com o SISCODES, amplia as condições de planejamento em teleterapia por prótons, agregando novas funcionalidades que contribuem para futuros estudos de simulações radioterápicas. REFERÊNCIAS 1. PTCOG: Particle Therapy Co-Operative Group. [acessado em 27 de março de 2010]. Disponível em: http://ptcog.web.psi.ch 2. Thornton AF, Fitzek M, Klein S, et al. Proton beam radiotherapy: a specialized treatment alternative. Commun Oncol. 2007;4:599-607. 3. Virgili G, Gatta G, Cicolallo L, et al. Incidence of uveal melanoma in Europe. Ophthalmology. 2007;114:2309-15. 4. Singh AD, Topham A. Incidence of uveal melanoma in the United States: 1973-1997. Ophthalmology. 2003;110:956-61. 5. Cirrone GAP, Cuttone G, Di Rosa F, et al. The Hadrontherapy Geant4 advanced example. In: 4th Workshop on Geant4 Bio-medical Developments, Geant4 Physics Validation; 2005 July 13-20; Genova, Italy. 6. Trindade BM. Desenvolvimento de sistema computacional para dosimetria em radioterapia por nêutrons e fótons baseado em método estocástico SISCODES [tese de mestrado]. Belo Horizonte, MG: Universidade Federal de Minas Gerais; 2004. 7. Mourão AP, Campos TPR. Development of a human eye model for ophthalmic brachytherapy dosimetry in heterogeneous medium at the uvea. In: Biomat 2007 - International Symposium on Mathematical and Computational Biology; 2007 Nov 24-29; Armação dos Búzios, RJ, Brasil. 8. National Library of Medicine. The visible human project. [acessado em 30 de março de 2010]. Disponível em: http://www.nlm.nih.gov/research/visible/visible_human.html 9. Slater JM, Miller DV, Slatter JW. Developing a clinical proton accelerator facility: consortium-assisted technology transfer. In: Particle Accelerator Conference, Accelerator Science and Technology., Conference Record of the 1991 IEEE; 1991 May 6-9; San Francisco, CA, USA. 10. Cirrone GAP, Cuttone G, Di Rosa F, et al. Monte Carlo based implementation of an energy modulation system for proton therapy. In: Nuclear Science Symposium Conference Record, 2004 IEEE; 2004 Oct 16-22. 11. International Commission on Radiation Units and Measurements. Clinical proton dosimetry part I: Beam production, beam delivery and measurement of absorbed dose. ICRU Report 59. Bethesda, MD: ICRU; 1998. 1. Doutoranda do Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Tecnologista do Centro de Desenvolvimento da Tecnologia Nuclear da Comissão Nacional de Energia Nuclear (CDTN/CNEN), Belo Horizonte, MG, Brasil 2. Doutor, Professor do Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil Trabalho realizado no Departamento de Engenharia Nuclear da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil Endereço para correspondência: Marília Tavares Christóvão Universidade Federal de Minas Gerais (UFMG), Departamento de Engenharia Nuclear Cidade Universitária da UFMG, Pampulha 31270-901. Belo Horizonte, MG, Brasil E-mail: marilia@cdtn.br Recebido para publicação em 15/4/2010 Aceito, após revisão, em 11/6/2010 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554