Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 38 nº 6 - Nov. / Dez. of 2005
Vol. 38 nº 6 - Nov. / Dez. of 2005
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Michael Jenwei Chen, Inês Nobuko Nishimoto, Paulo Eduardo Ribeiro Soares Novaes, Antônio Cássio de Assis Pellizzon, Robson Ferrigno, Ricardo César Fogaroli, Maria Aparecida Conte Maia, João Victor Salvajoli |
|
|
Descritores: Carcinoma, Endométrio, Radioterapia, Braquiterapia |
|
|
Resumo: IIIMédicos Titulares do Departamento de Radioterapia do Hospital do Câncer A.C. Camargo
INTRODUÇÃO O câncer de endométrio tem prevalência mundial bastante variada, nitidamente associada com níveis de desenvolvimento socioeconômico regionais. Excetuando-se o câncer de mama, em países mais industrializados, como os EUA, o câncer de endométrio responde, atualmente, pela principal causa de neoplasia maligna ginecológica(1,2). Em países com menor desenvolvimento socioeconômico, como é o caso do Brasil, o câncer de endométrio ocupa, por sua vez, a segunda colocação entre as causas de neoplasia maligna ginecológica, seguindo o câncer de colo uterino(3). O tratamento padrão consiste, inicialmente, na ressecção cirúrgica, com histerectomia total abdominal associada a salpingo-ooforectomia bilateral (HTA + SOB) e linfadenectomia seletiva. Nos estádios cirúrgicos mais avançados, por exemplo, FIGO IC (invasão de mais de 50% da parede miometrial) ou superior, e em pacientes com fatores adversos para a recidiva preconiza-se também o tratamento adjuvante sob a forma de radioterapia de feixe externo (RT) e/ou braquiterapia de fundo vaginal(4). Ainda há discussão, na literatura, acerca da melhor forma de adjuvância para o câncer de endométrio, e em alguns centros essas pacientes podem ser tratadas com o uso de RT ou braquiterapia de fundo vaginal exclusivas, ou mesmo com RT abdominal total, RT de região paraaórtica, ou com a adição de quimioterapia (QT), notadamente, para os casos de estádios mais avançados(5–9). No Brasil, no início dos anos 90, a introdução do uso de braquiterapia de alta taxa de dose (BATD) proporcionou nova perspectiva no uso de radiações para o tratamento adjuvante do câncer ginecológico. Comparada à braquiterapia de baixa taxa de dose, a BATD tem eficácia semelhante, mas com maior segurança, proteção radiológica e comodidade para o tratamento(10). No presente estudo, avaliamos, retrospectivamente, os resultados uni-institucionais do tratamento adjuvante do câncer de endométrio, com o uso de RT + BATD.
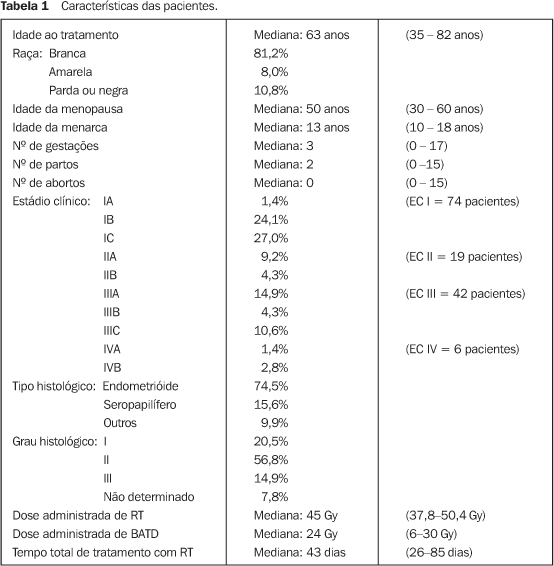
MATERIAIS E MÉTODOS Foram analisadas 141 pacientes tratadas entre janeiro de 1993 e janeiro de 2001 com RT + BATD, adjuvantes à cirurgia, após o diagnóstico inicial de câncer de endométrio. Os aspectos demográficos, anatomopatológicos e de técnicas de tratamento foram colhidos de prontuários médico-hospitalares, assim como as informações quanto ao seguimento clínico. Todas as pacientes foram tratadas inicialmente com cirurgia, que em 93,7% foi representada por HTA + SOB. A ausência de coleta de lavado peritoneal ou de realização de linfadenectomia/"sampling" linfonodal não foi considerada fator que excluísse as pacientes da análise. Nenhuma paciente incluída neste estudo foi tratada com RT ou BATD neoadjuvante ou com o uso de QT ou hormonioterapia (HT) como forma de adjuvância. Todos os casos foram estadiados segundo os critérios da FIGO de 1988(11). A RT adjuvante foi ministrada segundo os critérios: a) estádio clínico (EC) IB GII, IC ou superior; b) grau histológico III; c) histologia desfavorável (diferente do adenocarcinoma endometrióide típico); d) presença de embolização linfovascular; e) cirurgia "incompleta" (ausência de linfadenectomia/"sampling" linfonodal ou lavado peritoneal, ou presença de margem positiva). Para a RT da pelve foram usados fótons de megavoltagem de aceleradores lineares de 4 e 6 MeV. O volume de RT englobou o leito cirúrgico e as cadeias linfáticas ilíacas interna, externa e comum, através de quatro campos pélvicos com técnica convencional tipo "box", de acordo com protocolo institucional(12). As doses prescritas variaram de 45 a 50,4 Gy, em frações diárias de 180 cGy. Em relação à BATD, esta foi administrada utilizando-se sistema computadorizado de pós-carregamento ("afterloading") com fontes de irídio-192, com prescrição de dose na superfície dos aplicadores (parede vaginal). A dose final de braquiterapia variou de 20 a 24 Gy, em quatro frações semanais. A realização de "boost" em áreas de risco (por exemplo, em linfonodos paraaórticos, outras áreas linfonodais acometidas ou áreas de margens positivas) e possíveis alterações de prescrição de dose de RT ou BATD (por exemplo, redução de dose por fração por obesidade ou suspensão de tratamento por toxicidade) seguiram orientação médica e individualizada para cada paciente. Na rotina da avaliação de seguimento foram realizados anamnese, exame físico geral, exame ginecológico com citologia oncótica de cúpula vaginal, ultra-sonografia abdômino-pélvica e radiografia de tórax. Outros exames foram solicitados a critério médico, individualizados de acordo com queixas específicas da paciente. A faixa etária variou de 35 a 82 anos, com idade mediana de 63 anos (desvio-padrão [DP] = 9,3). Quanto ao estadiamento, observamos que 52,4% das pacientes se apresentavam com EC I, 13,5% com EC II, 29,8% com EC III e 4,3% com EC IV. Em termos demográficos, observamos predomínio da raça branca (81,2%), seguida da amarela (8,0%) (Tabela 1). A idade mediana da menarca foi de 13 anos (DP = 2,0) e da menopausa foi de 50 anos (DP = 5,3). O número mediano de gestações foi de 3 (DP = 2,8), partos 2 (DP = 2,6) e abortos 0 (DP = 1,0). Co-morbidades classicamente associadas ao câncer de endométrio, como hipertensão arterial sistêmica, diabetes mellitus, obesidade, além do uso de anticoncepcionais orais ou terapia de reposição hormonal, assim como tabagismo e etilismo, não foram avaliados com maiores detalhes no presente estudo.
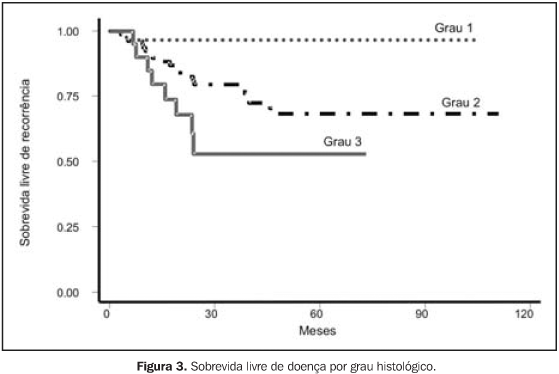
Na análise do tipo histológico, o adenocarcinoma endometrióide esteve presente em 74,5% dos casos e o carcinoma seropapilífero, em 15,6%. Outros tipos histológicos, como o carcinoma de células claras, o carcinoma mucinoso, o carcinoma escamoso e o carcinoma indiferenciado apresentaram baixa incidência nesta casuística, totalizando 9,9% dos casos. Quanto ao grau histológico, 20,5% dos casos foram de grau I, 56,8% foram de grau II e 14,9% dos casos foram de grau III. Do total de pacientes tratadas, 79,4% realizaram a RT em aceleradores lineares de 4 MeV e 20,6% em aceleradores lineares de 6 MeV. Dose mínima de 45 Gy em 25 frações de 180 cGy (ou 40 Gy em 25 frações de 160 cGy, para pacientes obesas) foi alcançada em 139 (98,5%) pacientes. Apenas quatro (2,8%) pacientes receberam menos de 20 Gy em BATD. O tempo mediano para realização de RT foi de 43 dias, variando de 26 a 85 dias (DP = 7,2). Em nove pacientes optou-se pela realização de "boost" (dose adicional) em área de acometimento linfonodal ou de margem positiva à cirurgia, segundo resultado de exame anatomopatológico. As doses medianas de "boost", prescritas individualmente, variaram de 5,4 Gy a 14 Gy, e em duas pacientes realizou-se também RT em região paraaórtica, com dose de 40 Gy. Quatro pacientes foram submetidas a QT adjuvante após o término do curso de RT, e seis, a HT.
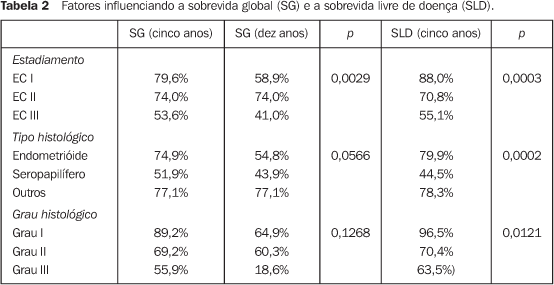
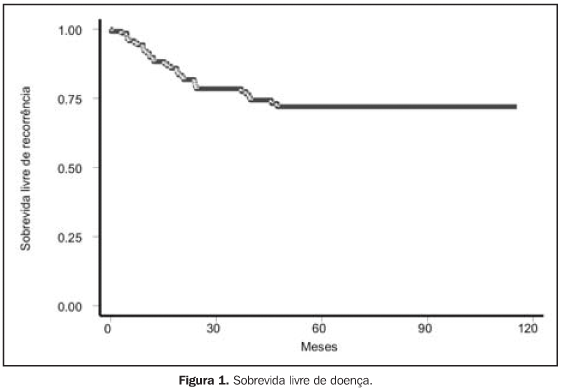
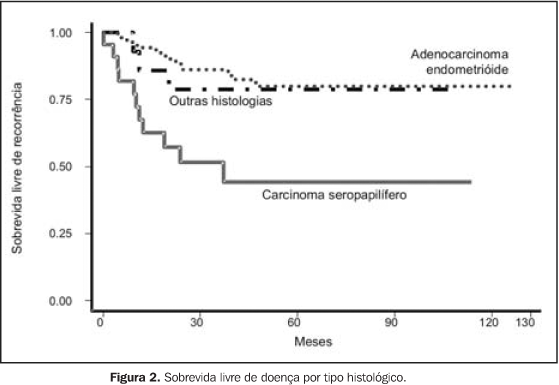
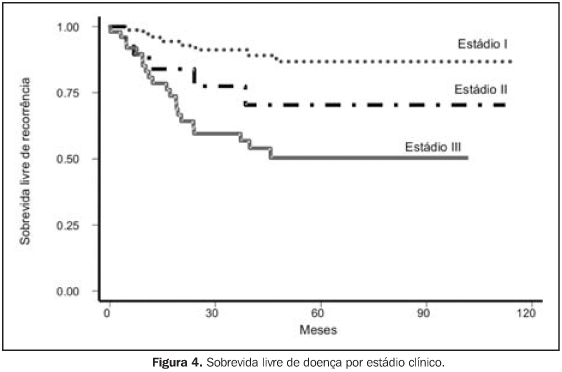
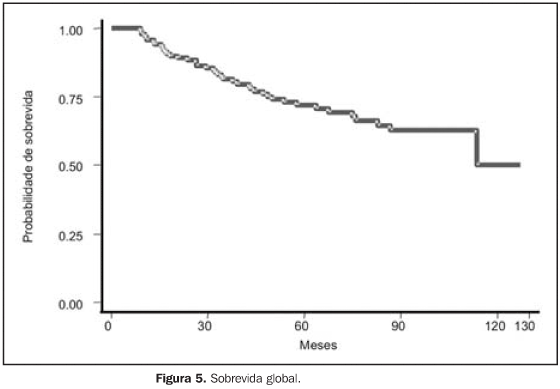
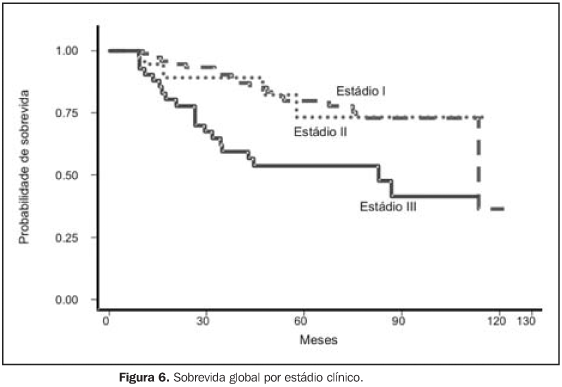
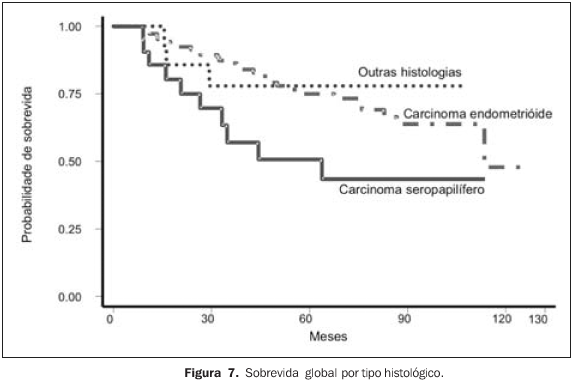
RESULTADOS Para a análise de falha terapêutica, os locais de recorrência foram classificados em: recorrência loco-regional (pélvica, em cúpula vaginal ou vagina) e a distância (intra-abdominal, óssea, pulmonar, etc.). Os efeitos tóxicos do tratamento adjuvante foram avaliados através de escalas de morbidades aguda e tardia, elaboradas pelo Radiation Therapy Oncology Group (RTOG)(13). Na análise estatística, usamos o método atuarial de Kaplan-Meier para cálculo das probabilidades de sobrevida global e livre de recorrência(14). A comparação entre a distribuição de sobrevida dos grupos foi feita através dos testes de log-rank e qui-quadrado(15), considerando valores de significância de 95% ou p < 0,05. O seguimento mediano foi de 53,7 meses, variando de 6,2 a 127,1 meses, com perda de 13,5%. Quanto ao estadiamento clínico, observamos sobrevida global (SG) em cinco anos de 79,6%, 74,0%, 53,6% e 100,0% para os estádios I, II, III e IV, respectivamente (p = 0,0029). A SG atuarial em dez anos foi de 58,9% (EC I), 74,0% (EC II), 41,0% (EC III) e 50,0% (EC IV). A sobrevida livre de doença (SLD) em cinco anos, para o grupo, foi de 88,0% (EC I), 70,8% (EC II), 55,1% (EC III) e 50,0% (EC IV) (p = 0,0003). Em dez anos, a SLD atuarial não mostrou alterações, sendo observado que após 48 meses (quatro anos) de seguimento não houve mais a ocorrência de recidiva pélvica ou a distância. Para todo o grupo, a SG foi de 71,8% e 54,9%, em cinco e dez anos, respectivamente, e a SLD foi de 74,4% em cinco anos. Na análise dos fatores prognósticos, ainda observamos que houve redução da SLD em cinco anos, de acordo com: — tipo histológico: 44,5% para carcinoma seropapilífero × 79,9% para adenocarcinoma endometrióide × 78,3% para outras histologias (carcinoma de células claras, carcinoma mucinoso e outros) (p = 0,0002);
Apesar de observarmos que o grau histológico não se mostrou fator que influenciasse a SG, o tipo histológico carcinoma seropapilífero, comparado com outras histologias, se mostrou fator prognóstico negativo por redução da SG, com significância marginal (p = 0,0566). Outros fatores também estudados, como idade (maior ou menor que 50 anos), raça, dose total de RT administrada (maior ou menor que 45 Gy) e tempo total de RT (maior ou menor que 50 dias) não demonstraram influência significativa na SG, ou mesmo na SLD, das pacientes deste estudo. Em termos de recorrência, com a administração de RT + BATD adjuvantes, das 141 pacientes tratadas, 108 (76,6%) permanecem sem evidência de recidiva. Das 33 pacientes em que houve recorrência, em apenas 13 (9,2%) ocorreu recidiva loco-regional (pelve, vagina ou cúpula vaginal). Nas pacientes com EC I, das oito pacientes que apresentaram recidivas, em duas ocorreu loco-regionalmente de forma isolada, em duas combinada a recorrência a distancia e em quatro somente ocorreu a distância. Nas pacientes com EC II, EC III e EC IV, das 25 pacientes que apresentaram recidivas, em nove (36,0%) ocorreu loco-regionalmente, em 17 ocorreu a distância (68,0%) e uma paciente apresentou recidiva em ambos os sítios.
Os sítios de recorrência a distância observados foram os seguintes: abdome e retroperitônio (33,3%), pulmão (33,3%), fígado (9,1%), ossos (9,1%) e sistema nervoso central (3,0%).
DISCUSSÃO O paradigma do tratamento do câncer de endométrio é a ressecção cirúrgica. A HTA + SOB prova-se tratamento não apenas eficaz para este tipo de tumor ginecológico, mas também é recomendado pela FIGO como método de estadiamento, visto que a análise pós-cirúrgica permite definição mais realista da extensão da doença, necessidade de terapêuticas complementares e das possibilidades de sobrevida(16). Ainda há controvérsia quanto à melhor forma de tratamento cirúrgico inicial, pois a recomendação clássica de HTA + SOB + "sampling" linfonodal (paraaórtico e pélvico) + lavado peritoneal diagnóstico é raramente seguida(17). Persistem dúvidas acerca da extensão necessária da HTA + SOB, notadamente em estádios iniciais(18), e diversos estudos têm procurado alternativas, especialmente para pacientes com EC IA e IB (GOG-LAP 2, MRC-ASTEC). No campo da adjuvância, estudos retrospectivos e prospectivos estabeleceram o papel da radioterapia como complemento ao tratamento cirúrgico inicial(19–21). No estudo do PORTEC(20), os índices de recidiva loco-regional reduziram-se de 14% para 4% com o uso de RT, e no GOG-99(21), a SLD em dois anos foi de 88% vs. 96% para o grupo tratado com RT. Basicamente, estes dados indicam a RT (RT pélvica exclusiva, RT + braquiterapia, braquiterapia exclusiva) como método adjuvante na redução dos índices de recorrência loco-regional, sem, entretanto, afetar de maneira significativa a SG das pacientes. A razão para o uso adjuvante das radiações baseia-se no fato de que há vantagem no aumento da SLD, proporcionado pelo maior controle pélvico loco-regional, reduzindo-se, durante o período de seguimento, o risco dessas pacientes eventualmente virem a necessitar de resgate com cirurgia e/ou RT, por recorrência, em geral, de mais difícil controle. Nessa idéia, na maioria dos estudos não se preconiza o uso de adjuvância quando há "baixo risco" de recidiva loco-regional, mas sim nos estádios com maior risco de recidiva.
Outro fato atestado na literatura é que, na maioria das vezes, a recidiva loco-regional ocorre em cúpula ou parede vaginal(20,21). A relação direta entre controle local e dose da radiação administrada sugerida para o controle do câncer justifica, por sua vez, o uso de braquiterapia intracavitária, quer exclusiva, quer concomitante à RT. Numa meta-análise publicada por Pearcey e Petereit em 2000(22) , observaram-se excelentes taxas de controle pélvico (de quase 100%) com o uso de braquiterapia intracavitária exclusiva adjuvante, em pacientes de "baixo risco". Comparando-se as diversas técnicas de braquiterapia (alta taxa de dose vs. baixa taxa de dose, cilindros vs. ovóides)(10), apesar de não haver estudo randomizado na literatura que estabeleça qual a melhor, a BATD vem paulatinamente substituindo a braquiterapia de baixa taxa de dose, considerando-se sua aparente equivalência em termos terapêuticos. No Brasil, a introdução da BATD em substituição à baixa taxa de dose se deu no início dos anos 90, com a aquisição dos primeiros sistemas computadorizados. Em nossa instituição, a alta taxa de dose substituiu a baixa taxa de dose em praticamente 100% das neoplasias malignas com indicação de braquiterapia. Acompanhando tendências internacionais(23), a utilização de "boost" com BATD em concomitância ao tratamento adjuvante com RT traz os benefícios do escalonamento de dose com a BATD e de sua baixa morbidade. Aalders et al.(19) compararam o uso de braquiterapia adjuvante associada ou não à RT para pacientes submetidas a HTA + SOB por carcinoma de endométrio, observando redução importante (1,9% vs. 6,9%) nos índices de recorrência loco-regional com o binômio RT + BATD. Entretanto, observaram maiores índices de recorrência a distância (9,9% vs. 5,4%) e que o benefício da adição de RT + BATD (vs. BATD) pôde ser observado em maior magnitude nos estádios IC e grau histológico III. Em nossa casuística, os resultados desta associação se mostraram excelentes, permitindo índices de controle pélvico, SLD e SG comparáveis aos da literatura. Alguns dados, porém, devem ser ressaltados. Fatores demográficos e anatomopatológicos reconhecidamente associados ao pior prognóstico no câncer de endométrio(24) não demonstraram, neste estudo, influir de maneira significativa na SG das pacientes (com valores de p não significativos). Idade (maior ou menor que 50 anos), raça (branca, amarela e negra) e tempo total de tratamento (maior ou menor que 50 dias) não influíram na SLD e SG. Tipo histológico e grau histológico se mostraram fatores de mau prognóstico para SLD, mas grau histológico não influiu na SG, apesar de tipo histológico tê-lo feito, entretanto, com significância marginal. Acreditamos que, com a maturação dos dados coletados, haja uma tendência para que os resultados acompanhem o observado na literatura médica. Efeitos colaterais e influência de co-morbidades Foram observadas taxas de complicações agudas em 17,8%, seguindo os critérios do RTOG (Tabela 3). Os relatos de toxicidade ocorrida durante o seguimento das pacientes puderam ser classificados conforme o sítio anatômico (por exemplo, dermatite, enterite, mielite) e a gravidade. Predominou, na análise, toxicidade moderada (graus II e III), havendo também a descrição de eventos qualificados como toxicidade grave (graus IV e V). Observamos, neste estudo, apenas um caso de mielite aguda (requerendo suspensão de tratamento), um caso de dermatite actínica grau II aguda. Ocorreram um caso de cistite actínica e dois casos de retite leves, que necessitaram apenas de acompanhamento médico. Houve também relato de 22 casos (15,6%) de alterações de trato gastrintestinal (enterite), que necessitaram algum tipo de intervenção terapêutica clínica ou cirúrgica. Esta incidência, apesar de relativamente alta, é compatível com a literatura médica(20,21,25), devendo ser analisada com ressalvas: pacientes portadoras de câncer de endométrio em geral manifestam outras co-morbidades que aumentam os riscos de complicações terapêuticas, o que pode também afetar as taxas de sobrevida. Não foi possível, no presente estudo, diferenciar as complicações relatadas como sendo originárias do tratamento cirúrgico ou exclusivamente da radioterapia. Observamos que em seis pacientes os quadros de alterações intestinais evoluíram com o desenvolvimento de fístulas e suboclusão, sendo que duas dessas pacientes vieram a falecer. Outro fato também observado é que morte por outras causas que não diretamente relacionadas à recorrência do câncer de endométrio (infarto do miocárdio, acidente vascular cerebral, segundo tumor primário associado, etc.) ocorreu em 9,9% das pacientes, contribuindo de forma negativa para a redução da SG.
CONCLUSÃO Os dados apresentados neste estudo ressaltam o papel que a RT exerce no controle loco-regional do câncer de endométrio, possibilitando excelentes taxas de cura nos estádios iniciais. A adição de BATD à RT adjuvante é método seguro e eficaz, sem adicionar morbidade excessiva ao tratamento das pacientes portadoras de câncer de endométrio. Também observamos que, para os estádios mais avançados, a falha terapêutica tende a ser a distância, sugerindo a necessidade de complementação terapêutica sistêmica, com introdução de novas modalidades, como o uso de agentes quimioterápicos. Estudos estão em andamento (GOG-9907 e GOG-0122) e outros já publicados têm explorado esta vertente(26).
REFERÊNCIAS 1.Landis SH, Murray T, Bolden S, Wingo PA. Cancer statistics, 1999. CA Cancer J Clin 1999;49:8–31, 1. [ ] 2.Wingo PA, Cardinez CJ, Landis SH, et al. Long-term trends in cancer mortality in the United States, 1930-1998. Cancer 2003;97(12 Suppl):3133–3275. [ ] 3.Fundação Oncocentro de São Paulo (FOSP). Mortalidade por câncer no Estado de São Paulo no biênio 2001–2002. Disponível em: http://www.fosp. saude.sp.gov.br/html/fr_dados.html. Acessado em 5/2/2004. [ ] 4.Practice guidelines: uterine corpus-endometrial cancer. Society of Gynecologic Oncologists Medical Practice Committee. Oncology (Williston Park) 1998;12:122–126. [ ] 5.Stewart KD, Martinez AA, Weiner S, et al. Ten-year outcome including patterns of failure and toxicity for adjuvant whole abdominopelvic irradiation in high-risk and poor histologic feature patients with endometrial carcinoma. Int J Radiat Oncol Biol Phys 2002;54:527–535. [ ] 6.Touboul E, Belkacemi Y, Buffat L, et al. Adenocarcinoma of the endometrium treated with combined irradiation and surgery: study of 437 patients. Int J Radiat Oncol Biol Phys 2001;50:81–97. [ ] 7.Ng TY, Perrin LC, Nicklin JL, Cheuk R, Crandon AJ. Local recurrence in high-risk node-negative stage I endometrial carcinoma treated with postoperative vaginal vault brachytherapy. Gynecol Oncol 2000;79:490–494. [ ] 8.Bafaloukos D, Aravantinos G, Samonis G, et al. Carboplatin, methotrexate and 5-fluorouracil in combination with medroxyprogesterone acetate (JMF-M) in the treatment of advanced or recurrent endometrial carcinoma: a Hellenic cooperative oncology group study. Oncology 1999;56:198–201. [ ] 9.Hicks ML, Piver MS, Puretz JL, et al. Survival in patients with paraaortic lymph node metastases from endometrial adenocarcinoma clinically limited to the uterus. Int J Radiat Oncol Biol Phys 1993;26:607–611. [ ] 10.Martinez AA, Edmundson GK. Brachytherapy. In: Gunderson LL, Tepper JE, editors. Clinical radiation oncology. Philadelphia: Churchill Livingstone, 2000;184–203. [ ] 11.International Federation of Gynecology and Obstetrics (FIGO) Stages – 1988 revision. Gynecol Oncol 1989;35:125–127. [ ] 12.Novaes PERS, Cruz EA. Tumores do endométrio. In: Pellizzon ACA, Salvajoli JV, Maia MAC, Novaes PERS, Fogaroli RC, Ferrigno R. Rotinas e condutas em radioterapia. São Paulo: Lemar, 2002: 95–100. [ ] 13.Radiation Therapy Oncology Group. Acute radiation morbidity scoring criteria. Disponível em: http://www.rtog.org/members/toxicity/acute.html. Acessado em 5/2/2004. [ ] 14.Kaplan EL, Meier P. Non-parametric estimation from incomplete observations. Am Stat Assoc 1958;53:457–481. [ ] 15.Mantel N, Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst 1959;22:719–748. [ ] 16.Creasman WT, Odicino F, Maisonneuve P, et al. Carcinoma of the corpus uteri. J Epidemiol Biostat 2001;6:47–86. [ ] 17.Barnes MN, Kilgore LC. Complete surgical staging of early endometrial adenocarcinoma: optimizing patient outcomes. Semin Radiat Oncol 2000; 10:3–7. [ ] 18.Holub Z, Bartos P, Dorr A, Eim J, Jabor A, Kliment L Jr. The role of laparoscopic hysterectomy and lymph node dissection in treatment of endometrial cancer. Eur J Gynaecol Oncol 1999;20:268–271. [ ] 19.Aalders J, Abeler V, Kolstad P, Onsrud M. Postoperative external irradiation and prognostic parameters in stage I endometrial carcinoma: clinical and histopathologic study of 540 patients. Obstet Gynecol 1980;56:419–427. [ ] 20.Creutzberg CL, van Putten WL, Koper PC, et al. Surgery and postoperative radiotherapy versus surgery alone for patients with stage-1 endometrial carcinoma: multicentre randomised trial. PORTEC Study Group. Post Operative Radiation Therapy in Endometrial Carcinoma. Lancet 2000;355(9213): 1404–1411. [ ] 21.Roberts J, Brunetto V, Keys H, et al. A phase III randomised study of surgery vs. surgery plus adjuvant radiation therapy in intermediate risk endometrial adenocarcinoma (GOG #99). Annual Meeting of the Society of Gynecologic Oncologist, 1998;70. [ ] 22.Pearcey RG, Petereit DG. Post-operative high dose rate brachytherapy in patients with low to intermediate risk endometrial cancer. Radiother Oncol 2000;56:17–22. [ ] 23.Nag S, Erickson B, Parikh S, Gupta N, Varia M, Glasgow G. The American Brachytherapy Society recommendations for high-dose-rate brachytherapy for carcinoma of the endometrium. Int J Radiat Oncol Biol Phys 2000;48:779–790. [ ] 24.Greven KM. Tailoring radiation to the extent of disease for uterine-confined endometrial cancer. Semin Radiat Oncol 2000;10:29_35. [ ] 25.Bye A, Trope C, Loge JH, Hjermstad M, Kaasa S. Health-related quality of life and occurrence of intestinal side effects after pelvic radiotherapy – evaluation of long-term effects of diagnosis and treatment. Acta Oncol 2000;39:173–180. [ ] 26.Randall ME, Spirtos NM, Dvoretsky P. Whole abdominal radiotherapy versus combination chemotherapy with doxorubicin and cisplatin in advanced endometrial carcinoma (phase III): Gynecologic Oncology Group Study No. 122. J Natl Cancer Inst Monogr 1995;(19):13–15. [ ]
Recebido para publicação em 28/10/2004. Aceito, após revisão, em 15/3/2005.
* Trabalho realizado no Departamento de Radioterapia do Hospital do Câncer A.C. Camargo, São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554