Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 38 nº 4 - Jul. / Ago. of 2005
Vol. 38 nº 4 - Jul. / Ago. of 2005
|
RELATO DE CASO
|
|
|
|
|
Autho(rs): Pablo Rydz Pinheiro Santana, Klaus Loureiro Irion, Dante Luiz Escuissato, Nelson da Silva Porto, Gilberto Bueno Fisher, Helena Terezinha Mocelin, Edson Marchiori, Sérgio Mazer |
|
|
Descritores: Alça da artéria pulmonar, Artéria pulmonar esquerda anômala, Estenose traqueal, Anel vascular, Variante da artéria pulmonar esquerda |
|
|
Resumo: IIIProfessor Assistente da Disciplina de Radiologia Médica da Universidade Federal do Paraná (UFPR), Médico Radiologista da Clínica DAPI – PR
INTRODUÇÃO A alça da artéria pulmonar ("pulmonary artery sling"), também chamada de artéria pulmonar esquerda anômala, é uma anormalidade congênita, primeiramente descrita em 1897(1). Esta anomalia é um dos tipos menos comuns, porém o mais letal dentre os anéis vasculares. Desde a sua primeira descrição, pouco mais de 150 casos foram relatados na literatura. Porém, num relato recente de uma série de casos, Döhlemann et al.(2) referem que 10 dos 13 pacientes com esta anomalia haviam sido diagnosticados nos últimos anos do estudo, sugerindo que ela possa ser não tão rara quanto se pensava. A alça da artéria pulmonar é formada por uma artéria pulmonar esquerda aberrante que, em vez de originar-se do tronco pulmonar, emerge da parede posterior da artéria pulmonar direita de trajeto normal. Nesta condição, a artéria pulmonar esquerda aberrante tem sua emergência mais à direita no mediastino, fazendo uma alça para retornar ao hemitórax esquerdo, atravessando o mediastino entre a traquéia e o esôfago. Esta alça, ou pinça vascular, determina compressão da parede anterior do esôfago e da parede direita e dorsal da traquéia, geralmente determinando importante obstrução da via aérea. Embora a maioria dos pacientes apresente quadro de obstrução respiratória grave, casos assintomáticos ou oligossintomáticos têm sido descritos(3). Alça da artéria pulmonar está comumente associada a anomalias cardiovasculares e da árvore traqueobrônquica(4,5). Neste trabalho são descritos os casos de dois pacientes com a referida anomalia, em que o diagnóstico pôde ser estabelecido por métodos de imagem não invasivos: num dos casos por tomografia computadorizada (TC), sem reforço de meio de contraste, porém com reconstruções tridimensionais da via aérea (TC3D), e no outro por exame de imagem por ressonância magnética (RM), também com técnica de reconstrução tridimensional (RM3D). Os dois casos ilustram os extremos da apresentação clínica e da associação com outras anomalias.
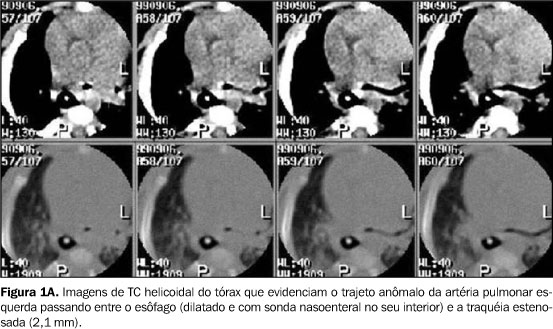
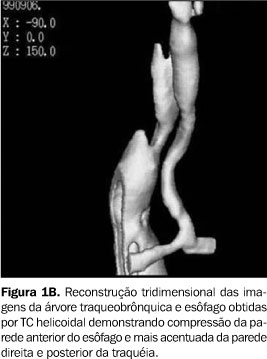
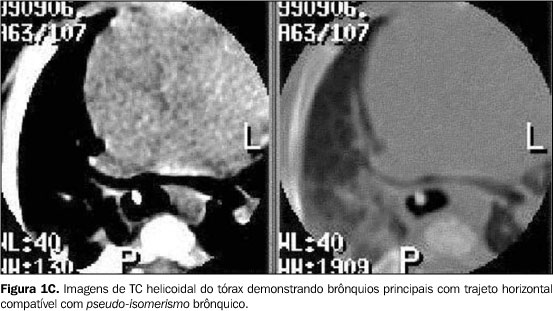
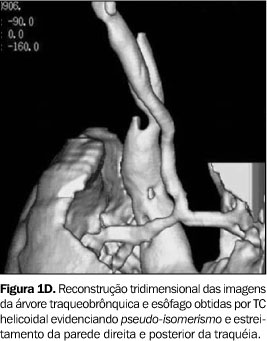
RELATO DOS CASOS Caso 1 Lactente do sexo feminino, com dois meses de idade, foi transferida à unidade de terapia intensiva pediátrica devido a distrição respiratória grave e broncoespasmo, sendo tratada com corticóides e broncodilatadores, sem alívio dos sintomas. Apresentava ainda estridor inspiratório e relato de episódios recorrentes de aspiração. O radiograma convencional do tórax mostrava importante componente atelectásico do pulmão direito. A paciente necessitou intubação e ventilação mecânica por dez dias. Durante este período, fez uso de antibióticos, aminas vasoativas e transfusão sanguínea. Broncoscopia demonstrou estenose traqueal 3 cm abaixo das cordas vocais, impedindo a progressão do tubo. Dada a gravidade do quadro clínico, optou-se por realizar a TC sem indução anestésica e sem o uso de meio de contraste endovenoso. Para viabilizar a realização do exame sem anestesia, foi prescrito jejum de quatro horas, seguido de aleitamento na ante-sala do equipamento de TC, onde se aguardou que a lactente dormisse induzida pela alimentação. Alguns cortes de TC de alta resolução (TCAR) precederam uma varredura por TC helicoidal, realizada com a paciente dormindo, porém respirando normalmente, o que não impediu o diagnóstico. Esse exame mostrou redução de mais de 50% da luz traqueal, em toda a sua extensão intratorácica. Reconstruções tridimensionais foram realizadas pela técnica de reconstrução de superfície ("surface rendering"), com seleção de limiares correspondentes às densidades da interface ar-partes moles (–750 UH a –250 UH), demonstrando a superfície interna da árvore traqueobrônquica e as porções do esôfago quando com conteúdo gasoso. A ausência de reforço de meio de contraste impediu uma boa demonstração das artérias pulmonares (Figura 1A) no mediastino, porém, as reconstruções tridimensionais permitiram identificar a compressão nas paredes direita e posterior da traquéia, bem como da parede anterior do esôfago (Figura 1B). Adicionalmente, estas reconstruções também forneceram dados para definir com mais segurança a presença de pseudo-isomerismo brônquico (Figuras 1C e 1D), no qual os brônquios direito e esquerdo originam-se da carina num ângulo de 90° (em relação ao plano axial). Também demonstraram com maior clareza alterações compatíveis com colapsabilidade traqueal ou traqueomalácia. Adicionalmente, a paciente tinha uma artéria subclávia direita aberrante, que também foi demonstrada nas imagens 3D, pela compressão da parede posterior do esôfago. A correção cirúrgica não foi possível e a paciente foi a óbito precocemente após o diagnóstico.
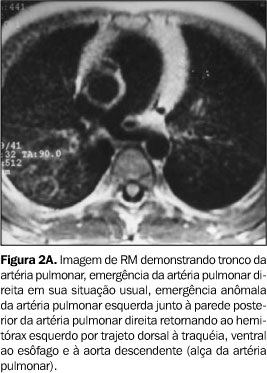
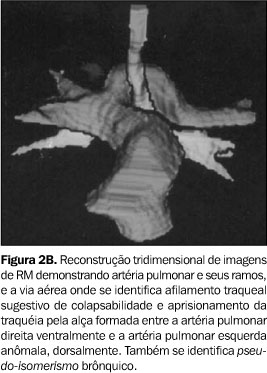
Caso 2 Criança de cinco anos de idade, sexo masculino, oligossintomática, que apresentava estridor respiratório ao exame clínico. Foi realizada broncoscopia que sugeriu área focal de traqueomalácia no segmento distal da traquéia. TC convencional do tórax, com reforço de meio de contraste, demonstrou área de estenose do segmento distal da traquéia e imagem adjacente com densidade de partes moles. Suspeitou-se da presença de anel vascular. Realizou-se RM do tórax em aparelho Elscint Prestige 2T com reconstrução 3D, confirmando-se a presença de anomalia de emergência e trajeto da artéria pulmonar esquerda (Figuras 2A e 2B).
DISCUSSÃO A alteração embriológica que resulta no desenvolvimento da alça da artéria pulmonar não é completamente entendida. Alguns autores acreditam que a formação da artéria pulmonar esquerda anômala resulta do atraso no desenvolvimento da artéria pulmonar esquerda e da árvore traqueobrônquica(6,7). Outros sugerem que a malformação seja conseqüência de um defeito no desenvolvimento do sexto arco aórtico esquerdo, limitado à sua porção ventral. Esta hipótese baseia-se no fato de que o ducto arterioso, que se origina da porção dorsal do sexto arco aórtico esquerdo, se desenvolve normalmente na maioria dos casos(5). Outra corrente considera que a artéria pulmonar esquerda anômala seja um ramo da artéria pulmonar direita, que estabelece sua trajetória para o pulmão esquerdo em decorrência da falta de suprimento arterial(8,9). Clinicamente, a maioria dos pacientes apresenta distrição respiratória progressiva, mas a gravidade do quadro depende da extensão da estenose traqueobrônquica. A média de idade dos pacientes quando os sintomas têm início é de dois meses(10). Entretanto, Döhlemann et al.(2) relatam que cerca da metade dos casos apresentam-se sintomáticos já ao nascimento. Outros sintomas comuns são cianose e estridor expiratório e/ou inspiratório, muitas vezes sendo necessária intubação desses pacientes. Podem existir períodos assintomáticos, seguidos de dispnéia, cianose, vômitos e aspiração. Apesar do início precoce dos sintomas, o diagnóstico pode não ser firmado até que realizada necropsia. Alguns autores têm relatado casos de pacientes assintomáticos ou com poucos sintomas, não surpreendentemente com maior sobrevida. Muitos destes pacientes tiveram diagnóstico estabelecido já na vida adulta, durante investigação diagnóstica para infecções respiratórias de repetição, estridor ou durante a investigação de alterações radiográficas encontradas em exames de rotina(3). Muitas anomalias traqueobrônquicas e cardiovasculares podem estar associadas à alça da artéria pulmonar. A coexistência de uma estenose traqueal de grande extensão, associada ao desaparecimento parcial ou completo dos anéis traqueais é a mais freqüente. Também são relatados casos com estenose dos brônquios principais, a presença de brônquio traqueal, anormalidades na ramificação brônquica e fístula traqueoesofágica(2). O pseudo-isomerismo, no qual o crescimento e a divisão dos brônquios principais estão alterados formando brônquios principais de comprimento semelhante, foi primeiramente descrito em 1976(4) e confirmado como anormalidade comumente associada à artéria pulmonar esquerda anômala num estudo posterior, que sugere o termo T invertido para descrever o trajeto horizontal dos brônquios principais direito e esquerdo(11). As anormalidades cardiovasculares são freqüentemente encontradas e podem estar presentes em cerca de 50% dos pacientes com alça da artéria pulmonar. As mais comumente encontradas são comunicação interatrial e interventricular, ducto arterioso patente, veia cava superior esquerda persistente e anomalias do arco aórtico, incluindo coarctação da aorta e artéria subclávia direita anômala(5). A angiocardiografia seletiva é o procedimento mais comumente usado para confirmar o diagnóstico desta anomalia, mas exames não-invasivos, como a angiocardiografia de subtração digital, a TC, a ecocardiografia ou a RM, podem também confirmar o diagnóstico(3). O radiograma convencional do tórax pode demonstrar enfisema obstrutivo ou atelectasia de um ou de ambos os pulmões, rebaixamento do hilo esquerdo, estenose das vias aéreas ou mesmo dilatação destas, alteração da altura na qual se dá a bifurcação traqueal, além da modificação dos ângulos traqueobrônquicos(2). A artéria pulmonar esquerda anômala pode ser ocasionalmente descrita como uma massa mediastinal(12). O esofagograma contrastado com bário pode produzir um achado específico caracterizado por uma compressão da parede anterior do esôfago. Embora este achado também possa ocorrer em outras condições raras, como a alça do ducto arterioso e artéria subclávia direita anômala(2), parece improvável que estas situações produzam sintomas com a mesma intensidade daqueles produzidos pela artéria pulmonar esquerda anômala(9). Chame-se a atenção, também, para o fato de que a alça da artéria pulmonar determina compressão da porção justacarinal da traquéia, enquanto no caso da artéria subclávia anômala esta compressão dá-se, em geral, acima da altura da croça da aorta. A broncoscopia é um exame muito importante para demonstrar ou afastar anomalias traqueobrônquicas associadas. Estenose traqueal por massa posterior pulsátil é comumente visualizada logo acima da carina(12). Porém, a broncoscopia é perigosa naqueles pacientes em que o tubo força a área estreitada da traquéia, causando mais edema e complicando o problema pré-existente(11). Para confirmar o diagnóstico de artéria pulmonar esquerda anômala, a angiocardiografia seletiva é o exame mais específico. Porém, nos casos com anomalias complexas, a alça da artéria pulmonar pode não ser identificada mesmo com a angiocardiografia(2). Devido à possibilidade de o diagnóstico ser estabelecido por meios não-invasivos, a angiocardiografia não é sempre necessária(5). A ecocardiografia parece ser o método diagnóstico mais simples e mais confortável para o paciente(3), mas tem baixa sensibilidade. Na presença de cardiopatia congênita e/ou hiperinsuflação de um ou ambos os pulmões, a anomalia se torna mais difícil de ser identificada(2,3,13). A TC provou ser um bom método para identificar as anormalidades vasculares. Pode ainda mostrar a trajetória horizontal dos brônquios principais (sinal do T invertido) e o tamanho da luz traqueal(11). Esta técnica também permite a reconstrução 3D das imagens da árvore traqueobrônquica e do esôfago, tornando mais fácil o diagnóstico da alça da artéria pulmonar e evitando o uso de exames invasivos como relatado no caso 1. A RM é considerada um excelente exame para investigar a artéria pulmonar esquerda anômala, porque permite a avaliação completa da anatomia vascular e ainda possibilita a identificação das anomalias traqueobrônquicas. A reconstrução 3D das imagens avalia de maneira mais efetiva a extensão da estenose traqueal, facilitando o planejamento da abordagem cirúrgica(14). A primeira cirurgia bem sucedida descrita foi em 1954, na qual se seccionou a artéria anômala e se realizou a anastomose após a correção da sua localização(15). Após este relato, a cirurgia tornou-se a única possibilidade real de cura. Com isso a técnica originalmente descrita por Potts et al.(15) vem sendo modificada e outras técnicas foram descritas(16–18). Três técnicas vêm sendo usadas: a divisão do vaso anômalo, a divisão do ducto arterioso patente ou ligamento arterioso e a divisão do brônquio principal direito com posterior reanastomose(5). Apesar da viabilidade de uma cirurgia para corrigir a anomalia, a mortalidade permanece alta mesmo anos após o procedimento(2). Porém, com a evolução da técnica cirúrgica e utilização de artifícios modernos como a circulação extracorpórea, esta mortalidade operatória vem diminuindo e a sobrevida, melhorando(17). O prognóstico dos pacientes sintomáticos, se não tratados, é invariavelmente fatal, poucos meses após o nascimento.
REFERÊNCIAS 1. Glaevecke H, Dohle W. Ube reine selten angedorene Anomalie der Pulmonarterie. Munch Med Wochenschr 1897;950–3. [ ] 2. Döhlemann C, Mantel K, Vogl TJ, et al. Pulmonary sling: morphological findings. Pre- and postoperative course. Eur J Pediatr 1995;154:2–14. [ ] 3. Dupuis C, Vaksmann G, Pernot C, Gerard R, Martinez J, Van Egmond H. Asymptomatic form of left pulmonary artery sling. Am J Cardiol 1988;61: 177–81. [ ] 4. Cohen SR, Landing BH. Tracheostenosis and bronchial abnormalities associated with pulmonary artery sling. Ann Otol Rhinol Laryngol 1976;85(5 Pt 1):582–90. [ ] 5. Sade RM, Rosenthal A, Fellows K, Castaneda AR. Pulmonary artery sling. J Thorac Cardiovasc Surg 1975;69:333–46. [ ] 6. Scheid P. Missbildung des Trachealskelettes und der linken Arteria pulmonalis mit Erstickungstod bei 7 Monate altem Kind. Frank Zeitsch fur Pathologie 1938;52:114–24. [ ] 7. Contro S, Miller RA, White H, Potts WJ. Bronchial obstruction due to pulmonary artery anomalies. I. Vascular sling. Circulation 1958;17:418–23. [ ] 8. Jue KL, Raghib G, Amplatz K, Adams P Jr, Edwards JE. Anomalous origin of the left pulmonary artery from the right pulmonary artery. Report of 2 cases and review of the literature. Am J Roentgenol Radium Ther Nucl Med 1965;95:598–610. [ ] 9. Clarkson PM, Ritter DG, Rahimtoola SH, Hallermann FJ, McGoon DC. Aberrant left pulmonary artery. Am J Dis Child 1967;113:373–7. [ ] 10. Grover FL, Norton JB Jr, Webb GE, Trinkle JK. Pulmonary sling. Case report and collective review. J Thorac Cardiovasc Surg 1975;69:295–300. [ ] 11. Berdon WE, Baker DH, Wung JT, et al. Complete cartilage-ring tracheal stenosis associated with anomalous left pulmonary artery: the ring-sling complex. Radiology 1984;152:57–64. [ ] 12. Koopot R, Nikaidoh H, Idriss FS. Surgical management of anomalous left pulmonary artery causing tracheobronchial obstruction. Pulmonary artery sling. J Thorac Cardiovasc Surg 1975;69:239–46. [ ] 13. Loureiro M, Moreira J, Vaz T, Ribeiro A, Monterroso J, Areias JC. Anomalous origin of the left pulmonary artery (sling): a case report and review of the literature. Rev Port Cardiol 1998;17:811–5. [ ] 14. Simoneaux SF, Bank ER, Webber JB, Parks WJ. MR imaging of the pediatric airway. RadioGraphics 1995;15:287–98. [ ] 15. Potts WJ, Hollinger PH, Rosenblum AH. Anomalous left pulmonary artery causing obstruction to right main bronchus: report of a case. J Am Med Assoc 1954;155:1409–11. [ ] 16. Tesler UF, Balsara RH, Niguidula FN. Aberrant left pulmonary artery (vascular sling): report of five cases. Chest 1974;66:402–7. [ ] 17. Backer CL, Idriss FS, Holinger LD, Mavroudis C. Pulmonary artery sling. Results of surgical repair in infancy. J Thorac Cardiovasc Surg 1992;103: 683–91. [ ] 18. Ziemer G, Heinemann M, Kaulitz R, Freihorst J, Seidenberg J, Wilken M. Pulmonary artery sling with tracheal stenosis: primary one-stage repair in infancy. Ann Thorac Surg 1992;54:971–3. [ ]
Recebido para publicação em 14/4/2004. Aceito, após revisão, em 1/9/2004.
* Trabalho realizado no Departamento de Radiologia Torácica do Pavilhão Pereira Filho da Irmandade da Santa Casa de Misericórdia de Porto Alegre, Porto Alegre, RS. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554