Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 40 nº 1 - Jan. / Fev. of 2007
Vol. 40 nº 1 - Jan. / Fev. of 2007
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Ilka Yamashiro, Ricardo Pires de Souza |
|
|
Descritores: Tomografia computadorizada, Nasofaringe, Tumor, Carcinoma |
|
|
Resumo:
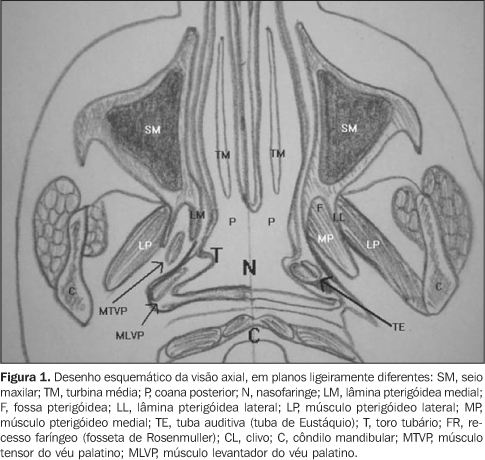
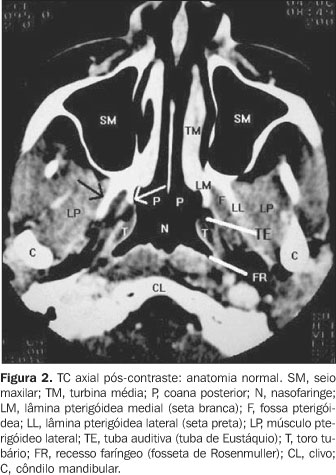
SUBSTRATO ANATÔMICO A nasofaringe é a parte mais superior das vias aéreas superiores e compõe o segmento superior da faringe. Seus principais reparos anatômicos são o recesso faríngeo lateral, o toro tubário e a tuba auditiva. A nasofaringe situa-se abaixo da base do crânio, anteriormente ao clivo, continua-se anteriormente com a cavidade nasal e inferiormente com a orofaringe, da qual é separada por um plano horizontal que passa pelo palato duro e o músculo palatofaríngeo. Lateralmente, é limitada pelas margens do músculo constritor superior, pela fáscia faringobasilar e pelo espaço parafaríngeo(1). Sua parede é composta por três camadas: revestimento mucoso, camada muscular e armação fibrosa denominada fáscia faringobasilar. Mede cerca de 2,0 cm de diâmetro ântero-posterior e cerca de 4,0 cm de extensão crânio-caudal(2). A lâmina média da fáscia cervical profunda ou fáscia bucofaríngea é uma condensação de tecido celular que circunda a porção lateral e posterior da nasofaringe, dando-lhe delimitação fascial e intermediando suas relações com estruturas vizinhas. É delicada, tênue, não representando barreira significativa à disseminação neoplásica ou infecciosa da nasofaringe para espaços adjacentes(3,4). Recobre lateralmente os músculos da faringe, tendo inserção superior na base do crânio no tubérculo faríngeo, com o músculo constritor da faringe, com a fáscia faringobasilar e na margem posterior da lâmina medial do processo pterigóideo. A protrusão de estruturas e a composição da parede faríngea dão forma ao relevo mucoso da nasofaringe, determinando pontos de reparo anatômicos que são utilizados na avaliação clínica e na interpretação dos cortes seccionais de tomografia computadorizada (TC) e ressonância magnética (RM). São eles: a) o toro tubário, a mais proeminente dessas estruturas, correspondendo à protrusão de parte da cartilagem da tuba auditiva. É visualizado como protuberância projetando-se para dentro da cavidade nasofaríngea em sua parede lateral, tanto na TC quanto na RM; b) o óstio da tuba auditiva, localizado em situação imediatamente ântero-inferior ao toro tubário(5). Nos cortes axiais de TC e RM aparece como discreta reentrância na parede lateral da nasofaringe; c) a prega salpingofaríngea, protrusão da mucosa determinada pelo trajeto submucoso do músculo salpingofaríngeo, formando o limite anterior do recesso faríngeo lateral; d) o recesso faríngeo lateral, situado posteriormente e estendendo-se superiormente em relação à prega salpingofaríngea e ao toro tubário (Figuras 1 e 2). É o sítio mais comum de origem do carcinoma de células escamosas da nasofaringe(6). Sua origem se dá pela discreta herniação mucosa por uma zona da parede faríngea que não dispõe de fibras musculares (seio de Morgagni) O grau de distensibilidade deste recesso é altamente variável. Ele tende a ser simétrico, embora discretas assimetrias não sejam incomuns na RM e na TC(7). Em jovens tem menor amplitude devido à maior presença de tecido linfóide retrofaríngeo(8).
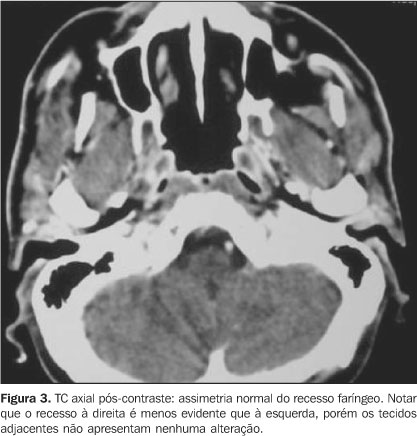
A nasofaringe é constituída por: a) Uma camada muscular, formada pelos músculos constritores da faringe superior, média e inferior, levantadores da faringe (palatofaríngeo, estilofaríngeo e salpingofaríngeo), palatoglosso, levantador e tensor do véu palatino e o músculo palatofaríngeo; b) uma armação fibrosa ou fáscia faringobasilar, situada entre a túnica muscular e a mucosa, estendendo-se sem interrupção da extremidade superior à inferior da faringe, não existindo na parte anterior, exceto na aderência com a laringe, onde é circular(1). Cranialmente, onde sua superfície externa não é recoberta pela camada muscular (entre a base do crânio e a porção ínfero-lateral da cartilagem da tuba auditiva), existe um entalhe lateral denominado seio de Morgagni. É por este espaço que a tuba auditiva e o músculo levantador do véu palatino penetram para atingir a porção interna da nasofaringe. O seio de Morgagni, por sua característica anatômica, é importante via de disseminação do carcinoma da nasofaringe para os espaços vizinhos, como o parafaríngeo; c) um revestimento mucoso ou túnica interna, que reveste a face interna da fáscia faringobasilar e tem continuidade com o revestimento mucoso da cavidade nasal e orofaringe. É constituído por epitélio e por córion rico em glândulas mucíparas e em folículos linfóides. Seu epitélio é do tipo cilíndrico ciliado pseudo-estratificado(9). No córion temos abundância de tecido linfóide, com formações que vão compor parte do anel linfático da faringe, que pode ser sítio de desenvolvimento de linfoma não-Hodgkin, que é a segunda neoplasia maligna mais comum da nasofaringe(2,10). Glândulas salivares menores estão presentes na submucosa em torno das tubas auditivas e podem ser foco de lesões benignas ou malignas da nasofaringe. O conhecimento da ocorrência de variantes anatômicas é importante para que não se confunda alterações da normalidade com doença. A assimetria dos pontos de reparo da mucosa é variação de ocorrência comum, destacando-se a assimetria do recesso faríngeo. A diminuição da profundidade ou mesmo colabamento deste recesso faríngeo como aspecto normal deve ser diferenciada de doença. A análise dos planos profundos adjacentes, havendo integridade e simetria destes, sugere normalidade (Figura 3). Também a obtenção de imagens na TC durante manobra de Valsalva modificada ou ampla abertura da boca poderá ser útil. A manobra de Valsalva modificada leva à máxima distensão do óstio da tuba auditiva e do recesso faríngeo. A ampla abertura da boca distende o recesso faríngeo e aumenta a profundidade do óstio tubário(7).
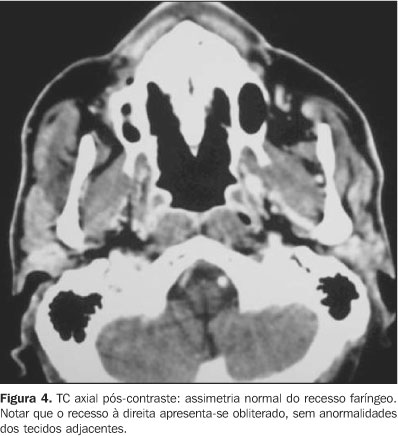
O tecido linfóide nasofaríngeo pode, às vezes, assemelhar-se a processo tumoral. Sabendo-se que seu limite normal é a mucosa e a submucosa, a extensão para planos profundos deve ser considerada como evidência de lesão maligna ou processo inflamatório agressivo(11,12). Com o avanço da idade há diminuição do volume do tecido linfóide, dos músculos levantador e tensor do véu palatino, músculos constritores e aumento de tecido gorduroso. Essas modificações são conhecidas como atrofia nasofaríngea. Na avaliação radiológica observamos aumento do tamanho do recesso faríngeo lateral, com maior proeminência do toro tubário e do óstio tubário. Deve-se ressaltar que se não houver total esclarecimento quanto à assimetria nos cortes axiais, torna-se mandatória a realização de cortes coronais, principalmente em alterações da extremidade superior do recesso lateral(13) (Figura 4).
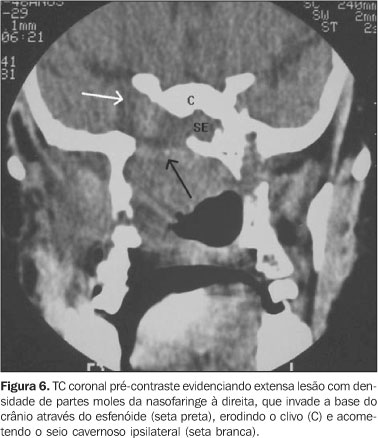
ESTADIAMENTO LOCAL DOS CARCINOMAS DA NASOFARINGE O carcinoma de células escamosas compreende aproximadamente 70% a 98% de todas as neoplasias malignas da nasofaringe. Os linfomas compõem cerca de 20% dos casos e os restantes 10% são causados por uma variedade de lesões, incluindo os adenocarcinomas, o carcinoma adenóide cístico, os rabdomiossarcomas, etc. O carcinoma de células escamosas da nasofaringe é um câncer relativamente raro, compreendendo 0,25% das neoplasias malignas na América do Norte, porém apresenta alta incidência entre os asiáticos, principalmente do sudeste asiático, chegando a compreender 18% de todos os cânceres na China(2). Tende a afetar grupo etário mais jovem que outras lesões do trato aerodigestivo superior, sendo mais comum em homens do que em mulheres(14). Os fatores de risco para o desenvolvimento do carcinoma da nasofaringe incluem os mesmos da orofaringe, como o consumo de nitrosaminas (presentes em condimentos alimentares) e hidrocarbonetos policíclicos, o uso crônico de álcool e tabaco, condições precárias de vida, infecções nasossinusais de repetição, e há forte associação com a infecção pelo vírus Epstein-Barr, principalmente em pacientes do sudeste asiático, onde a população afetada geralmente é mais jovem quando comparada à população caucasiana(2). A classificação da Organização Mundial da Saúde, recentemente, atualizou a classificação histológica dos carcinomas da nasofaringe, dividindo-os em dois maiores subtipos: 1 – o carcinoma de células escamosas; 2 – o carcinoma de células não-queratinizadas. O subtipo carcinoma de células não-queratinizadas é, ainda, subdividido em subtipo I – diferenciado (2a) e II – indiferenciado (2b). O termo linfoepitelioma também é usado para designar estes dois subtipos de tumor. Essas novas nomenclaturas 2a e 2b correspondem aos antigos tipos 2 e 3 da antiga classificação, respectivamente(2). Este último, o carcinoma de células não-queratinizadas subtipo indiferenciado, parece estar mais relacionados à infecção pelo vírus Epstein-Barr, promovendo de maneira ainda incerta o desenvolvimento do câncer em pacientes mais jovens(15–17). Ainda, a presença do genoma viral (vírus Epstein-Barr) em linfonodos metastáticos pode sugerir um carcinoma da nasofaringe como sítio primário(18). O sítio de origem é variado. Os locais mais comuns são as paredes laterais da nasofaringe, mais freqüentemente o recesso faríngeo lateral e muitas vezes o toro tubário está envolvido(14,19,20) (Figuras 5A e 5B). A manifestação clínica do carcinoma de nasofaringe depende do tamanho, da localização e da rota de disseminação provocada por esses tumores. Geralmente, pequenas lesões são assintomáticas. Porém, otite média serosa, cefaléia, obstrução nasal, epistaxe, "dor de garganta", trismo e proptose podem estar presentes, dependendo do grau de acometimento das estruturas vizinhas e do tamanho da lesão(2). Outros sintomas menos comuns podem estar presentes, como hemotímpano, massa periauricular, sensação de "ouvido tampado", barotrauma, pólipo no interior da orelha interna e perda auditiva neurossensorial súbita(21). Vias anatômicas específicas pelas quais o tumor se estende para a base do crânio ou regiões intracranianas são inferidas por imagens de TC e RM, assim como a disseminação metastática linfonodal ou a distância. O carcinoma da nasofaringe é um dos poucos tumores da cabeça e pescoço que não apresenta relação entre o tamanho tumoral e a presença de metástases linfonodais, e isto se deve ao extenso plexo de drenagem linfática presente na região. Cerca de 90% dos casos apresentam-se com metástases linfonodais no momento do diagnóstico e, ainda, 50% deles já apresentam doença bilateral(17). O sítio primário de drenagem é para os linfonodos retrofaríngeos, mas como podem apresentar-se obliterados na idade adulta por processos inflamatórios/infecciosos ocorridos na infância, estes linfonodos podem não se apresentar acometidos. Outros sítios de drenagem preferencial são para os níveis II, III e ocasionalmente V(2). Metástases a distância podem acometer os pulmões, o esqueleto, o fígado e ocasionalmente o plexo coróide(17). Em geral, os carcinomas de nasofaringe se disseminam através da mucosa e submucosa ao longo dos grupamentos musculares e em suas origens e inserções, junto aos planos gordurosos que circundam os músculos, ao longo dos feixes vásculo-nervosos e pelos forames criados para passagem normal dessas estruturas. Algumas estruturas são mais resistentes à invasão tumoral, como a porção cartilaginosa da tuba auditiva e a fáscia faringobasilar(2,19,22,23). A disseminação perineural é a forma mais insidiosa de disseminação tumoral e é de fundamental importância para o planejamento terapêutico e prognóstico. O nervo do canal pterigóideo representa a principal rota de disseminação perineural do carcinoma de nasofaringe. Deve-se suspeitar de invasão perineural quando há alargamento ou realce anormal do nervo com obliteração dos planos gordurosos(24). O carcinoma da nasofaringe origina-se, comumente, na região do recesso faríngeo lateral. Na TC, usualmente nota-se assimetria, borramento ou obliteração desse recesso, que pode estar associado a aumento do músculo levantador do véu palatino(6,19,25). Quando o tumor ultrapassa a fáscia faringobasilar, invade o espaço parafaríngeo, ocorrendo em 65% dos casos de carcinoma de nasofaringe, segundo Hoe(14,25). Sham e Choy encontraram 85% de comprometimento desta região(26). A partir do espaço parafaríngeo, o tumor pode estender-se superiormente, anteriormente, lateralmente ou posteriormente. A extensão superior do carcinoma da nasofaringe é a mais freqüente rota de disseminação direta (48%)(19,25). A extensão intracraniana pode ocorrer por destruição direta da base do crânio ou por extensão para o seio cavernoso através do forame lacerado ou do forame oval. A extensão superior do tumor é visualizada como infiltração do seio esfenoidal com opacificação ou presença de líquido e destruição óssea. As áreas mais comuns de destruição óssea na base do crânio são o clivo, o forame lacerado e a fossa craniana média, ao redor do soalho do seio esfenóide e forame jugular (Figura 6).
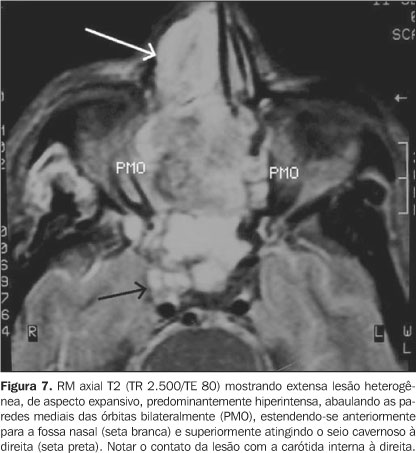
A disseminação do tumor pelo forame lacerado é perivascular através da artéria carótida e resulta em erosão do canal carotídeo (Figura 7). A disseminação através do forame oval é perineural, resultando em erosão na base do esfenóide. Uma via de disseminação menos comum para a fossa craniana média é a perineural através do forame redondo(14,27). É importante lembrar que a invasão da base do crânio independe do tamanho do tumor, variando desde discreta erosão até franca destruição óssea. Outros achados concomitantes na invasão intracraniana são o comprometimento predominantemente das cisternas da base, dos seios cavernosos, associada a paralisia dos pares cranianos acometidos(2,17).
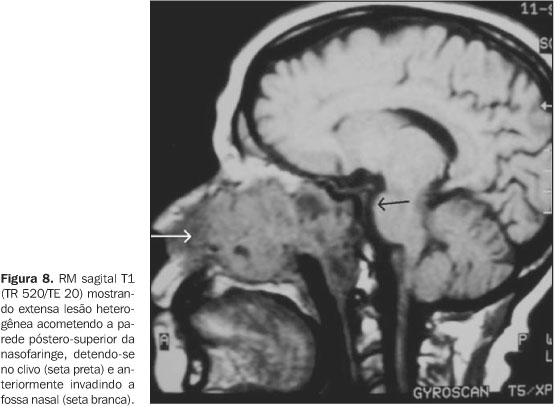
Low et al. relataram o acometimento do ângulo cerebelopontino por esses carcinomas, ressaltando a dificuldade diagnóstica e terapêutica desta entidade, já que os pacientes estudados apresentavam doença avançada ou recorrência tumoral de uma doença avançada previamente tratada(28). Deve-se suspeitar de recorrência da doença se o paciente apresentar sintomas neurológicos sem explicação aparente, como perda auditiva neurossensorial, zumbido ou paralisia facial(28). A extensão posterior é a segunda rota mais freqüente de disseminação direta (40%)(14). Quando o tumor se estende para o espaço retrofaríngeo é observada massa anterior aos músculos pré-vertebrais. Nesta localização há linfonodos retrofaríngeos e pode ser difícil distinguir o envolvimento linfonodal da extensão direta pelo tumor. A infiltração do espaço pré-vertebral é identificada como massa posterior aos músculos pré-vertebrais e acontece em 14% dos casos (Figura 8).
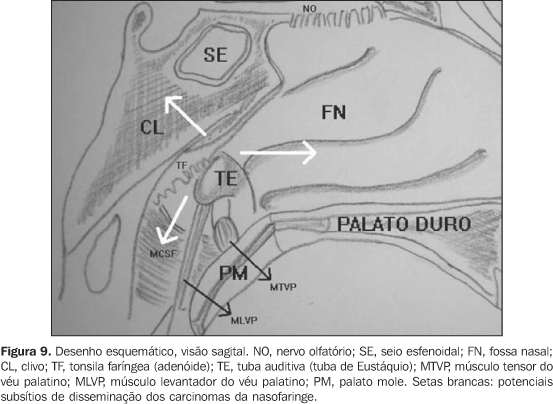
Na extensão ântero-lateral pode ocorrer invasão do espaço mastigador, incluindo a fossa infratemporal (14%). Inferiormente, os carcinomas invadem a orofaringe através das paredes laterais da faringe, pelos pilares anterior e posterior das tonsilas palatinas. Como este tipo de disseminação geralmente é submucoso, pode apresentar-se clinicamente oculta. A forma de disseminação submucosa pode estar clinicamente oculta e a TC e a RM podem ser úteis na detecção deste tipo de disseminação ou para identificar áreas suspeitas, indicando a biópsia da região. Como já foi dito, esses tumores podem ser pequenos e infiltrativos causando ou não efeito de massa; nesses casos, a obliteração dos planos gordurosos e a perda da definição das margens musculares são achados diagnósticos de grande valia, e a RM com uso do meio de contraste (gadolínio) mais a supressão de gordura tem-se mostrado superior à TC na avaliação das partes moles, tanto da região profunda como da superficial da nasofaringe, além de poder diferenciar claramente tecido linfóide da musculatura(17,19). Este fato é muito importante, já que o fator prognóstico mais relevante no carcinoma da nasofaringe está na profundidade e no grau de infiltração de estruturas vizinhas e não no seu tamanho(29). Entretanto, a TC é melhor para demonstrar a envolvimentos sutis das estruturas ósseas da base do crânio(6,30). Ambos os métodos têm papel essencial e complementar no estadiamento e no tratamento dos pacientes portadores de cânceres da nasofaringe. Já a tomografia por emissão de pósitrons (positron emission tomographic scanning) acessa de maneira mais adequada tumores recorrentes e metástases linfonodais muito pequenas(2,17). Como não é possível, pelos exames de imagem, suspeitar do tipo histológico da lesão, fato importante, já que o prognóstico é diferente para os diferentes tipos celulares, resta ao radiologista mapear de forma precisa os sítios invadidos e auxiliar o clínico/cirurgião no correto estadiamento (Tabela 1) (Figura 9).
Tipicamente, os carcinomas de células escamosas são massas com coeficiente de atenuação similar ao dos músculos e não mostram realce significativo após administração endovenosa do material de contraste na TC. Na RM esses tumores apresentam intensidade de sinal intermediária em todas as seqüências. As interfaces tumor/tecidos moles são demonstradas de maneira mais adequada pela RM, enquanto a destruição óssea discreta é mais bem evidenciada pela TC. A extensão neoplásica através dos forames lacerado e oval é mais bem apreciada por meio da RM. A utilização do contraste paramagnético por via endovenosa (gadolínio) é vantajosa no estudo por RM, já que o intenso realce tumoral permite melhor delimitação da lesão, evitando, dessa forma, que se superestimem suas dimensões, fenômeno que é habitual nas margens sem contraste, em função da presença de edema e processo inflamatório perilesional(31,32) (Figuras 10A e 10B). Para um estadiamento completo deve-se estudar também o acometimento linfonodal, presente em aproximadamente 90% dos pacientes no momento do diagnóstico. Os linfonodos retrofaríngeos são, usualmente, os primeiros a serem acometidos, mas podem apresentar-se normais caso estejam obliterados por processos inflamatórios prévios. Os seguintes são os dos níveis II e III, e ocasionalmente os dos níveis I e V podem estar comprometidos(2) (Tabela 2).
O tratamento de escolha para os carcinomas da nasofaringe geralmente é a radioterapia, por isso os métodos de imagem são tão importantes no mapeamento tumoral para o planejamento radioterápico(33). Todavia, a avaliação pós-tratamento, tanto pela TC quanto pela RM, apresenta baixas sensibilidade (45% a 67% para a TC e 56% para a RM) e especificidade (64% a 70% para a TC e 78% a 83% para a RM)(34).
REFERÊNCIAS 1. Parker GD, Harnsberger HR, Jacobs JM. The pharyngeal mucosal space. Semin Ultrasound CT MR 1990;11:460–475. [ ] 2. Mukerji SK. Pharynx. In: Som PM, Curtin HD, editors. Head and neck imaging. 4th ed. St. Louis: Mosby, 2003;1470–1484. [ ] 3. Silver AJ, Mawad ME, Hilal SK, Sane P, Ganti SR. Computed tomography of the nasopharynx and related spaces. Part II: Pathology. Radiology 1983;147:733–738. [ ] 4. Last RJ. Anatomy regional and applied. 6th ed. London: Churchill Livingstone, 1978. [ ] 5. Testut L, Latarjet A. Aparato de la digestión. In: Testut L, Latarjet A. Tratado de anatomía humana 8ª ed. Barcelona-Buenos Aires: Salvat Editores, 1944;112–133. [ ] 6. Braun IF. MRI of the nasopharynx. Radiol Clin North Am 1989;27:315–330. [ ] 7. Mancuso AA, Bohman L, Hanafee W, Maxwell D. Computed tomography of the nasopharynx: normal and variants of normal. Radiology 1980; 137(1 Pt 1):113–121. [ ] 8. Khoo FY, Kanagasuntheram R, Chia KB. Variations of the lateral recesses of the nasopharynx. Arch Otolaryngol 1967;86:456–462. [ ] 9. Cormack DH. Ham's Histology. 9th ed. Philadelphia: JB Lippincott, 1987. [ ] 10. Harnsberger HR. Handbooks in radiology: head and neck imaging. Chicago: Mosby-Year Book, 1990. [ ] 11. Muraki AS, Mancuso AA, Harnsberger HR, Johnson LP, Meads GB. CT of the oropharynx, tongue base, and floor of the mouth: normal anatomy and range of variations, and applications in staging carcinoma. Radiology 1983;148:725–731. [ ] 12. Olsen WL, Jeffrey RB Jr, Sooy CD, Lynch MA, Dillon WP. Lesions of the head and neck in patients with AIDS: CT and MR findings. AJR Am J Roentgenol 1988;151:785–790. [ ] 13. Lingermar RE, Shellhamer RH. Benign neoplasms of the nasopharynx. In: Cummings CW, Fredrickson JM, Harker LA, et al, editors. Otolaryngology – head and neck surgery. St. Louis: Mosby, 1986;1269. [ ] 14. Fu KK. Treatment of tumor of nasopharynx. In: Thauley SE, Ponje WR, Batsakis JG, Lindeberg RD, editors. Comprehensive management of head and neck tumors. Philadelphia: WB Saunders, 1987;30:649–683. [ ] 15. Nicholls JM, Agathanggelou A, Fung K, Zeng X, Niedobitek G. The association of squamous cell carcinomas of the nasopharynx with Epstein-Barr virus shows geographical variation reminiscent of Burkitt's lymphoma. J Pathol 1997;183:164–168. [ ] 16. Zhang XS, Wang HH, Hu LF, et al. V-val subtype of Epstein-Barr virus nuclear antigen 1 preferentially exists in biopsies of nasopharyngeal carcinoma. Cancer Lett 2004;211:11–18. [ ] 17. Weber AL, al-Arayedh S, Rashid A. Nasopharynx: clinical, pathologic, and radiologic assessment. Neuroimaging Clin N Am 2003;13:465–483. [ ] 18. Macdonald MR, Freeman JL, Hui MF, et al. Role of Epstein-Barr virus in fine-needle aspirates of metastatic neck nodes in the diagnosis of nasopharyngeal carcinoma. Head Neck 1995;17: 487–493. [ ] 19. Hoe JWM. Computed tomography of nasopharyngeal carcinoma. A review of CT appearances in 56 patients. Eur J Radiol 1989;9:83–90. [ ] 20. Su CY, Hsu SP, Lui CC. Computed tomography, magnetic resonance imaging and electromyographic studies of tensor veli palatini muscles in patients with nasopharyngeal carcinoma. Laryngoscope 1993;103:673–678. [ ] 21. Low WK, Goh YH. Uncommon otological manifestations of nasopharyngeal carcinoma. J Laryngol Otol 1999;113:558–560. [ ] 22. Miura T, Hirabuki N, Nishiyama K, et al. Computed tomographic findings of nasopharyngeal carcinoma with skull base and intracranial involvement. Cancer 1990;65:29–37. [ ] 23. Hoover LA, Hanafee WN. Differential diagnosis of nasopharyngeal tumors by computed tomography scanning. Arch Otolaryngol 1983;109:43–47. [ ] 24. Pandolfo I, Bandino A, Longo M, Faranda C. Perineural spread of nasopharyngeal carcinoma: radiological and CT demonstration. Eur J Radiol 1988;8:231–235. [ ] 25. Hoe J. CT of nasopharyngeal carcinoma: significance of widening of the preoccipital soft tissue on axial scans. AJR Am J Roentgenol 1989;153: 867–872. [ ] 26. Sham JST, Choy D. Prognostic value of paranasopharyngeal extension of nasopharyngeal carcinoma on local control and short-term survival. Head Neck 1991;13:298–310. [ ] 27. Teresi LM, Lufkin RB, Vinuela F, et al. MR imaging of the nasopharynx and floor of the middle cranial fossa. Part II. Malignant tumors. Radiology 1987;164:817–821. [ ] 28. Low WK, Fong KW, Chong VF. Cerebellopontine angle involvement by nasopharyngeal carcinoma. Am J Otol 2000;21:871–876. [ ] 29. Sakata K, Hareyama M, Tamakawa M, et al. Prognostic factors of nasopharynx tumors investigated by MR imaging and the value of MR imaging in the newly published TNM staging. Int J Radiat Oncol Biol Phys 1999;43:273–278. [ ] 30. Dillion WP, Mills CM, Kjos B, DeGroot J, Brant-Zawadzki M. Magnetic resonance imaging of the nasopharynx. Radiology 1984;152:731–738. [ ] 31. Souza RP, Rapoport A. O valor da tomografia computadorizada e da ressonância magnética na avaliação do espaço parafaríngeo. Parte II: tumores e pseudotumores. Rev Imagem 1994;16:7–24. [ ] 32. Phillips CD, Gay SB, Newton RL, Levine PA. Gadolinium-enhanced MRI of tumors of the head and neck. Head Neck 1990;12:308–315. [ ] 33. Chong VF, Fan YF, Mukherji SK. Carcinoma of the nasopharynx. Semin Ultrasound CT MR 1998;19:449–462. [ ] 34. Chong VF, Fan YF. Detection of recurrent nasopharyngeal carcinoma: MR imaging versus CT. Radiology 1997;202:463–470. [ ]
Recebido para publicação em 28/10/2004. Aceito, após revisão, em 17/3/2005.
* Trabalho realizado no Serviço de Diagnóstico por Imagem do Serviço de Radiologia do Hospital Heliópolis, São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554