Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 42 nº 6 - Nov. / Dez. of 2009
Vol. 42 nº 6 - Nov. / Dez. of 2009
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Wellington de Paula Martins, Stael Porto Leite, Carolina Oliveira Nastri |
|
|
Descritores: Ultrassonografia, Puberdade precoce, Ovário |
|
|
Resumo:
INTRODUÇÃO O conhecimento das mudanças que ocorrem na pelve feminina durante a puberdade é fundamental ao investigar alterações da pelve feminina em crianças e adolescentes. O correto diagnóstico pode ser muito facilitado pelos métodos de imagem, sendo a ultrassonografia a modalidade de escolha(1). O útero pré-púbere é fino, com o corpo uterino de tamanho similar ao colo. Devido à estimulação hormonal que ocorre na puberdade, o útero cresce e o fundo torna-se proeminente. Os ovários podem ser identificados com a ultrassonografia em todas as idades, sendo que o seu volume aumenta geralmente após os seis anos de idade. Pequenos folículos podem ser vistos normalmente durante toda a infância. O exame ultrassonográfico nessas pacientes é rotineiramente realizado por via abdominal usando o líquido da bexiga como uma janela ultrassônica. O líquido ajuda deslocar o intestino com gases (que impedem a passagem adequada do ultrassom) para fora da pelve. O estudo com Doppler colorido permite a identificação rápida dos vasos e de estruturas vasculares anormais. Em adolescentes sexualmente ativas, o exame pode ser complementado com o exame vaginal. Alem disso, quando uma melhor resolução é necessária ou em situações em que o exame pela via abdominal não traz informações suficientes, a realização do exame pela via retal é uma boa opção quando executado por ultrassonografistas experientes. As principais indicações para ultrassonografia pélvica em crianças e adolescentes são a puberdade precoce ou atrasada, dor ou massas pélvicas, genitália ambígua, sangramento vaginal em crianças, amenorreia primária e dor ou massas pélvicas. Sangramento vaginal na criança pré-púbere pode ser causado por corpo estranho, puberdade precoce ou rabdomiossarcoma vaginal. As causas mais comuns de amenorreia primária em adolescentes incluem: disgenesia gonadal (síndrome de Turner) e anomalias müllerianas (malformação uterovaginal). A dor ou as massas pélvicas em crianças e adolescentes podem ocorrer devido a torsão ovariana, cisto ovariano hemorrágico, doença inflamatória pélvica ou gravidez ectópica.
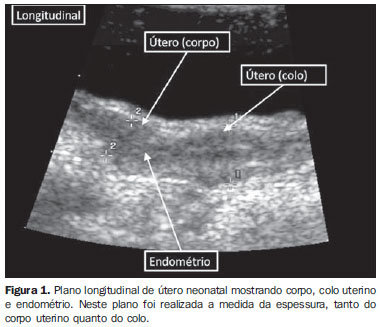
ÚTERO E OVÁRIOS Em neonatos, o útero está aumentado em razão da influência de hormônios maternos e placentários(2,3). O corpo é maior que o colo, o comprimento uterino é de aproximadamente 3,5 cm e a espessura máxima é de aproximadamente 1,4 cm. O endométrio geralmente é visível e ecogênico (Figura 1). Um pouco de líquido pode estar presente na cavidade endometrial em aproximadamente 25% dos úteros neonatais. Nos neonatos, o volume ovariano é discretamente maior que na infância, com média de 1 cm3 no primeiro ano de vida, em relação a 0,67 cm3 no segundo ano de vida(4). A presença de folículos ovarianos (< 1 cm) é rotineiramente detectada em 84% do nascimento até os dois anos de idade e em 68% das crianças entre dois e seis anos de idade(5).
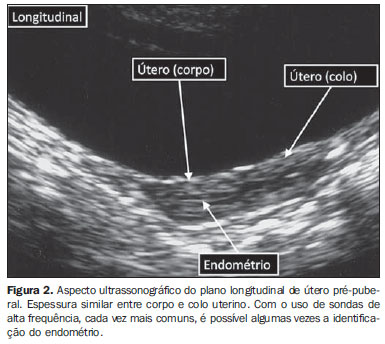
Antes da puberdade, entre dois e seis anos de idade, o tamanho e morfologia de útero e ovários são relativamente estáveis: o volume de cada ovário é menor que 2 cm3, com folículos menores que 9 mm, o comprimento do útero é menor que 4 cm, e a largura e espessura do corpo e colo uterinos são geralmente menores que 1 cm. O útero pré-puberal apresenta uma configuração tubular (espessura do colo igual à do corpo), sendo que algumas vezes a espessura do colo pode ser superior à do corpo(6,7). O endométrio normalmente não é demonstrável, entretanto, em alguns casos, pode ser visto com uso de sondas de alta frequência (Figura 2). Do ponto de vista prático, podemos adotar as seguintes medidas como limites superiores de normalidade para meninas pré-púberes: comprimento uterino < 4,5 cm, espessura uterina < 1 cm e volume ovariano < 3 cm3(8).
Um recente estudo avaliando o uso da ultrassonografia pélvica para distinguir crianças com puberdade precoce central de crianças com pubarca precoce, telarca precoce ou puberdade normal também mostrou que a ultrassonografia é um bom método diagnóstico(9). Tanto o comprimento quanto o volume uterino e o volume ovariano foram muito bons em diferenciar meninas com puberdade precoce das meninas com puberdade normal. A relação da espessura do corpo/colo, considerada por muitos como bom método, também apresentou bom desempenho, porém foi pior em relação às medidas anteriores. Todavia, este estudo não avaliou a espessura uterina de forma isolada, sendo esta medida provavelmente a mais reprodutível, uma vez que seus limites são mais bem definidos(10). Já durante a medida do comprimento do útero, o orifício externo de úteros pré-púberes pode ser difícil de diferenciar da vagina, enquanto os limites da largura podem ser mal definidos em razão da similaridade de ecogenicidade do útero com os ligamentos e trompas. A partir do início da puberdade (ao redor dos seis a nove anos), há um aumento progressivo do tamanho do útero e ovários. O corpo uterino passa a ser mais largo e espesso que o corpo, resultando no formato piriforme encontrado em mulheres adultas, sendo que a relação corpo/colo aumenta, saindo de 1/2 para valores entre 2/1 e 3/1(8). O útero geralmente apresenta comprimento entre 5 e 8 cm, largura em torno de 3,5 cm e espessura entre 1,5 e 3 cm. O endométrio pode ser identificado com facilidade e sua espessura e aparência ecográfica variam de acordo com a fase do ciclo menstrual. Em resposta ao estímulo das gonadotrofinas, os ovários adquirem formato mais ovoide e volumes acima de 4 cm3. O estudo Doppler das artérias uterinas pode ser utilizado como ferramenta complementar no seguimento da puberdade(11). Estas artérias podem ser avaliadas no corte transverso do útero, próximo ao fundo. Em garotas pré-puberes, o fluxo sistólico se manifesta como uma onda de espectro estreito, não há sinal Doppler durante o período diastólico, e alto índice de pulsatilidade (IP): média de 6,27, variando de 3,5 a 8. No início da puberdade normalmente se nota sinal Doppler não contínuo durante a diástole e redução no IP: média de 3,7, variando de 2,5 a 5. Já no final da puberdade, o espectro Doppler é de onda sistólica mais larga, com sinal Doppler contínuo durante a diástole e IP menor que 3: média de 2,06, variando de 1,1 a 2,96. Porém, o Doppler tanto das artérias uterinas quanto das artérias ovarianas, é pior que o volume do útero e ovários para separar crianças com puberdade precoce daquelas com puberdade normal(12).
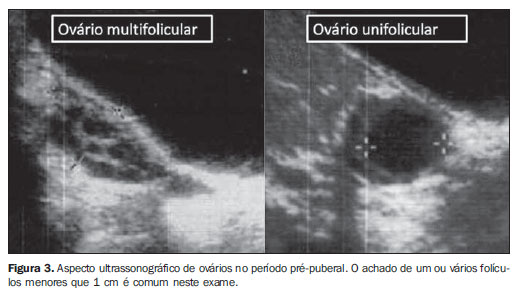
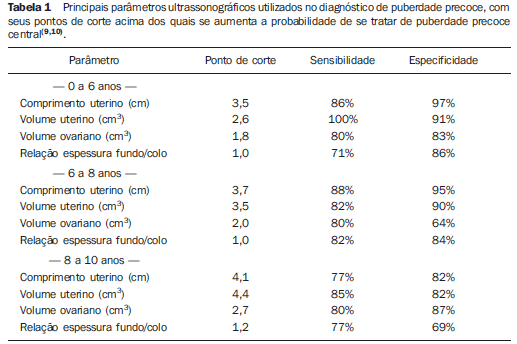
AVALIAÇÃO ECOGRÁFICA DA INFLUÊNCIA HORMONAL EM GAROTAS Estimulação estrogênica Os achados ecográficos que sugerem estimulação estrogênica são: espessura e volume do útero, espessamento do corpo uterino (corpo mais espesso que o colo ou relação corpo/colo > 1) e identificação do endométrio. A aparência do ovário é menos útil, devido a certa sobreposição de medidas no decorrer da infância entre garotas pré-puberes e púberes, e ao fato da presença de folículos não indicar puberdade precoce, uma vez que a observação de folículos com menos de 1 cm de diâmetro é comum no período pré-puberal (Figura 3)(6,13). A ultrassonografia foi considerada útil no diagnóstico diferencial de puberdade precoce central da telarca prematura, como adjuvante em dosagens de LH, por um recente consenso sobre o uso de agonistas de GnRH em crianças(14). Os principais marcadores relatados por este consenso foram: possibilidade de definir o endométrio, o que apresenta alta especificidade (em torno de 100%), porém com sensibilidade não tão boa (entre 30% e 80%)(15), o comprimento do útero acima de 3,0-4,0 cm (dependendo da idade), e volume ovariano acima de 1,0 a 1,5 cm3, com sensibilidades e especificidades em torno de 90%(9,10,16,17). A Tabela 1 resume os principais pontos de corte utilizados no diagnóstico de puberdade precoce separando por idade.
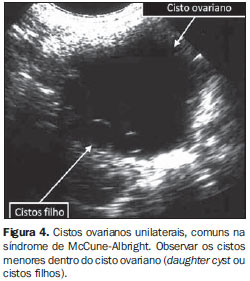
Puberdade precoce é definida com desenvolvimento sexual completo (incluindo menarca) antes dos oito anos de idade. A puberdade precoce pode ser classificada em dois tipos: central e periférica. A puberdade precoce central (puberdade precoce verdadeira) é dependente de gonadotrofinas. É idiopática em aproximadamente dois terços dos casos. Alguns tumores do sistema nervoso central ou aumento da pressão intracraniana podem levar a puberdade precoce central. O incremento uterino e ovariano pode ser demonstrado pela ultrassonografia previamente às mudanças nos padrões secretórios de LH e FSH, quando comparados com o teste de GnRH(16). Quando o acompanhamento ecográfico é realizado durante o tratamento com agonistas de GnRH, pode ser demonstrada redução do volume uterino e ovariano até os valores de crianças pré-púberes da mesma idade(18,19). A puberdade precoce periférica (pseudopuberdade precoce) não é dependente de gonadotrofinas. A síndrome de McCune-Albright consiste de manchas "café-com-leite", displasia fibrosa e puberdade precoce periférica. Cistos foliculares com produção autônoma de estradiol são a causa mais frequente de puberdade precoce periférica, sendo que estas crianças apresentam níveis séricos de estradiol sérico elevados e baixos níveis de FSH e LH. Nestes casos, a resposta ao teste de GnRH é negativa. Os achados ultrassonográficos mais comuns são a observação de útero com características de estímulo estrogênico e cisto ovariano folicular unilateral(20,21), que pode apresentar, em seu interior, cistos foliculares de menor diâmetro (Figura 4), nomeados de daughter cyst(22). Regressão espontânea dos sintomas e desaparecimento do cisto ovariano à ecografia podem ocorrer. Os cistos ovarianos foliculares com produção autonômica de estrogênio são muito mais comuns que tumores ovarianos produtores de estrogênio, como tumores de células da granulosa ou gonadoblastomas.
Adrenarca prematura isolada e telarca prematura isolada Estas crianças apresentam características ecográficas da pelve (relação corpo/colo, comprimento e espessura uterinas e volume ovariano) com valores semelhantes a de crianças pré-púberes da mesma idade(13,16).
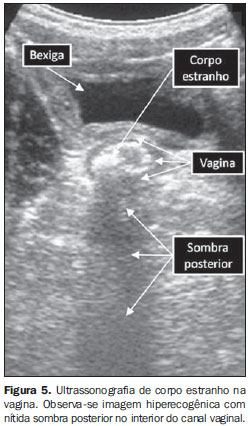
AVALIAÇÃO ECOGRÁFICA DE SANGRAMENTO VAGINAL EM CRIANÇAS PRÉ-PÚBERES O sangramento vaginal em crianças pré-púberes pode ocorrer devido a corpo estranho na vagina, puberdade precoce ou rabdomiossarcoma vaginal. Hemangiomas e outras malformações vasculares também podem ser a causa de sangramento vaginal nestas crianças. Corpo estranho na vagina Corpos estranhos na vagina podem ser vistos em 18% das crianças com sangramento e corrimento vaginal e em 50% das crianças com sangramento vaginal sem corrimento(8). Um corpo estranho vaginal pode ser identificado ao se avaliar a vagina como imagem ecogênica, sendo comum a presença de sombra acústica posterior (Figura 5)(23).
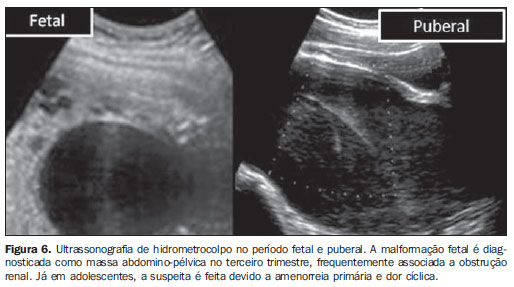
Rabdomiossarcoma vaginal Rabdomiossarcomas vaginais são achados quase que exclusivamente em crianças muito novas. A aparência ultrassonográfica destes tumores é de grandes nódulos sólidos, heterogêneos ou hipoecoicos, posteriores à bexiga. A sobrevida em cinco anos de rabdomiossarcomas do trato genital, dos casos sem metástase, é de aproximadamente 90%(24-26). Amenorreia primária em adolescentes Define-se amenorreia primária em uma destas três seguintes situações: ausência de menarca aos 16 anos de idade, ausência de telarca ou adrenarca aos 14 anos, e ausência de menarca após três anos da adrenarca e telarca. A presença ou ausência de caracteres sexuais secundários ao exame clínico e a identificação do útero ao exame ecográfico são os passos iniciais para se iniciar uma investigação laboratorial. Causas comuns de amenorreia primária incluem: falência ovariana (por exemplo, síndrome de Turner: 48,5% dos casos), malformações uterovaginais (anomalias müllerianas: 16,2% dos casos), disfunção do eixo hipotálamo-hipófise-ovariano (8,3% dos casos), atraso constitucional ou familiar (6% dos casos). Outras causas menos comuns, como desnutrição, psiquiátrica, infecções, são responsáveis por 21% dos casos(27). Síndrome de Turner Meninas com cariótipo 45 X0 (cerca de 70% dos casos) vão apresentar útero pré-púbere e ovários que não podem ser identificados à ultrassonografia ou ovários em fita(28,29). Em casos raros, particularmente naqueles em que o cariótipo é do tipo mosaico, os ovários podem ter aparência ecográfica normal(30). Puberdade espontânea pode ocorrer em até 20% dos casos(31). Malformações uterovaginais (anomalias müllerianas) Os ductos paramesonéfricos (müllerianos) se desenvolvem entre a 5ª e 6ª semanas de idade gestacional e começam a fusão em torno da 8ª semana na linha média, para formar o canal uterovaginal. Durante a fusão, o canal uterovaginal atinge o seio urogenital ao mesmo tempo em que a placa vaginal se desenvolve distalmente. Desta maneira, a vagina é formada tanto pelos ductos paramesonéfricos (2/3 ou 4/5 superiores) quanto pelo seio urogenital(32). A agenesia mülleriana (síndrome de Mayer-Rokitansky-Kuster-Hauser) é a segunda causa mais comum de infertilidade feminina primária, sendo a primeira a disgenesia gonadal(33). Ecograficamente, esta síndrome se caracteriza por atresia vaginal associada a ausência do útero ou útero rudimentar e ovários normais. Malformações renais (agenesia, ectopia) ocorrem em até 50% dos casos, e malformações ósseas, em até 12% dos casos. Em 6% a 10% destas mulheres, um pouco de endométrio funcional e um pequeno útero podem estar presentes, podendo ocorrer hematométrio. Malformações obstrutivas A maioria dos casos de hidrometrocolpo congênito está associada com malformação do seio urogenital. Obstruções uterovaginais podem ser identificadas ainda durante a vida fetal, no terceiro trimestre, como massa abdomino-pélvica (Figura 6). Há frequentemente obstrução renal associada. Adolescentes com anomalias obstrutivas normalmente apresentam amenorreia primária e dor abdominal cíclica. A ultrassonografia nestes casos é útil para diferenciar os casos de hematometrocolpo devido a hímen imperfurado ou septo vaginal transverso de hematométrio devido a agenesia cervical(34). A diferenciação destes casos é muito importante para explicar sobre o prognóstico, uma vez que o hematometrocolpo resolve-se após a desobstrução, enquanto o hematométrio, devido a agenesia cervical, geralmente é tratado com histerectomia.
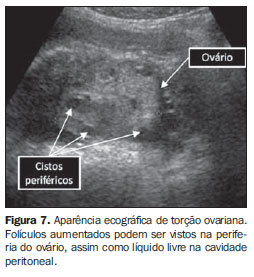
Aproximadamente 45% dos septos vaginais ocorrem no terço superior da vagina, 40% no terço médio e apenas 15% no terço inferior(35). A presença de hemivagina obstruída com duplicação uterina, síndrome de Herlyn-Werner-Wunderlich, é quase sempre associada com agenesia renal ipsilateral(36). Ao exame clínico, dor abdominal cíclica, por causa da obstrução, está presente concomitantemente com ciclos menstruais regulares, o que normalmente pode retardar o diagnóstico correto. A obstrução vaginal completa deve ser tratada com urgência, devido ao risco de endometriose e comprometimento da capacidade reprodutiva. Malformações não obstrutivas As principais malformações não obstrutivas resultam de falhas na fusão ou reabsorção dos ductos paramesonéfricos, resultando em úteros septados, bicornos, didelfos e unicornos. A ultrassonografia bidimensional pode suspeitar sobre o tipo de defeito, que pode ser mais bem avaliado com a ultrassonografia tridimensional(37). ULTRASSONOGRAFIA: MASSAS E DOR PÉLVICA A ultrassonografia é a modalidade inicial na avaliação de crianças e adolescentes com dor pélvica. Torção e massas ovarianas A torção ovariana é mais comum em pacientes com fatores predisponentes como cistos ou massas ovarianas(38). Em crianças a torção ovariana pode ocorrer pelo fato de a tuba uterina ser relativamente mais longa e o ovário, mais móvel. A torção de ovário normal ocorre principalmente por causa da mobilidade excessiva do ovário na pelve infantil. O ovário torcido apresenta múltiplos folículos aumentados na periferia (Figura 7)(39). O estudo Doppler colorido não é uma ferramenta confiável na avaliação da torção ovariana. Fluxo arterial periférico e/ou central podem ser demonstrados ao estudo Doppler em torções ovarianas com comprovação cirúrgica, o que pode ser explicado pela duplicidade da vascularização ovariana. Devido ao atraso diagnóstico, já que dor pélvica em crianças raramente é investigada de maneira rápida, uma quantidade muito pequena dos ovários torcidos pode ser salva durante a cirurgia.
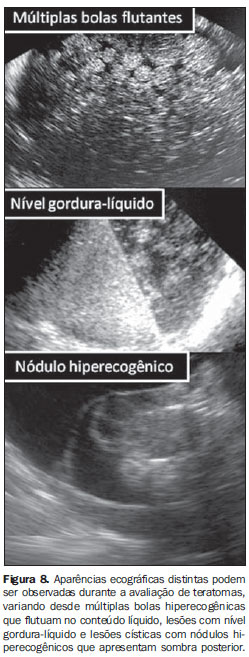
As massas ovarianas em crianças ocorrem principalmente devido a cistos funcionais (foliculares: 60%) e neoplasias (40%). Dois terços das neoplasias são benignas, comumente teratomas, ao passo que um terço delas é maligna. No exame ultrassonográfico os teratomas apresentam características diversas (Figura 8), o que pode dificultar o diagnóstico. A análise histológica dos tumores ovarianos malignos revela uma prevalência de 60% a 75% de tumores de células germinativas, tumores epiteliais em 10% a 20% dos casos e tumores estromais em aproximadamente 10%(38,40). Em crianças e adolescente, os teratomas ovarianos podem levar a torção em cerca de 30% dos casos e são bilaterais em 10%.
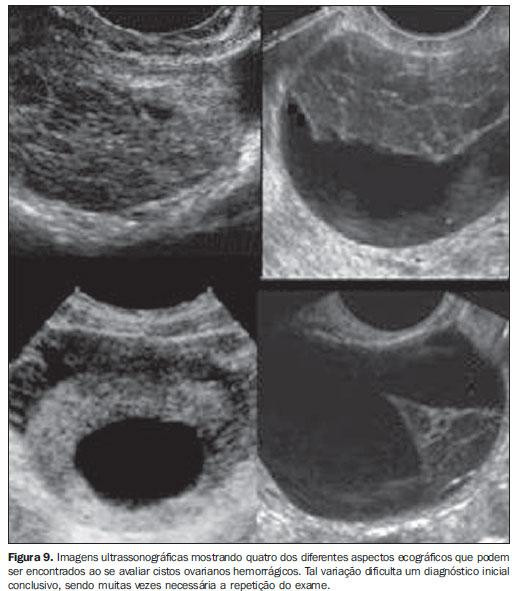
A ultrassonografia mostra nódulos da parede em 55% dos casos e focos ecogênicos com sombra posterior em 44% dos casos. Alguns achados ecográficos como ascite, implantes peritoneais, linfadenopatia ou metástases hepáticas podem sugerir malignidade. As características ecográficas da lesão não sugerem malignidade, o que dificulta o diagnóstico. Cistos ovarianos hemorrágicos Dor pélvica aguda no meio do ciclo é clinicamente sugestiva de hemorragia decorrente da ovulação, que ocorre durante a formação do corpo lúteo. A ultrassonografia mostra massa ovariana complexa com reforço acústico posterior, devido à natureza líquida do conteúdo, sendo frequentemente associada com a presença de líquido livre em fundo de saco vaginal. Entretanto, a aparência ecográfica destes cistos pode variar bastante (Figura 9). Durante o seguimento ecográfico, tais cistos tornam-se anecoicos na maior parte dos casos(41).
Doença inflamatória pélvica A doença inflamatória pélvica, ou abscesso tubo-ovariano, é encontrada em adolescentes sexualmente ativas e pode ser reconhecida pelos achados clínicos (dor pélvica, febre, dor à mobilização cervical, rigidez anexial). A ultrassonografia é útil para detectar complicações como abscessos tubo-ovarianos, hidrossalpinges e piossalpinges. Gravidez ectópica A incidência de prenhez ectópica é muita baixa entre adolescentes, todavia, nesta faixa etária, apresenta a maior taxa de mortalidade(8). Assim como em adultos, o diagnóstico deve ser feito baseando-se na presença de qualquer massa anexial associada a um teste de gravidez positivo.
CONSIDERAÇÕES FINAIS A ultrassonografia se mostra como modalidade de escolha na avaliação inicial da pelve feminina na infância e adolescência, situação em que o exame clínico é muito limitado, pois o exame de toque vaginal não pode ser realizado, e muitas vezes os clínicos não se sentem confortáveis em realizar exame pela via retal. A ultrassonografia pode fornecer valiosas informações sobre a pelve, permitindo o direcionamento de tratamentos clínicos e cirúrgicos. Para isso, é muito importante que os profissionais tenham conhecimento específico das mudanças que ocorrem na pelve feminina durante a infância e adolescência, evitando diagnósticos imprecisos.
REFERÊNCIAS 1. Ziereisen F, Guissard G, Damry N, et al. Sonographic imaging of the paediatric female pelvis. Eur Radiol. 2005;15:1296-309. [ ] 2. Nussbaum AR, Sanders RC, Jones MD. Neonatal uterine morphology as seen on real-time US. Radiology. 1986;160:641-3. [ ] 3. Hata K, Nishigaki A, Makihara K, et al. Ultrasonic evaluation of the normal uterus in the neonate. J Perinat Med. 1989;17:313-7. [ ] 4. Cohen HL, Shapiro MA, Mandel FS, et al. Normal ovaries in neonates and infants: a sonographic study of 77 patients 1 day to 24 months old. AJR Am J Roentgenol. 1993;160:583-6. [ ] 5. Cohen HL, Eisenberg P, Mandel F, et al. Ovarian cysts are common in premenarchal girls: a sonographic study of 101 children 2-12 years old. AJR Am J Roentgenol. 1992;159:89-91. [ ] 6. Holm K, Laursen EM, Brocks V, et al. Pubertal maturation of the internal genitalia: an ultrasound evaluation of 166 healthy girls. Ultrasound Obstet Gynecol. 1995;6:175-81. [ ] 7. Orbak Z, Sağsöz N, Alp H, et al. Pelvic ultrasound measurements in normal girls: relation to puberty and sex hormone concentration. J Pediatr Endocrinol Metab. 1998;11:525-30. [ ] 8. Garel L, Dubois J, Grignon A, et al. US of the pediatric female pelvis: a clinical perspective. Radiographics. 2001;21:1393-407. [ ] 9. Badouraki M, Christoforidis A, Economou I, et al. Evaluation of pelvic ultrasonography in the diagnosis and differentiation of various forms of sexual precocity in girls. Ultrasound Obstet Gynecol. 2008;32:819-27. [ ] 10. Martins WP, Nastri CO. Ultrasonographic measurement of ovarian volume in the diagnosis of central precocious puberty. Ultrasound Obstet Gynecol. 2009;34:484-5. [ ] 11. Ziereisen F, Heinrichs C, Dufour D, et al. The role of Doppler evaluation of the uterine artery in girls around puberty. Pediatr Radiol. 2001;31:712-9. [ ] 12. Golestani R, Sheikhvatan M, Behpour AM, et al. Relationship between uterine and ovarian arterial blood flow measured by Doppler sonography at different stages of puberty. Taiwan J Obstet Gynecol. 2008;47:62-5. [ ] 13. Buzi F, Pilotta A, Dordoni D, et al. Pelvic ultrasonography in normal girls and in girls with pubertal precocity. Acta Paediatr. 1998;87:1138-45. [ ] 14. Carel JC, Eugster EA, Rogol A, et al. Consensus statement on the use of gonadotropin-releasing hormone analogs in children. Pediatrics. 2009; 123:e752-62. [ ] 15. de Vries L, Horev G, Schwartz M, et al. Ultrasonographic and clinical parameters for early differentiation between precocious puberty and premature thelarche. Eur J Endocrinol. 2006;154:891-8. [ ] 16. Haber HP, Wollmann HA, Ranke MB. Pelvic ultrasonography: early differentiation between isolated premature thelarche and central precocious puberty. Eur J Pediatr. 1995;154:182-6. [ ] 17. Herter LD, Golendziner E, Flores JA, et al. Ovarian and uterine findings in pelvic sonography: comparison between prepubertal girls, girls with isolated thelarche, and girls with central precocious puberty. J Ultrasound Med. 2002;21:1237-46; quiz 1247-8. [ ] 18. Ambrosino MM, Hernanz-Schulman M, Genieser NB, et al. Monitoring of girls undergoing medical therapy for isosexual precocious puberty. J Ultrasound Med. 1994;13:501-8. [ ] 19. Jensen AM, Brocks V, Holm K, et al. Central precocious puberty in girls: internal genitalia before, during, and after treatment with long-acting gonadotropin-releasing hormone analogues. J Pediatr. 1998;132:105-8. [ ] 20. Rodriguez-Macias KA, Thibaud E, Houang M, et al. Follow up of precocious pseudopuberty associated with isolated ovarian follicular cysts. Arch Dis Child. 1999;81:53-6. [ ] 21. Fakhry J, Khoury A, Kotval PS, et al. Sonography of autonomous follicular ovarian cysts in precocious pseudopuberty. J Ultrasound Med. 1988;7:597-603. [ ] 22. Lee HJ, Woo SK, Kim JS, et al. "Daughter cyst" sign: a sonographic finding of ovarian cyst in neonates, infants, and young children. AJR Am J Roentgenol. 2000;174:1013-5. [ ] 23. Caspi B, Zalel Y, Katz Z, et al. The role of sonography in the detection of vaginal foreign bodies in young girls: the bladder indentation sign. Pediatr Radiol. 1995;25 Suppl 1:S60-1. [ ] 24. Martelli H, Oberlin O, Rey A, et al. Conservative treatment for girls with nonmetastatic rhabdomyosarcoma of the genital tract: a report from the Study Committee of the International Society of Pediatric Oncology. J Clin Oncol. 1999;17:2117-22. [ ] 25. Andrassy RJ, Wiener ES, Raney RB, et al. Progress in the surgical management of vaginal rhabdomyosarcoma: a 25-year review from the Intergroup Rhabdomyosarcoma Study Group. J Pediatr Surg. 1999;34:731-4; discussion 734-5. [ ] 26. Castellino SM, McLean TW. Pediatric genitourinary tumors. Curr Opin Oncol. 2007;19:248-53. [ ] 27. Timmreck LS, Reindollar RH. Contemporary issues in primary amenorrhea. Obstet Gynecol Clin North Am. 2003;30:287-302. [ ] 28. Morgan T. Turner syndrome: diagnosis and management. Am Fam Physician. 2007;76:405-10. [ ] 29. Haber HP, Ranke MB. Pelvic ultrasonography in Turner syndrome: standards for uterine and ovarian volume. J Ultrasound Med. 1999;18:271-6. [ ] 30. Mazzanti L, Nizzoli G, Tassinari D, et al. Spontaneous growth and pubertal development in Turner's syndrome with different karyotypes. Acta Paediatr. 1994;83:299-304. [ ] 31. Massa G, Heinrichs C, Verlinde S, et al. Late or delayed induced or spontaneous puberty in girls with Turner syndrome treated with growth hormone does not affect final height. J Clin Endocrinol Metab. 2003;88:4168-74. [ ] 32. Gell JS. Müllerian anomalies. Semin Reprod Med. 2003;21:375-88. [ ] 33. Chandiramani M, Gardiner CA, Padfield CJ, et al. Mayer-Rokitansky-Kuster-Hauser syndrome. J Obstet Gynaecol. 2006;26:603-6. [ ] 34. Blask AR, Sanders RC, Rock JA. Obstructed uterovaginal anomalies: demonstration with sonography. Part II. Teenagers. Radiology. 1991; 179:84-8. [ ] 35. Rackow BW, Arici A. Reproductive performance of women with müllerian anomalies. Curr Opin Obstet Gynecol. 2007;19:229-37. [ ] 36. Orazi C, Lucchetti MC, Schingo PM, et al. Herlyn-Werner-Wunderlich syndrome: uterus didelphys, blind hemivagina and ipsilateral renal agenesis. Sonographic and MR findings in 11 cases. Pediatr Radiol. 2007;37:657-65. [ ] 37. Ferreira AC, Mauad Filho F, Nicolau LG, et al. Ultra-sonografia tridimensional em ginecologia: malformações uterinas. Radiol Bras. 2007;40:131-6. [ ] 38. Schultz KA, Ness KK, Nagarajan R, et al. Adnexal masses in infancy and childhood. Clin Obstet Gynecol. 2006;49:464-79. [ ] 39. Breech LL, Hillard PJ. Adnexal torsion in pediatric and adolescent girls. Curr Opin Obstet Gynecol. 2005;17:483-9. [ ] 40. Gribbon M, Ein SH, Mancer K. Pediatric malignant ovarian tumors: a 43-year review. J Pediatr Surg. 1992;27:480-4. [ ] 41. Swire MN, Castro-Aragon I, Levine D. Various sonographic appearances of the hemorrhagic corpus luteum cyst. Ultrasound Q. 2004;20:45-58. [ ]
Recebido para publicação em 13/6/2009.
* Trabalho realizado na Escola de Ultra-sonografia de Ribeirão Preto (EURP) e no Departamento de Ginecologia e Obstetrícia do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), Ribeirão Preto, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554