Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 41 nº 2 - Mar. / Abr. of 2008
Vol. 41 nº 2 - Mar. / Abr. of 2008
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Antonio Carlos Vieira Lopes, Kleber Pimentel, Maria Betânia Pereira Toralles, Alessandro de Moura Almeida, Luciana Vieira Lopes, Edward Araújo Júnior, Luciano Marcondes Machado Nardozza, Antonio Fernandes Moron |
|
|
Descritores: Medição da translucência nucal, Ducto venoso, Osso nasal, Idade materna, Trissomia |
|
|
Resumo: VMédica da Clínica Dr. Antonio Carlos Vieira Lopes, Salvador, BA, Brasil
INTRODUÇÃO Em 1866, Langdon Down descreveu que, em indivíduos com trissomia 21, a pele parecia ser redundante para o corpo, o nariz fino e a face plana(1). Durante os últimos anos, diversos estudos têm proposto técnicas não–invasivas para o diagnóstico pré–natal de anormalidades cromossômicas, baseadas tanto em achados ultra–sonográficos quanto em testes bioquímicos maternos. Estudos randomizados têm demonstrado que os exames invasivos para pesquisa cariotípica, tanto a amniocentese quanto a biópsia de vilo corial, apresentam risco de abortamento em torno de 1%(2,3). No Brasil, os testes bioquímicos maternos estão restritos a poucos serviços particulares e têm altos custos, de forma que a pesquisa ultra–sonográfica de primeiro trimestre torna–se o principal método para o rastreamento de anormalidades cromossômicas. A idade materna (IM) avançada é um fator de risco para anormalidades cromossômicas (trissomias 13, 18 e 21). Como os fetos com anormalidades cromossômicas mais freqüentemente morrem intra–útero, o risco diminui com o avançar da idade gestacional(4,5). A translucência nucal (TN) apresenta–se como uma imagem ultra–sonográfica hipoecogênica, decorrente do acúmulo de líquido na região posterior do pescoço, que ocorre com maior exuberância entre a 10ª e 14ª semanas de gestação(6). Desde o início da década de 90, diversos estudos têm mostrado a associação entre aumento da espessura da TN e a presença de anormalidades cromossômicas(7,8). Uma falência cardíaca precoce nos fetos com anormalidades cromossômicas é proposta como um possível mecanismo do aumento na medida da TN(9). Dessa forma, a avaliação do fluxo no ducto venoso (DV) pode refletir este estado hemodinâmico. Há relatos, na literatura, que alterações no padrão de fluxo do DV (fluxo ausente ou reverso) apresentam alta sensibilidade com baixa taxa de falso–positivo na detecção de anormalidades cromossômicas(10). Inclusive, a presença de um padrão de fluxo anormal no DV em um feto com aumento na medida da TN aumenta o risco de esse feto apresentar anormalidade cromossômica(11). Diversos estudos têm demonstrado alta associação de ausência de osso nasal (ON) entre 11 e 13 semanas e seis dias com trissomia 21(12–14). Recentemente, demonstrou–se que a associação da avaliação do ON e do fluxo no DV à medida da TN, em fetos com alto risco de anormalidades cromossômicas, tem o potencial de aumentar a sensibilidade do screening para trissomia 21 em 2% a 4% ou reduzir pela metade a taxa de falso–positivo(15). O objetivo deste estudo é avaliar o potencial da IM > 35 anos, da medida da TN, da avaliação do ON e do fluxo no DV em uma população de fetos com alto risco para anormalidades cromossômicas entre 12 e 14 semanas, de forma a se verificar o teste, ou a combinação de testes, que apresente a maior associação com anormalidades cromossômicas.
MATERIAIS E MÉTODOS Realizou–se estudo prospectivo observacional entre janeiro de 2002 e setembro de 2004 com 92 gestantes entre 12 e 14 semanas, encaminhadas ao serviço para pesquisa de cariótipo fetal. Todas as pacientes concordaram com a participação no estudo, sendo este aprovado pelo Comitê de Ética em Pesquisa da Instituição. Os procedimentos foram realizados na Clínica Dr. Antonio Carlos Vieira Lopes, que é centro de referência em medicina fetal na Bahia, e na Maternidade Climério de Oliveira da Universidade Federal da Bahia. As coletas de vilo corial para as pesquisas cariotípicas foram realizadas por meio de biópsia de vilo corial transabdominal e por um único examinador. Para a análise citogenética utilizou–se a técnica de bandeamento G(16) e estudo molecular por reação de cadeia de polimerase para os cromossomos 13, 16, 18, 21, 22, X e Y(17). Os critérios utilizados para a realização de biópsia de vilo corial foram o aumento na medida da TN (risco maior que 1:300) ou IM acima de 35 anos. Os exames ultra–sonográficos foram realizados por via abdominal em aparelho da marca Aloka modelo SSD–2000, equipado com transdutor convexo multifreqüencial (3,5 MHz a 5,0 MHz) por dois ultra–sonografistas experientes na avaliação de marcadores de cromossomopatias do primeiro trimestre. Para a aferição da TN, utilizou–se corte sagital do feto, o mesmo utilizado para a medida do comprimento cabeça–nádega, entre 45–84 mm, feto em posição neutra, imagem fetal ocupando 75% da tela do monitor, calipers posicionados no interior do espaço anecóico compreendido entre a pele fetal e o tecido subcutâneo que recobre a coluna cervical. Foram realizadas três medidas em cada feto, sendo utilizada a maior delas. Para a avaliação do DV, utilizou–se inicialmente o Doppler colorido para a localização do vaso. As ondas de velocidade de fluxo do DV foram obtidas em um plano médio–sagital do tronco fetal, com ângulo de insonação inferior a 30°, imediatamente distal ao sino portal e proximal ao infundíbulo da veia cava inferior. Tal técnica evita a contaminação do fluxo proveniente da porção intra–hepática da veia umbilical, veia hepática esquerda e veia cava inferior. As ondas de fluxo do DV foram categorizadas como sendo normais (fluxo positivo) ou anormais (fluxo ausente ou reverso), de acordo com os padrões de fluxo sanguíneo durante a contração atrial. Para a avaliação do ON efetuou–se corte médio–sagital da face fetal, com o dorso posicionado posteriormente, e leve flexão da cabeça. Duas linhas ecogênicas do perfil do nariz fetal devem ser visualizadas: a linha ecogênica superficial é a pele fetal, e a linha ecogênica profunda é o ON. Se o exame foi tecnicamente satisfatório e o ON foi visualizado, é classificado como presente. Se o ON não foi visualizado, este é classificado como ausente. Os dados foram alocados em uma planilha do programa Excel (Windows XP, Microsoft) e analisados por intermédio do programa estatístico SPSS versão 9.0 para Windows (SPSS Inc.; Chicago, IL, USA). Para as variáveis contínuas foram calculados a média e o desvio–padrão, e para as variáveis categóricas foi calculado o percentual. Para se determinar a acurácia diagnóstica dos testes, foram calculados a sensibilidade, a especificidade, o valor preditivo positivo e o valor preditivo negativo, com intervalo de 95% de confiança (95%IC). Os testes diagnósticos foram avaliados tanto isoladamente como em paralelo e em seqüência.
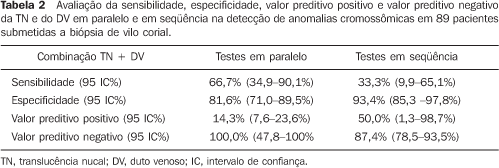
RESULTADOS Das 92 gestantes submetidas à biópsia de vilo corial, não houve crescimento celular em três casos, os quais foram excluídas do estudo. Nas 89 gestantes em que se obteve o resultado do cariótipo fetal, encontrou–se alteração cromossômica em 12 fetos (13,5%). Desses 12 fetos com alterações cromossômicas, sete (58,3%) eram casos de trissomia do cromossomo 21, um (8,3%) era de trissomia do 18, um (8,3%) era de trissomia do 22, dois (16,6%) eram casos de 47XXY e um (8,3%) era de marcador cromossômico 46 XY inv (9) (gh). A IM variou de 25 a 47 anos, com média de 36,2 anos e desvio–padrão de 4,6 anos. Das 89 gestantes, 67 (75,3%) apresentavam idade maior ou igual a 35 anos e 22 (24,7%) apresentavam idade inferior a essa. A idade gestacional à época da biópsia de vilo corial variou de 12 a 14 semanas, com média de 13 semanas e desvio–padrão de 0,79. A principal indicação para a realização de biópsia de vilo corial foi a IM > 35 anos em 72 gestantes (78,3%), seguida de alto risco (maior que 1:300) de trissomia 21 baseado na medida da TN em 16 gestantes (17,4%); outras causas, como filho anterior com doenças genéticas, malformações em filhos anteriores, achados de alterações morfológicas fetais em exame ultra–sonográfico, perfizeram 4,3% das indicações de biópsia de vilo corial. A medida da TN foi possível em todos os casos, sendo esta realizada apenas por via transabdominal. A avaliação do fluxo no DV foi possível em todos os casos. A proporção de fluxo alterado (onda A zero ou reversa) foi de 6 em 77 fetos normais (7,8%), sendo que no grupo de fetos que apresentavam cromossomopatias esta proporção foi de 5 em 12 fetos (41,7%). A avaliação do ON foi possível em todos os casos, estando presente em todos os fetos, tanto normais quanto em portadores de alterações cromossômicas. A Tabela 1 mostra a sensibilidade, a especificidade, o valor preditivo positivo e o valor preditivo negativo da TN, do DV e da IM, isoladamente, na detecção de anormalidades cromossômicas. A Tabela 2 mostra a sensibilidade, a especificidade, o valor preditivo positivoe o valor preditivo negativo da TN combinada ao DV, tanto em paralelo quanto em seqüência, na detecção de anormalidades cromossômicas.
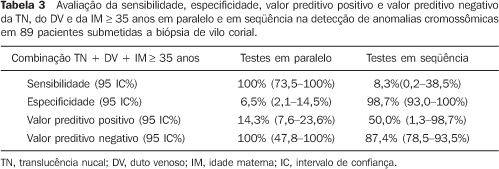
A Tabela 3 avalia a sensibilidade, a especificidade, o valor preditivo positivo e o valor preditivo negativo da TN combinada com o DV e a IM, tanto em paralelo quanto em seqüência, na detecção de anormalidades cromossômicas.
DISCUSSÃO O risco para muitas anormalidades cromossômicas aumenta com a IM, porém, como os fetos com anormalidades cromossômicas apresentam maior freqüência de morte intra–uterina, o risco diminui com o avançar da idade gestacional(4,5,18). A IM foi o primeiro marcador adotado como método de rastreamento de trissomia 21, com taxa de detecção de 30% e taxa de falso–positivo de 5%(19). Snijders et al.(4) avaliaram 57.614 gestantes entre 9 e 16 semanas, com 35 ou mais anos de idade, sendo que desse total 538 fetos apresentavam trissomia 21. Observaram que o risco de trissomia 21 aumenta com a IM e diminui com a idade gestacional. A prevalência de trissomia 21 entre 12 e 16 semanas foi de 30%, enquanto com 40 semanas foi de 21%. Em nosso estudo, o uso isolado da IM como teste diagnóstico para anormalidades cromossômicas apresentou baixa sensibilidade (58,33%), com valor preditivo positivo baixo (10,45%), mostrando–se de pouca importância para o rastreamento quando utilizada isoladamente. A TN foi descrita, inicialmente, por Nicolaides et al.(6) como um acúmulo de líquido na nuca fetal, sendo que este acúmulo de líquido entre 11 e 14 semanas de gestação está presente em 75% dos fetos com trissomias 18 e 21. Diversos estudos prospectivos que se seguiram comprovaram a associação de elevação da medida da TN com trissomia 21, com taxas de detecção que variaram de 58,3% a 100%(20–23), com taxa de falso–positivo em torno de 5%. A TN, da mesma forma que a IM, apresentou sensibilidade moderada (58,33%) e baixo valor preditivo positivo (35%). Uma possível explicação para a baixa sensibilidade pode ser o pequeno número de casos com anormalidades cromossômicas analisados, resultado este que está de acordo com a maioria dos estudos preliminares(24–26). Utilizando como nível de corte da medida da TN o valor maior ou igual a 3,0 mm, a taxa de detecção de anormalidades cromossômicas variou de 17,6% a 48,8%(24–26). Um estudo mostrou que a inclusão da avaliação do fluxo no DV à combinação da IM e medida da TN entre 10 e 16 semanas de gestação pode diminuir a taxa de falso–positivos no rastreamento de anormalidades cromossômicas(27). Em nosso estudo, o uso isolado da avaliação do fluxo no DV teve sensibilidade de apenas 41,67% na detecção de anormalidades cromossômicas. Não há consenso, na literatura, sobre a importância do uso da avaliação do fluxo no DV na detecção de anormalidades cromossômicas no primeiro trimestre de gestação, com taxas de sensibilidade que variam de 65% a 93,1%(10,27). Antolín et al.(27) avaliaram 1.371 gestantes de baixo risco entre 10 e 16 semanas usando a medida da TN e a avaliação do fluxo do DV no rastreamento para anormalidades cromossômicas. A avaliação isolada do fluxo no DV teve taxa de detecção global de 65%, com falso–positivo de 4,3%. Murta et al.(10) avaliaram 372 fetos de baixo risco entre 10 e 14 semanas, obtendo 29 com anormalidades cromossômicas. O fluxo no DV encontrou–se alterado (onda A zero ou reversa) em 93,1% dos fetos com anormalidades cromossômicas e em apenas 1,7% dos fetos normais. No que diz respeito à avaliação do ON, diversos estudos mostram a associação de ausência de visualização do ON no primeiro trimestre e aumento na taxa de detecção de trissomia 21, com taxa variando de 60% a 72,9%, e taxa de falso–positivo em torno de 5%(13,28,29). Diferentemente desses estudos, em nossa casuística a avaliação do ON não se mostrou teste sensível para a detecção de anormalidades cromossômicas, pois esteve presente em todos os casos de cromossomopatias. Nossos resultados estão de acordo com os obtidos por Malone et al.(30), que obtiveram sensibilidade de apenas 7,7% para a ausência do ON na detecção de trissomia 21, ou seja, o ON foi descrito como presente em 9 de 11 fetos com trissomia 21 (82%). Uma possível explicação para a falta de sensibilidade do ON pode ter sido a pequena amostra de casos com anormalidades cromossômicas, com apenas sete fetos com trissomia 21; além do mais, a incidência do ON varia de acordo com a raça e a etnia(31). Com base nesse fato, torna–se prematuro afirmar ser a ausência do ON um marcador fraco para a detecção de trissomia 21 no primeiro trimestre de gestação.
CONCLUSÃO Baseado em nossos resultados, os usos isolados da TN, do DV, do ON e da IM não se mostraram com sensibilidade suficiente para serem utilizados no rastreamento de cromossomopatias no primeiro trimestre da gravidez. A avaliação da TN e do DV em paralelo, ou seja, um dos dois testes estando positivo, aumentou a sensibilidade de detecção de anomalias cromossômicas para 66,7%, com valor preditivo positivo de 14,29%. O grande benefício dessa associação ocorre quando, em uma paciente, ambos estejam negativos, pois neste caso há altíssima probabilidade (100%) de que o feto não apresente anomalia cromossômica. A avaliação em paralelo da TN, do DV e da IM apresentou a maior sensibilidade (100%), entretanto, com valor valor preditivo positivo baixo. De acordo com nossos resultados, a melhor opção para o rastreamento de cromossomopatias no primeiro trimestre seria a combinação em paralelo da TN, do DV e da IM. Nos casos em que a IM fosse igual ou superior 35 anos, se verificaria a TN e o DV. Se estes dois testes estiverem alterados, há evidência importante que sugere a necessidade de propedêutica invasiva para a realização de cariótipo fetal. Caso apenas um destes testes esteja alterado, deve–se, mesmo assim, oferecer ao casal uma propedêutica invasiva para a confirmação do cariótipo fetal, haja vista que, isoladamente, a taxa de falso–positivo da TN é alta (16,88%) e a taxa de falso–positivo do DV é de 8%.
REFERÊNCIAS 1. Langdon Down J. Observations on an ethnic classification of idiots. Clinical and Reports London Hospital. 1866;3:259–62. [ ] 2. Smidt–Jensen S, Permin M, Philip J, et al. Randomised comparison of amniocentesis and transabdominal and transcervical chorionic villus sampling. Lancet. 1992;340:1237–44. [ ] 3. Nicolaides K, Brizot Mde L, Patel F, et al. Comparison of chorionic villus sampling and amniocentesis for fetal karyotyping at 10–13 weeks' gestation. Lancet. 1994;344:435–9. [ ] 4. Snijders RJM, Sundberg K, Holzgreve W, et al. Maternal age and gestation–specific risk for trisomy 21. Ultrasound Obstet Gynecol. 1999;13: 167–70. [ ] 5. Snijders RJM, Sebire NJ, Nicolaides KH. Maternal age and gestational age–specific risks for chromosomal defects. Fetal Diagn Ther. 1995;10: 356–67. [ ] 6. Nicolaides KH, Azar G, Snijders RJ, et al. Fetal nuchal oedema: associated malformations and chromosomal defects. Fetal Diagn Ther. 1992;7: 123–31. [ ] 7. Pandya PP, Snijders RJ, Johnson SP, et al. Screening for fetal trisomies by maternal age and fetal nuchal translucency thickness at 10 to 14 weeks of gestation. Br J Obstet Gynaecol. 1995;102:957–62. [ ] 8. Pandya PP, Goldberg H, Walton B, et al. The implementation of the first trimester scanning at 10–13 weeks' gestation and the measurement of fetal nuchal translucency thickness in two maternity units. Ultrasound Obstet Gynecol. 1995;5:20–5. [ ] 9. Montenegro N, Matias A, Areias JC, et al. Increased fetal nuchal translucency: possible involvement of early cardiac failure. Ultrasound Obstet Gynecol. 1997;10:265–8. [ ] 10. Murta CG, Moron AF, Avila MA, et al. Application of ductus venosus Doppler velocimetry for the detection of fetal aneuploidy in the first trimester of pregnancy. Fetal Diagn Ther. 2002;17: 308–14. [ ] 11. Zoppi MA, Putzolu M, Ibba RM, et al. First–trimester ductus venosus velocimetry in relation to nuchal translucency thickness and fetal karyotype. Fetal Diagn Ther. 2002;17:52–7. [ ] 12. Cicero S, Curcio P, Papageorghiou A, et al. Absence of nasal bone in fetuses with trisomy 21 at 11–14 weeks of gestation: an observational study. Lancet. 2001;358:1665–7. [ ] 13. Otano L, Aiello H, Igarzábal L, et al. Association between first trimester absence of fetal nasal bone on ultrasound and Down syndrome. Prenat Diagn. 2002;22:930–2. [ ] 14. Zoppi MA, Ibba RM, Axiana C, et al. Absence of fetal nasal bone and aneuploidies at first–trimester nuchal translucency screening in unselected pregnancies. Prenat Diagn. 2003;23:496–500. [ ] 15. Prefumo F, Sethna F, Sairam S, et al. First–trimester ductus venosus, nasal bones, and Down syndrome in a high–risk population. Obstet Gynecol. 2005;105:1348–54. [ ] 16. Sanchez O, Escobar JI, Yunis JJ. A simple G–banding technique. Lancet 1973;2:269–71. [ ] 17. van den Berg C, Van Opstal D, Brandenburg H, et al. Accuracy of abnormal karyotypes after the analysis of both short– and long–term culture of chorionic villi. Prenat Diagn. 2000;20:956–69. [ ] 18. Snijders RJM, Holzgreve W, Cuckle H, et al. Maternal age–specific risks for trisomies at 9–14 weeks' gestation. Prenat Diagn. 1994;14:543–52. [ ] 19. Cuckle H. Integrating antenatal Down's syndrome screening. Curr Opin Obstet Gynecol. 2001;13: 175–81. [ ] 20. Audibert F, Dommergues M, Benattar C, et al. Screening for Down syndrome using first–trimester ultrasound and second–trimester maternal serum markers in a low–risk population: a prospective longitudinal study. Ultrasound Obstet Gynecol. 2001;18:26–31. [ ] 21. Chasen ST, Sharma G, Kalish RB, et al. First–trimester screening for aneuploidy with fetal nuchal translucency in a United States population. Ultrasound Obstet Gynecol. 2003;22:149–51. [ ] 22. Zoppi MA, Ibba RM, Floris M, et al. Fetal nuchal translucency screening in 12495 pregnancies in Sardinia. Ultrasound Obstet Gynecol. 2001;18: 649–51. [ ] 23. Wayda K, Keresztúri A, Orvos H, et al. Four years experience of first–trimester nuchal translucency screening for fetal aneuploidies with increasing regional availability. Acta Obstet Gynecol Scand. 2001;80:1104–9. [ ] 24. Comas C, Martinez JM, Ojuel J, et al. First–trimester nuchal edema as a marker of aneuploidy. Ultrasound Obstet Gynecol. 1995;5:26–9. [ ] 25. Ville Y, Lalondrelle C, Doumerc S, et al. First–trimester diagnosis of nuchal anomalies: significance and fetal outcome. Ultrasound Obstet Gynecol. 1992;2:314–6. [ ] 26. Trauffer PM, Anderson CE, Johnson A, et al. The natural history of euploid pregnancies with first–trimester cystic hygromas. Am J Obstet Gynecol. 1994;170:1279–84. [ ] 27. Antolín E, Comas C, Torrents M, et al. The role of ductus venosus blood flow assessment in screening for chromosomal abnormalities at 10–16 weeks of gestation. Ultrasound Obstet Gynecol. 2001;17:295–300. [ ] 28. Wong SF, Choi H, Ho LC. Nasal bone hipoplasia: is it a common finding amongst chromosomally normal fetuses of southern Chinese women? Gynecol Obstet Invest. 2003;56:99–101. [ ] 29. Cicero S, Sonek JD, McKenna DS, et al. Nasal bone hipoplasia in trisomy 21 at 15–22 weeks' gestation. Ultrasound Obstet Gynecol. 2003;21: 15–8. [ ] 30. Malone FD, Ball RH, Nyberg DA, et al. First–trimester nasal bone evaluation for aneuploidy in the general population. Obstet Gynecol. 2004; 104:1222–8. [ ] 31. Collado F, Bombard A, Li V, et al. Ethnic variation of fetal nasal bone length between 11–14 weeks' gestation. Prenat Diagn. 2005;25:690–2. [ ]
Recebido para publicação em 18/6/2007. Aceito, após revisão, em 24/7/2007.
* Trabalho realizado na Faculdade de Medicina da Universidade Federal da Bahia (UFBA), Salvador, BA, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554