Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 41 nº 1 - Jan. / Fev. of 2008
Vol. 41 nº 1 - Jan. / Fev. of 2008
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Jetro Pereira de Oliveira, Márcia Maria dos Santos Lopes, Luiz Antonio Ribeiro da Rosa, Léa Mirian Barbosa da Fonseca, Rossana Corbo |
|
|
Descritores: Medicina nuclear, Acompanhante, Quarto terapêutico, Dosímetro termoluminescente |
|
|
Resumo: VProfessora Adjunta do Departamento de Radiologia do Serviço de Medicina Nuclear do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), Rio de Janeiro, RJ, Brasil
INTRODUÇÃO A radioiodoterapia baseia-se no fato de que uma considerável porcentagem do tumor e/ou de metástases, provenientes de tumores diferenciados da tireóide, fixa ativamente o iodo-131 (131I), permitindo, dessa forma, a destruição do tumor, ou a redução do volume tumoral, após este receber altas doses de radiação. As maiores dificuldades estão na seleção dos pacientes, para que o tratamento seja eficaz, e o tipo de proteção radiológica a ser adotado. Nos últimos dez anos houve significativo desenvolvimento no campo do tratamento com radionuclídeos, mas é importante lembrar que a terapia com radionuclídeos na forma de 131I tem sido usada desde 1955(1). Um exemplo de procedimento terapêutico em medicina nuclear é o tratamento de tumores diferenciados da tireóide (papilífero e folicular). Pacientes, depois de serem tratados com a radioiodoterapia, apresentam grande índice de cura, mantendo-se livres da doença por mais de 30 anos. Mesmo o paciente com metástases a distância pode manter-se em controle estável por muitos anos(2). Ocorre, porém, que o 131I emite radiação gama de alta energia. Isto leva à exposição do meio ambiente, ao redor do paciente. Portanto, há a necessidade de se fazer o tratamento em regime de internação, em quarto especial, seguindo as normas de radioproteção da Comissão Nacional de Energia Nuclear (CNEN)(3,4). A CNEN é um órgão federal que tem por objetivo assegurar que as instalações que utilizam radiações ionizantes façam-no corretamente, dentro dos critérios e das normas de radioproteção. Isto vem garantir que os níveis de radiação sejam tão baixos quanto razoavelmente exeqüíveis, acarretando, conseqüentemente, a minimização da exposição às radiações ionizantes da população como um todo(5) . O critério atual de isolamento de um paciente da medicina nuclear que tenha recebido dose terapêutica de 131I acima de 1,11 GBq consiste na sua internação individual em quarto terapêutico. Caso seja necessário, é possível a internação de dois pacientes no mesmo quarto, mas neste caso é obrigatório o uso de barreira protetora entre os leitos (biombo blindado com chumbo). O quarto terapêutico, devidamente sinalizado e com acesso controlado, deve possuir paredes e pisos construídos com materiais impermeáveis que permitam a descontaminação, cantos arredondados, sanitário privativo e biombo blindado junto ao leito(3). O paciente pode ser liberado quando a atividade de 131I nele presente for igual ou inferior a 1,11 GBq(3), o que equivale a uma taxa de exposição de cerca de 1,8 µC/kg, medida com monitor de área modelo MIR, série 7026, fabricado pelo Instituto de Engenharia Nuclear/CNEN, a uma distância de 1 m da fonte de 131I. A legislação atual(4) regulamenta que as doses devem ser restritas de forma que seja improvável que acompanhantes recebam mais de 5 mSv durante o período de tratamento do paciente. O hipotireoidismo e o isolamento necessários para o tratamento, na maioria das vezes, trazem problemas psicológicos importantes, que tornam o procedimento muito penoso para os pacientes. Estes, muitas vezes, não toleram mais de uma internação. No caso de pacientes com dificuldades de locomoção, crianças ou pacientes com problemas psicológicos, estes são acompanhados por uma segunda pessoa, e ambos compartilham o quarto terapêutico. A pessoa, normalmente, pertence à família do paciente e, preferencialmente, não deve estar na idade fértil, ou não ter intenção de gerar filhos. O acompanhante e o paciente recebem orientações de radioproteção fornecidas pela equipe médica, por exemplo, aproximar-se do paciente somente quando necessário, evitando, assim, exposições desnecessárias à radiação ionizante do 131I presente no organismo do paciente. No caso de pacientes com câncer tireoidiano tratados com 5.550 MBq de 131I, Mathieu et al.(6) afirmam que, em média, a dose que uma pessoa recebe ao conviver com esse tipo de paciente por um período de 15 dias, após este receber alta hospitalar, é de 0,24 mSv. Coover et al.(7) relatam que pacientes são imediatamente liberados, para voltar para as suas residências, após receberem o 131I com atividades superiores aos 7.400 MBq. Esta nova rotina, do ponto de vista psicológico, vem proporcionando grande benefício ao paciente e a todos os seus amigos e familiares, além de minimizar a exposição à radiação ionizante de toda a equipe médica e diminuir os custos financeiros do tratamento, pois o paciente não fica mais retido no hospital. O objetivo deste trabalho é avaliar a dose recebida por um acompanhante de paciente em tratamento de câncer de tireóide com 131I, durante o período de internação (dois dias), uma vez que essa pessoa fica no mesmo quarto terapêutico com o paciente, e comparar os resultados obtidos com os limites de dose fixados em normas de proteção radiológica nacionais(3,4). Neste trabalho, a dose foi avaliada com o uso de dosímetro termoluminescente.
MATERIAIS E MÉTODOS Neste trabalho não se teve a preocupação de avaliar alguma possível contaminação do acompanhante, por exemplo, via de inalação de 131I ou pelo contato entre este radionuclídeo e a sua pele. Procurou-se, apenas, avaliar a dose recebida pelo acompanhante decorrente da exposição à radiação oriunda do paciente. Dois experimentos foram montados para avaliar as doses recebidas pelos acompanhantes de pacientes de medicina nuclear. No primeiro experimento, os acompanhantes foram monitorados com dosímetro termoluminescente, e no segundo experimento utilizou-se um simulador de acrílico, no qual se colocou o mesmo tipo de dosímetro, sendo o simulador posicionado no quarto terapêutico juntamente com o paciente. Optou-se por adotar o segundo porque, uma vez que é rara a internação de pacientes acompanhados, tal experimento possibilitou a obtenção de um maior número de medidas, melhorando a estatística dos resultados. Como se esperava que a dose recebida pelo acompanhante fosse baixa, usou-se um único dosímetro para a determinação da dose média, para uma determinada atividade de 131I administrada. Duas das atividades de 131I mais usadas no Brasil foram consideradas neste trabalho (3.700 MBq e 5.550 MBq). No período da investigação, não se teve a oportunidade de avaliar a dose em acompanhantes de pacientes que receberam atividade de 3.700 MBq. No entanto, todas as doses avaliadas envolvendo esta atividade foram obtidas com o uso do simulador. Seis acompanhantes de pacientes que receberam 5.550 MBq foram monitorados e a dose média obtida, nesta situação, é o quociente entre a dose total integrada, devido aos seis pacientes, e a quantidade de pacientes. Nos casos de medidas no simulador, 10 pacientes foram considerados para ambas as atividades. Portando, os valores das doses médias obtidas para 3.700 MBq e 5.550 MBq são o quociente entre a dose total integrada eo número de pacientes. Em todas essas situações de medidas foi colocado um biombo de chumbo entre os leitos do paciente e do acompanhante, ou simulador. Todas as pessoas envolvidas no experimento foram orientadas em relação aos objetivos do trabalho e esclarecidas a respeito dos procedimentos realizados. Após essa orientação, os pacientes e os acompanhantes foram instruídos a assinar o consentimento livre e esclarecido. Não houve seleção quanto a idade, sexo ou presença de outras doenças. Este trabalho foi submetido e aprovado pelo Comitê de Ética em Pesquisa da Instituição onde o trabalho foi desenvolvido. O estudo teve caráter longitudinal e o nível de confiança considerado foi de 99%, três desvios-padrão. As características do experimento foram a avaliação de valores de doses empregando dosímetros termoluminescentes. O simulador usado é feito de metacrilato de polimetila (acrílico), com paredes de 0,4 cm de espessura. Possui formato cilíndrico, com 8,0 cm de diâmetro e 13,0 cm de altura. Seu interior foi preenchido com água. Fixaram-se, com fita aderente, duas cápsulas de dosímetros termoluminescentes na parte externa de sua lateral. O simulador foi colocado sobre um leito a uma distância de 2,85 m do leito do paciente, permanecendo no mesmo local durante todo o período de internação (aproximadamente 48 horas). O material termoluminescente utilizado, em forma de pó, foi o fluoreto de lítio dopado com magnésio, titânio e sódio (LiF: Mg,Ti,Na). Esse composto é produzido pela Philitech (França), sob o código DTL937. É um material enriquecido com lítio-7 (7Li). Considerando os objetivos deste trabalho, ele apresenta características físicas apropriadas, incluindo desvanecimento pequeno à temperatura ambiente, de 5% ao ano. O tratamento térmico pré-irradiação utilizado na regeneração do material é de 450 °C durante três horas. O tratamento térmico pós-irradiação é realizado no próprio leitor termoluminescente, a uma temperatura de 125 °C, durante cinco segundos. Essa temperatura é inferior à de avaliação dos dosímetros termoluminescentes (440 °C). O forno utilizado para o tratamento térmico dos dosímetros é um ETT, fabricado pela Fimel (França). O pó termoluminescente, depois de irradiado, foi avaliado em uma leitora automática Fimel PCL3, que possui uma fotomultiplicadora RTC, modelo XP1122. Os dosímetros termoluminescentes foram calibrados com o uso de uma fonte de cobalto-60 (60Co). A energia média dos fótons emitidos pelo 131I é de 364 keV e, para essa energia, a dependência energética da resposta do DTL937 não é importante, podendo ser desconsiderada no cálculo da dose. Assim, o fator de calibração obtido para a energia da radiação gama do 60Co pode ser usado na determinação das doses devidas ao 131I sem correções adicionais. O pó termoluminescente foi confinado dentro de cápsulas cilíndricas de polietileno, com dimensões externas de 0,5 cm de diâmetro e 2,3 cm de comprimento. Uma pequena tampa impede que o pó escape da cápsula. Um par dessas cápsulas foi fixado com fita aderente (esparadrapo) na parte externa da vestimenta do acompanhante, na altura da caixa torácica. Este lugar foi escolhido para facilitar a reprodutibilidade do procedimento. As pessoas permaneceram com os dosímetros durante todo o período de internação, exceto durante o banho. Entre a cama do paciente e a do acompanhante ou simulador existe um biombo de chumbo com as seguintes características: comprimento de 1,07 m, altura de 1,06 m e profundidade de 2,0 cm. Depois do tratamento dos pacientes, 48 horas após a ingestão do material radioativo, os dosímetros foram recolhidos das vestimentas, ou do simulador, para uma avaliação posterior no laboratório de dosimetria termoluminescente. Este trabalho foi desenvolvido segundo as normas de proteção radiológica brasileiras(3,4). Adicionalmente, compararam-se as doses avaliadas com os dosímetros termoluminescentes posicionados sobre o simulador a 2,85 m do paciente, com resultados de cálculo realizados segundo os procedimentos apresentados pelas normas norte-americanas NRC-8.39 e 10CFR35.75(8,9). Neste caso não foi utilizado o biombo de chumbo entre o simulador e o paciente, de modo a reproduzir as condições de cálculo descritas nesses últimos documentos(8,9). Os cálculos e as medidas foram realizados para uma atividade de 131I de 5.550 MBq, a mais utilizada durante os tratamentos.
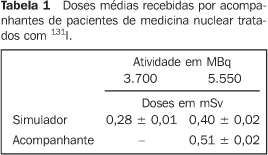
RESULTADOS A Tabela 1 mostra que ao se integrar as doses medidas por um par de dosímetros termoluminescentes fixados em um simulador, após este ser exposto a 10 pacientes que receberam atividades de 3.700 MBq de 131I, por um período de dois dias de internação, foi possível determinar uma dose média de (0,28 ± 0,01) mSv. Ao se submeter esse mesmo simulador com outro par de dosímetros a outros 10 pacientes que receberam atividades de 5.550 MBq de 131I por um período de 24 horas, esses dosímetros registraram dose integrada média de (0,40 ± 0,02) mSv. A Tabela 1 mostra, também, que ao fixar um mesmo par de dosímetros termoluminescentes na vestimenta de seis acompanhantes de pacientes que ingeriram 5.550 MBq de 131I, tendo acompanhantes e pacientes permanecido no mesmo quarto terapêutico por dois dias, os dosímetros registraram dose integrada média de (0,51 ± 0,02) mSv.
A dose máxima calculada, segundo as normas norte-americanas NRC-8.39 e 10CFR35.75(8,9), para um determinado ponto a 2,85 m de uma fonte pontual de 5.550 MBq de 131I, é de 0,42 mSv. Os três valores medidos por dosímetros termoluminescentes, fixados no simulador e situados à mesma distância de 2,85 m de pacientes que ingeriram a mesma atividade de 131I (5.550 MBq), foram de (1,24 ± 0,09) mSv, (0,98 ± 0,07) mSv e (0,99 ± 0,07) mSv, que fornecem valor médio de (1,07 ± 0,13) mSv.
DISCUSSÃO A diferença observada entre os valores médios das doses medidas nos acompanhantes e no simulador, quando compartilham o mesmo quarto terapêutico com pacientes tratados com 5.550 MBq de 131I, pode ser explicada pelo fato de o acompanhante deambular e, conseqüentemente, aproximar o seu dosímetro do paciente, enquanto os dosímetros fixados no simulador permanecem estáticos sobre o outro leito. Como era esperado, quanto maior a atividade de 131I administrada, maior a dose registrada pelo dosímetro termoluminescente. É importante enfatizar que todos os valores de dose medidos estão abaixo do limite estabelecido pela norma de radioproteção NN-3.01(4), que é de 5 mSv ao ano. Portanto, segundo as normas consideradas, sob o ponto de vista da proteção radiológica, não há impedimento algum para que uma pessoa acompanhe um paciente sob tratamento de câncer de tiróide com uso de 131I, tendo esse recebido atividades entre 3.700 MBq e 5.550 MBq. O fato da dose medida no simulador (1,08 ± 0,03) mSv ser maior que o valor da dose calculada (0,42 mSv) é explicado pelo fato da fonte não ser pontual, pois o radionuclídeo se distribui por todo o corpo do paciente, e qualquer movimento executado pelo paciente poderá aproximá-lo dos dosímetros, reduzindo a distância de 2,85 m, considerada para o cálculo da dose devida a uma fonte pontual. É importante ressaltar que, mesmo na ausência do biombo de chumbo, os valores medido e calculado estão aquém do valor limite de 5 mSv preconizado tanto pelas normas brasileiras(3,4) como pelas americanas(8,9). Os presentes resultados confirmam que a dose que uma pessoa recebe, ao compartilhar, por um período de dois dias, o mesmo quarto terapêutico com um paciente tratado com 3.700 MBq ou 5.550 MBq de 131I, não excede (0,51 ± 0,02) mSv. Portanto, pode-se afirmar que a dose recebida por tal pessoa está em concordância, sob o ponto de vista da radioproteção, com as normas brasileiras(3,4), que requerem que o acompanhante não receba, durante um exame ou tratamento, dose maior que 5 mSv ao ano. Os resultados do presente trabalho estão em concordância com os resultados de Mathieu et al.(6) , bem como com os de Coover et al.(7). De acordo, ainda, com os resultados do presente trabalho e do trabalho de Mathieu et al.(6), o acompanhante de um paciente que recebera 5.550 MBq de 131I receberá uma dose de cerca de 0,75 mSv após acompanhar o paciente durante 17 dias, ou seja, dois dias de internação (0,51 mSv) e mais 15 dias depois da alta médica (0,24 mSv). Como o acompanhante e o paciente compartilham o mesmo quarto terapêutico por um período de dois dias, é natural que o acompanhante se contamine com o 131I administrado ao paciente. O 131I é um radionuclídeo volátil que é liberado na respiração, pelos poros da pele, na saliva, nas fezes e na urina do paciente. Porém, como mencionado anteriormente, o presente trabalho não contemplou a avaliação da dose no acompanhante como decorrência de uma possível contaminação. Contudo, os resultados obtidos com os acompanhantes (0,51 ± 0,02) mSv e com o simulador (0,40 ± 0,02) mSv não parecem indicar uma contaminação importante dos acompanhantes, caso ela tenha realmente ocorrido. Agradecimentos O primeiro autor agradece à Coordenação de Aperfeiçoamento de Pessoas de Nível Superior (Capes), pelo suporte financeiro recebido, e a todas as pessoas que se prontificaram a ajudar a conceber este trabalho, bem como a Ana Maria de Oliveira Rebelo, supervisora de radioproteção do Serviço de Medicina Nuclear do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro, e ao Arnaldo Rangel Carvalho, técnico do Laboratório de Dosimetria Termoluminescente do Instituto de Radioproteção e Dosimetria da Comissão Nacional de Energia Nuclear.
REFERÊNCIAS 1. Chapman EM, Maloof F. The use of radioactive iodine in the diagnosis and treatment of hyperthyroidism: ten years' experience. Medicine (Baltimore). 1955;34:261–70. [ ] 2. Brucer M. Thyroid radioiodine uptake measurement. A standard system for universal intercalibration. USAEC Report. ORINS 1959;19. [ ] 3. CNEN-NE-3.05. Requisitos de radioproteção e segurança para serviços de medicina nuclear. Comissão Nacional de Energia Nuclear. [Acessado em: 28/2/2007]. Disponível em: http://www. cnen.gov.br/seguranca/normas/mostra-norma. asp?op=305 [ ] 4. CNEN-NN-3.01. Diretrizes básicas de proteção radiológica. Comissão Nacional de Energia Nuclear. [Acessado em: 28/2/2007]. Disponível em: http://www.cnen.gov.br/seguranca/normas/mostra-norma.asp?op=301 5. Mendes LCG, Fonseca LMB, Carvalho ACP. Proposta de método de inspeção de radioproteção aplicada em instalações de medicina nuclear. Radiol Bras. 2004;37:115–23. [ ] 6. Mathieu I, Caussin J, Smeesters P, et al. Recommended restrictions after 131I therapy: measured doses in family members. Health Phys. 1999;76: 129–36. [ ] 7. Coover LR, Silberstein EB, Kuhn PJ, et al. Therapeutic 131I in outpatients: a simplified method conforming to the Code of Federal Regulations, title 10, part 35.75. J Nucl Med. 2000;41:1868–75. [ ] 8. U.S. Nuclear Regulatory Commission. Regulatory Guide 8.39. Release of patients administered radioactive materials. Washington, DC: Office of Nuclear Regulatory Research; 1997. p.14–9. [ ] 9. The Code of Federal Regulations: title 10, energy; part 35. Medical use of byproduct material; section 75, release of individuals containing radiopharmaceuticals or permanent implants. Fed Regist. 1997;62:4133. [ ]
Recebido para publicação em 23/3/2007. Aceito, após revisão, em 10/7/2007.
* Trabalho realizado no Serviço de Medicina Nuclear do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554