Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 42 nº 2 - Mar. / Abr. of 2009
Vol. 42 nº 2 - Mar. / Abr. of 2009
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Marcus Vinicius Leitão de Souza, Honomar Ferreira de Souza, Alexandru Buescu, Mario Vaisman |
|
|
Descritores: Doença de Graves, Metimazol, Iodeto de sódio |
|
|
Resumo:
INTRODUÇÃO Mais de 60 anos se passaram desde a primeira descrição do iodo radioativo para tratamento do hipertireoidismo, em 1941 no Massachusetts General Hospital em Boston, sendo o isótopo usado na ocasião o NaI-130I(1,2). Em função do baixo custo, da maior eficácia na destruição da célula tireoidiana e da meia vida de oito dias, o NaI-131I passou a ser o isótopo de escolha e mantém-se amplamente utilizado até os dias de hoje. No entanto, no tratamento do hipertireoidismo, particularmente o relacionado à doença de Graves, o uso de drogas antitireoidianas tem sido a primeira opção, não somente no Brasil como também na América do Sul(3), principalmente no intuito de atingir remissão. Considerando o custo médio do tratamento e o percentual médio de remissão após 12-24 meses de tratamento (cerca de 50-60%)(4-9), a indicação precoce do uso de NaI-131I como tratamento definitivo (dose terapêutica - DT) deveria ser uma opção utilizada com mais frequência. Questões relativas à segurança no emprego do NaI-131I com ênfase nas pacientes do sexo feminino e a possível interferência com a fertilidade constituíam obstáculos no encaminhamento precoce para essa terapia. Com o objetivo de avaliar possíveis mudanças no perfil dos pacientes encaminhados para DT, assim como a mudança de conduta em relação à dose administrada e o consequente efeito sobre o percentual de cura do hipertireoidismo desses pacientes, procedemos a um levantamento dos dados do Serviço de Medicina Nuclear do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), no período de 12 anos, abrangendo janeiro de 1990 a dezembro de 2001. Para avaliar a eficácia da DT, assim como a influência da mudança no cálculo da DT, analisamos o estado funcional tireoidiano um ano pós-DT.
MATERIAIS E MÉTODOS Foi realizado estudo retrospectivo, com análise de prontuários do HUCFF-UFRJ, a partir dos dados do Serviço de Medicina Nuclear, tendo sido selecionados todos os pacientes submetidos a DT, de janeiro de 1990 a dezembro de 2001. Para o cálculo das doses de NaI-131I foram levados em conta o volume da tireóide estimado pelo exame clínico, a captação de NaI-131I em 24 horas, a gravidade do hipertireoidismo e eventuais comorbidades presentes. O cálculo variou de 50-150 μCi/g de tecido tireoidiano, porém não havia relato de quantos μCi/g de tecido tireoidiano foram definidos em cada período analisado. Em razão de o período referido ser uma variável contínua, os 12 anos foram segmentados em três períodos de 4 anos para análise comparativa. Esses períodos compreenderam de janeiro de 1990 a dezembro de 1993 (período 1), janeiro de 1994 a dezembro de 1997 (período 2) e janeiro de 1998 a dezembro de 2001 (período 3). Foram incluídos os pacientes submetidos a DT com hipertireoidismo descompensado (TSH diminuído e T4 elevado) associado a sinais e sintomas de hipertireoidismo com ou sem tratamento prévio com antitireoidiano. Na avaliação laboratorial pré-DT foi incluída a última dosagem hormonal e, portanto, o nível hormonal que refletia o grau de descompensação do hipertireoidismo, a despeito do uso de antitireoidiano. Para a uniformização da amostra, foram excluídos os pacientes com qualquer um dos seguintes critérios: submetidos a tireoidectomia previamente à DT; já submetidos previamente à DT; submetidos à DT por bócio multinodular tóxico ou nódulo único tóxico; em uso de antitireoidiano por menos de três meses antes da DT; submetidos a DT em uso de antitireoidiano; sem dosagem hormonal no intervalo de 9-12 meses pós-DT; sem dados clínicos e laboratoriais prévios à DT. As seguintes variáveis foram incluídas para análise estatística: idade, sexo, tempo de tratamento com antitireoidiano, volume do bócio, captação de 24 horas de NaI-131I pré-DT, níveis hormonais pré-DT, dose de NaI-131I administrada, tipo de antitireoidiano, dose do antitireoidiano, níveis hormonais pós-DT (9-12 meses) com classificação do estado funcional tireoidiano neste período (curados ou não curados). A dose do antitireoidiano foi considerada como a dose que o paciente estava em uso na ocasião da suspensão antes da DT. Para inclusão no grupo dos pacientes em uso de antitireoidiano, estes precisariam estar em uso por pelo menos três meses do respectivo antitireoidiano. Os pacientes sem antitireoidiano por mais de três meses foram considerados como sem antitireoidiano pré-DT. O tamanho do bócio foi determinado de acordo com a avaliação clínica e graduado de 0 até 3, sendo 0 = ausência de bócio, 1 = tireoide aumentada de uma a duas vezes, 2 = tireoide aumentada mais que duas e até quatro vezes, e 3 = tireoide aumentada mais que quatro vezes o volume normal. As dosagens incluíram T4 livre (ng/dl), TSH (mU/l), T4 total (μg/dl) e T3 total (ng/dl). A reavaliação constituiu de dosagens hormonais no período entre 9 e 12 meses pós-DT. Neste período os pacientes foram classificados em dois grupos: a) Curados, que incluía os seguintes pacientes: T4 livre normal sem antitireoidiano (eutireoidianos); T4 livre normal em uso de levotiroxina (hipotireoideos tratados); T4 livre baixo com ou sem levotiroxina (hipotireoideos sem tratamento ou em compensação). b) Não curados, que incluía os seguintes pacientes: T4 livre elevado sem qualquer medicação; T4 livre elevado em uso de antitireoidiano; T4 livre normal em uso de antitireoidiano. Os pacientes com T4 livre elevado em uso de levotiroxina foram classificados de acordo com a evolução das consultas subseqüentes, assim como os pacientes com T4 livre baixo e em uso de antitireoidiano. Os níveis de TSH não foram levados em conta para esta classificação, em função de a supressão do eixo poder se estender por período longo, mesmo já se tendo atingido o eutireoidismo clínico(10,11). Nos pacientes sem dosagem de T4 livre foi considerado o nível de T4 total, com os mesmos critérios considerados acima. Análise estatística Os dados foram analisados no programa Epi-Info versão 6.0. O teste de Kruskal-Wallis foi utilizado para comparação das variáveis numéricas e categóricas, sendo aplicado para comparar idade, tempo de tratamento com antitireoidiano, T4 livre, T4 total, T3 total, captação de NaI-131I e dose terapêutica nos três períodos. O teste χ2 foi utilizado para análise bivariada, com comparação de duas variáveis categóricas, sendo aplicado para comparar sexo, volume do bócio (segmentado de 0-4), tipo de antitireoidiano utilizado e cura ou não do hipertireoidismo um ano pós-DT nos três períodos, com valor maior que 3,84 correspondendo a p < 0,05. A determinação da significância estatística foi o nível de 5%, ou seja, se o valor de p < 0,05, então existe significância estatística.
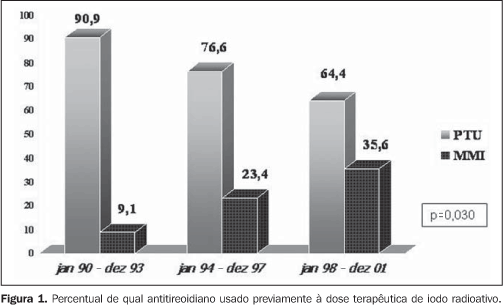
RESULTADOS Foram levantados 774 prontuários de pacientes com hipertireoidismo submetidos a DT, sendo analisados 226 prontuários que preencheram os critérios de inclusão e exclusão previamente relacionados. Todos os resultados da análise estão expostos na Tabela 1. Observamos aumento significativo do número de pacientes encaminhados para DT no decorrer dos anos (27, 70 e 129 pacientes, respectivamente, em cada período estabelecido). O perfil clínico dos pacientes encaminhados para DT permaneceu similar com o passar dos anos, refletido pela similaridade estatística, nos três períodos, de volume do bócio, níveis hormonais (T4 livre, T3 total e TSH), captação de iodo pré-DT, assim como a dose de antitireoidiano usada previamente à DT. Os dois pontos em que observamos mudança em relação ao perfil clínico dos pacientes foram: 1) incremento significativo no número de pacientes do sexo feminino encaminhadas para DT, principalmente a partir de 1993 (62,9%, 82,8% e 86,8% nos três períodos, respectivamente, com p = 0,005); 2) tipo de antitireoidiano usado previamente à DT, com incremento significativo dos pacientes em uso de metimazol (9,1%, 23,4% e 35,6% nos três períodos, respectivamente, com p = 0,03), conforme apresentado na Figura 1.
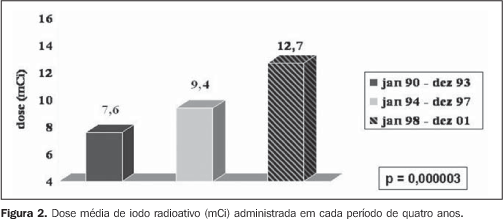
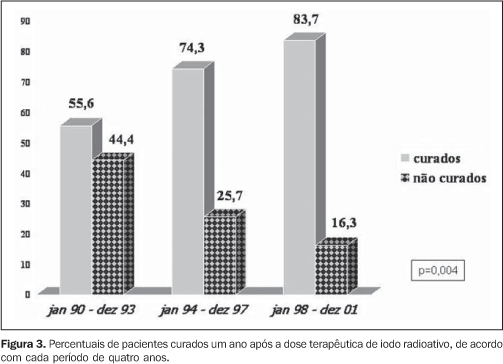
A dose de iodo administrada teve incremento altamente significativo (7,6, 9,4 e 12,7 mCi nos três períodos, respectivamente, com p = 0,000003), como observado na Figura 2, com reflexo direto no percentual de pacientes curados do hipertireoidismo um ano após a DT (55,6%, 74,3% e 83,7% nos três períodos, respectivamente, com p = 0,004), conforme exposto na Figura 3.
Analisando separadamente os pacientes curados um ano pós-DT, não houve alteração significativa no percentual de pacientes hipotireoideos, com 9/15 (60%), 36/52 (69%) e 67/108 (62%) nos três períodos, respectivamente.
DISCUSSÃO Ainda nos dias atuais não existe tratamento ideal e as três abordagens terapêuticas clássicas - cirurgia, uso de droga antitireoidiana ou DT de NaI-131I - têm vantagens e desvantagens(12-15). Os critérios para a administração do iodo radioativo como tratamento para o hipertireoidismo na doença de Graves ainda não têm sido uniformes em diferentes países, principalmente em relação à dose administrada, ao momento a ser utilizado e a quais fatores podem influenciar na eficácia deste tratamento. Nos EUA, a preferência pela DT é marcante e indicada em vários casos de forma precoce(16). A dose por grama de tecido tireoidiano tem aumentado progressivamente em citações científicas, no intuito de impedir qualquer chance de recidiva ou mesmo não cura do hipertireoidismo, com necessidade de repetir a DT(17). Verificamos que o número de pacientes encaminhados para DT mais que duplicou em cada período, refletindo sua maior aceitação como um excelente método para tratamento definitivo e também sua segurança(12,17). A influência da literatura dos EUA, país onde se chega a indicar o iodo radioativo em até 69% dos casos como a forma inicial de tratamento(16), pode também ser um fator associado. Em relação ao tempo médio de tratamento com antitireoidiano previamente à DT, houve discreta diminuição com o decorrer dos anos, apesar de sem diferença significativa (p = 0,289), talvez apontando uma tendência em indicar mais precocemente um tratamento definitivo. Em relação ao uso de antitireoidiano previamente à DT, houve um aumento significativo de pacientes em uso de metimazol (Figura 1), talvez sinalizando os resultados de alguns trabalhos, que sugerem um maior efeito radioprotetor do propiltiouracil(18-22), além da maior facilidade para suspensão pré-DT do metimazol(23). Outro achado interessante foi o incremento no percentual de pacientes do sexo feminino encaminhadas para DT, com participação de 60,7% no período de 1990-1993, elevando-se para 83% no período de 1994-1997 e permanecendo estável em 86,3% no período de 1998-2001. Estes dados refletem não somente a segurança da DT, notadamente em pacientes jovens com doença de Graves, como demonstrado por Metso et al. em recente estudo populacional com 2.793 pacientes(24), mas reenfatizando a segurança do iodo radioativo mesmo nas mulheres em idade fértil, como demonstrado por Brandão et al.(25), já que das 189 mulheres do estudo, 40,7% (n = 77) tinham idade entre 16-40 anos e 26,7% (n = 30) tinham idade entre 16-30 anos. Aspecto crucial a ser discutido é a diferença na dose de radioiodo (incremento de 7,6 mCi para 9,4 mCi e 12,7 mCi, com p = 0,000003). Muito se tentou até hoje para se definir o que seria a dose ideal(17,26), passando desde doses fixas pequenas(27,28) e cálculos de doses(12), a fim de atingir o eutireoidismo, até doses fixas elevadas(29,30), com intuito de garantir o hipotireoidismo e, consequentemente, a "cura" do hipertireoidismo. Claramente se demonstra que quanto maior a dose, maior o percentual de hipotireoidismo, e quanto menor a dose, maior a chance de recidiva. Quando utilizados, os cálculos de doses são extremamente variáveis (75-200 μCi/g)(12,17), com variações até no mesmo serviço, principalmente relacionadas ao volume do bócio, à gravidade do hipertireoidismo e à presença de cardiopatia. A utilização da ultrassonografia para mensuração do volume do bócio é pouco prática e não mostra diferença no efeito final da DT quando comparada à avaliação clínica(31). Apesar de não parecer prática, uma metodologia simples foi recentemente descrita para avaliação biocinética do iodo radioativo, assim como avaliação da relação dose absorvida/atividade administrada(32), podendo ser útil para cálculos de doses mais eficazes; porém, ainda não é rotineiramente utilizada. Assim, as doses empregadas atualmente têm sido cada vez mais elevadas, principalmente quando se consideram eventuais comorbidades e riscos que o hipertireoidismo pode trazer para o paciente, sendo a cardiopatia o mais temido. Com essas considerações, fica nítido o incremento das doses calculadas com o passar dos anos, com o intuito de garantir cura do hipertireoidismo o mais rápido possível, mesmo que à custa de hipotireoidismo de instalação relativamente precoce. Não se pode esquecer dos pacientes com hipertireoidismo não tão grave, sem comorbidades e com bons indicadores para remissão após antitireoidiano(5,33), a fim de proporcionar a esses pacientes chance de eutireoidismo independente do uso de qualquer medicação. Assim, parece ser de bom senso observar todos os indicadores de gravidade da doença de Graves e discutir com o paciente a sua melhor opção de tratamento. Podemos observar, assim como Hernández-Jiménez et al.(34), que o aumento linear da dose administrada (Figura 2) correspondeu a um aumento progressivo no percentual de pacientes curados (Figura 3), com incremento de 55% para 74% e, finalmente, para 83% (p = 0,004). Concluímos que em nosso serviço o número de pacientes encaminhados para DT teve incremento altamente significativo, o que reafirma a aceitação, pelos endocrinologistas, do iodo radioativo como um método seguro de tratamento definitivo para os pacientes com doença de Graves. A dose de iodo administrada aumentou significativamente nos períodos analisados e este incremento coincidiu com uma diminuição significativa no percentual de pacientes não curados um ano após a DT. Concluímos ainda que os pacientes não têm sido encaminhados mais precocemente para DT e que aumentou o uso do metimazol nos pacientes a serem submetidos ao iodo radioativo, talvez em razão do muito provável efeito radioprotetor do propiltiouracil, já confirmado em estudos prospectivos controlados(20,21). Por fim, observamos um aumento percentual significativo de mulheres (mesmo em idade fértil) encaminhadas para DT, aproximando-se da real prevalência da doença de Graves no sexo feminino.
REFERÊNCIAS 1. Becker DV, Sawin CT. Radioiodine and thyroid disease: the beginning. Semin Nucl Med. 1996; 26:155-64. [ ] 2. Sawin CT, Becker DV. Radioiodine and the treatment of hyperthyroidism: the early history. Thyroid. 1997;7:163-76. [ ] 3. Romaldini JH. Case selection and restrictions recommended to patients with hyperthyroidism in South America. Thyroid. 1997;7:225-8. [ ] 4. Bonnema SJ, Bartalena L, Toft AD, et al. Controversies in radioiodine therapy: relation to ophthalmopathy, the possible radioprotective effect of antithyroid drugs, and use in large goiters. Eur J Endocrinol. 2002;147:1-11. [ ] 5. Vitti P, Rago T, Chiovato L, et al. Clinical features of patients with Graves' disease undergoing remission after antithyroid drug treatment. Thyroid. 1997;7:369-75. [ ] 6. Allannic H, Fauchet R, Orgiazzi J, et al. Antithyroid drugs and Graves' disease: a prospective randomized evaluation of the efficacy of treatment duration. J Clin Endocrinol Metab. 1990;70:675-9. [ ] 7. Hedley AJ, Young RE, Jones SJ, et al. Antithyroid drugs in the treatment of hyperthyroidism of Graves' disease: long-term follow-up of 434 patients. Scottish Automated Follow-Up Register Group. Clin Endocrinol (Oxf). 1989;31:209-18. [ ] 8. Sugrue D, McEvoy M, Feely J, et al. Hyperthyroidism in the land of Graves: results of treatment by surgery, radio-iodine and carbimazole in 837 cases. Q J Med. 1980;49:51-61. [ ] 9. Tamai H, Nakagawa T, Fukino O, et al. Thionamide therapy in Graves' disease: relation of relapse rate to duration of therapy. Ann Intern Med. 1980;92: 488-90. [ ] 10. Allahabadia A, Daykin J, Sheppard MC, et al. Radioiodine treatment of hyperthyroidism - prognostic factors for outcome. J Clin Endocrinol Metab. 2001;86:3611-7. [ ] 11. Benker G, Reinwein D, Kahaly G, et al. Is there a methimazole dose effect on remission rate in Graves' disease? Results from a long-term prospective study. Clin Endocrinol (Oxf). 1998;49: 451-7. [ ] 12. Cooper DS. Treatment of thyrotoxicosis. In: Braverman LE, Utiger RD, editors. Werner & Ingbar's The thyroid: a fundamental and clinical text. 8th ed. Philadelphia: Lippincott Williams & Wilkins; 2000. p. 691-715. [ ] 13. Sosa JA, Bowman HM, Tielsch JM, et al. The importance of surgeon experience for clinical and economic outcomes from thyroidectomy. Ann Surg. 1998;228:320-30. [ ] 14. Hermann M, Roka R, Richter B, et al. Reoperation as treatment of relapse after subtotal thyroidectomy in Graves' disease. Surgery. 1999;125:522-8. [ ] 15. Törring O, Tallstedt L, Wallin G, et al. Graves' hyperthyroidism: treatment with antithyroid drugs, surgery, or radioiodine - a prospective randomized study. Thyroid Study Group. J Clin Endocrinol Metab. 1996;81:2986-93. [ ] 16. Levy EG. Treatment of Graves' disease: the American way. Baillières Clin Endocrinol Metab. 1997;11:585-95. [ ] 17. Kaplan MM, Meier DA, Dworkin HJ. Treatment of hyperthyroidism with radioactive iodine. Endocrinol Metab Clin North Am. 1998;27:205-23. [ ] 18. Imseis RE, Vanmiddlesworth L, Massie JD, et al. Pretreatment with propylthiouracil but not methimazole reduces the therapeutic efficacy of iodine-131 in hyperthyroidism. J Clin Endocrinol Metab. 1998;83:685-7. [ ] 19. Tuttle RM, Patience T, Budd S. Treatment with propylthiouracil before radioactive iodine therapy is associated with a higher treatment failure rate than therapy with radioactive iodine alone in Graves' disease. Thyroid. 1995;5:243-7. [ ] 20. Santos RB, Romaldini JH, Ward LS. Propylthiouracil reduces the effectiveness of radioiodine treatment in hyperthyroid patients with Graves' disease. Thyroid. 2004;14:525-30. [ ] 21. Bonnema SJ, Bennedbaek FN, Veje A, et al. Propylthiouracil before 131-I therapy of hyperthyroid diseases: effect on cure rate evaluated by a randomized clinical trial. J Clin Endocrinol Metab. 2004;89:4439-44. [ ] 22. de Souza MV, Buescu A, Vaisman M, et al. The effect of propylthiouracil on the efficacy of radioiodine (I-131) therapy in Graves' hyperthyroidism. Arq Bras Endocrinol Metab. 2006;50:1088-95. [ ] 23. Andrade VA, Gross JL, Maia AL. The effect of methimazole pretreatment on the efficacy of radioactive iodine therapy in Graves' hyperthyroidism: one year follow-up of a prospective, randomized study. J Clin Endocrinol Metab. 2001;86: 3488-93. [ ] 24. Metso S, Jaatinen P, Huhtala H, et al. Increased cardiovascular and cancer mortality after radioiodine treatment for hyperthyroidism. J Clin Endocrinol Metab. 2007;92:2190-6. [ ] 25. Brandão CDG, Antonucci J, Correa ND, et al. Efeitos da radioiodoterapia nas gerações futuras de mulheres com carcinoma diferenciado de tireóide. Radiol Bras. 2004;37:51-5. [ ] 26. Nordyke RA, Gilbert FI Jr. Optimal iodine-131 dose for eliminating hyperthyroidism in Graves' disease. J Nucl Med. 1991;32:411-6. [ ] 27. Cevallos JL, Hagen GA, Maloof F, et al. Low-dosage 131-I therapy of thyrotoxicosis (diffuse goiters). A five-year follow-up study. N Engl J Med. 1974;290:141-3. [ ] 28. Sridama V, McCormick M, Kaplan EL, et al. Long-term follow-up study of compensated low-dose 131I therapy for Graves' disease. N Engl J Med. 1984;311:426-32. [ ] 29. Eriksson E, Eriksson K, Wahlberg P. Treatment of hyperthyroidism with standard doses of radioiodine aiming at ablation. Acta Med Scand. 1985; 217:55-60. [ ] 30. Safa AM, Skillern PG. Treatment of hyperthyroidism with a large initial dose of sodium iodide I-131. Arch Intern Med. 1975;135:673-5. [ ] 31. Tsuruta M, Nagayama Y, Yokoyama N, et al. Long-term follow-up studies on iodine-131 treatment of hyperthyroid Graves' disease based on the measurement of thyroid volume by ultrasonography. Ann Nucl Med. 1993;7:193-7. [ ] 32. Araujo F, Melo RC, Rebelo AMO, et al. Proposta de metodologia para tratamento individualizado com iodo-131 em pacientes portadores de hipertireoidismo da doença de Graves. Radiol Bras. 2007;40:389-95. [ ] 33. Cooper DS. Antithyroid drugs in the management of patients with Graves' disease: an evidence-based approach to therapeutic controversies. J Clin Endocrinol Metab. 2003;88:3474-81. [ ] 34. Hernández-Jiménez S, Pachón-Burgos A, Aguilar-Salinas CA, et al. Radioiodine treatment in autoimmune hyperthyroidism: analysis of outcomes in relation to dosage. Arch Med Res. 2007;38: 185-9. [ ]
Recebido para publicação em 3/9/2008
* Trabalho realizado no Serviço de Endocrinologia do Departamento de Ciências Médicas da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554