Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 42 nº 2 - Mar. / Abr. of 2009
Vol. 42 nº 2 - Mar. / Abr. of 2009
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Ricardo Akiyoshi Nakamura, Carlos Roberto Monti, Felipe Amstalden Trevisan, Alexandre Arthur Jacinto |
|
|
Descritores: Próstata, Câncer, Radioterapia, Toxicidade, Fatores prognósticos |
|
|
Resumo:
INTRODUÇÃO Câncer de próstata é o câncer mais frequente em homens, excetuando-se o câncer de pele não melanoma, sendo estimados 49.530 casos novos para 2008 no Brasil, correspondendo a 52 casos novos por 100.000 homens(1). A doença pode ser abordada de diversas formas, como cirurgia, radioterapia externa, braquiterapia com sementes de iodo, braquiterapia com alta taxa de dose(2), terapia de supressão androgênica, somente monitoramento do antígeno prostático específico (PSA) e crioterapia. Entretanto, os únicos tratamentos que oferecem cura aos pacientes são a cirurgia, a radioterapia externa, a braquiterapia e a crioterapia, ou uma associação entre essas modalidades terapêuticas. Na radioterapia externa, a técnica de radioterapia conformada (RTC3D) utiliza alta tecnologia, com o uso de potentes computadores e complexos programas de computador, possibilitando melhor localização do alvo da radioterapia e dos órgãos de risco, permitindo a liberação de altas doses de radiação no volume alvo, com maior controle sobre a dose de radiação em estruturas normais. A alta dose de radiação no câncer de próstata tem proporcionado maior controle bioquímico em estudos prospectivos aleatorizados, entretanto, sem resultar em aumento da sobrevida global(3,4) e com aumento da toxicidade(5). Entretanto, altas doses liberadas com a RTC3D geram toxicidade inferior à radioterapia convencional com doses de radiação convencionais(6). O objetivo deste estudo é reportar os resultados do tratamento do câncer de próstata localizado com RTC3D realizado em uma instituição onde mais de 1.000 pacientes foram tratados até o momento, e avaliar fatores prognósticos para controle da doença e para toxicidade do tratamento.
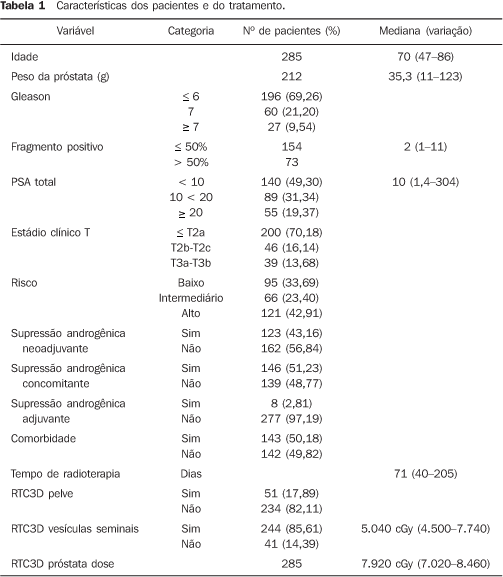
MATERIAIS E MÉTODOS De julho de 1997 a janeiro de 2002, 285 pacientes consecutivos com adenocarcinoma de próstata localizado diagnosticado por meio de biópsia transretal foram submetidos a RTC3D com finalidade curativa em uma única instituição e foram analisados retrospectivamente. O seguimento mediano foi de 53,6 meses (3,6-95,3 meses). Todos os pacientes foram estadiados de acordo com o sistema de estadiamento do American Joint Committee on Cancer (2002). Não houve informação sobre o nível de testosterona no início do tratamento. Todos os pacientes consentiram por escrito submeterem-se ao tratamento. Outras características dos pacientes estão listadas na Tabela 1.
Características do tratamento Supressão androgênica neoadjuvante, concomitante e/ou adjuvante e tipo de medicamento supressor utilizado foram realizados segundo decisão do médico urologista e/ou radioterapeuta. Os pacientes foram simulados em decúbito dorsal, em tomógrafo helicoidal, com contraste venoso e uretral, com cortes de 5 mm de espessura. As imagens foram adquiridas por meio do software Med Crane. Os alvos do tratamento foram delineados nos cortes tomográficos do seguinte modo: a) próstata - delineado todo seu volume (GTV [gross tumor volume]); b) vesículas seminais - delineada toda sua extensão (GTV quando acometida; CTV [clin-ical target volume] quando doença subclínica); c) drenagem - delineados linfonodos dos vasos ilíacos internos e externos, a começar da parte caudal da articulação sacro-ilíaca, e linfonodos obturatórios, excluindo-se linfonodos perirretais laterais (CTV em pacientes de alto risco). Margens de movimentação de alvo e erros de posicionamento foram de 10 mm em todas as dimensões e 3 mm posteriormente (PTV [planning target volume]). Os órgãos de risco foram delineados do seguinte modo: a) bexiga - todo seu volume pela camada muscular externa; b) reto - todo seu volume e conteúdo pela camada mais externa, desde a transição retoanal até a transição retossigmoidea. Foram utilizadas energias de 6 ou 15 MV e cinco campos de radiação. O tratamento radioterápico foi dividido em fases: irradiaram-se pelve, vesículas seminais e próstata na primeira fase (PTV1); após, o volume de tratamento restringiu-se às vesículas seminais e à próstata (PTV2); por fim, o campo de tratamento englobou somente a próstata com respectivas margens (PTV3). Quando não houve irradiação pélvica, o tratamento constituiu-se de duas fases: irradiação das vesículas seminais e da próstata (PTV1), e após, somente a próstata (PTV2). As restrições de dose em tecidos normais foram: a) reto: 50% < 50 Gy, 25% < 70 Gy; b) bexiga: 50% < 50 Gy, 30% < 70 Gy; c) cabeças femorais: < 55Gy; a isodose de prescrição foi de 95%. A Figura 1 representa o histograma de dose e volume e corte axial de tomografia num planejamento RTC3D de próstata. Em seguida, as informações do planejamento foram transferidas ao acelerador linear e o tratamento foi efetuado com dose de 180 cGy por dia cinco vezes por semana. Os pacientes foram avaliados durante a terapia semanalmente, ou mais frequentemente, se necessário. O controle de qualidade foi realizado com check-films semanais. Outras características do tratamento estão listadas na Tabela 1. Seguimento dos pacientes Após a RTC3D, os pacientes foram monitorados com PSA total seriado entre três e seis meses, e estudos de imagem foram solicitados quando houve queixas específicas. Todos os pacientes foram contatados por telefone para atualização de dados referentes ao controle da doença e toxicidade do tratamento no momento da análise. Toxicidade A toxicidade tardia foi avaliada para reto e bexiga e graduada segundo o Common Terminology Criteria for Adverse Ef-fects version 3(7). Falência bioquímica A falência bioquímica foi considerada após três aumentos consecutivos do PSA total(8) ou início de terapia de supressão androgênica por qualquer motivo. Análise estatística Os pacientes foram analisados como um único grupo para controle de doença e toxicidade tardia, e como três grupos distintos para controle da doença segundo PSA total inicial, valor de Gleason e estádio clínico T. O grupo de baixo risco foi definido como PSA total inicial < 10 ng/ml, valor de Gleason < 6 e estádio > T2a; o de risco intermediário, como PSA total inicial > 10 e < 20 ng/ml ou valor de Gleason = 7 ou estádio T2b-T2c; e o de alto risco, como PSA total inicial > 20 e/ou valor de Gleason > 8 e/ou estádio T3, ou duas ou mais características do grupo de risco intermediário. Os pacientes que apresentaram toxicidade urinária ou retal tardia podem ter tido um ou mais tipos de toxicidade, e a data e o grau considerados para o cálculo de sobrevida foram a mais recente e o maior. Morte por câncer de próstata foi definida como morte do paciente com metástases a distância. Associações entre variáveis categóricas em tabelas de contingência foram verificadas pelo teste do qui-quadrado, e quando pelo menos uma frequência esperada foi menor que 5 em tabelas 2 × 2 o teste exato de Fisher foi adotado. O nível de 5% de significância foi considerado para todos os testes. O tempo de sobrevida global foi definido como o intervalo entre a data do início do tratamento e a data da morte ou última informação para observações censuradas. O período de recidiva da doença ou da falência bioquímica foi medido do início da RTC3D e a data da recidiva. Sobrevidas global e livre de recidiva foram estimadas pelo método de Kaplan-Meier, e o teste de log-rank foi aplicado para comparar curvas de sobrevida com intervalo de confiança de 95%. O risco relativo bruto para morte e ajustado foi estimado pelo modelo de regressão de Cox. Toda a análise estatística foi realizada por meio do software Stata release 7.0 (StataCorp.; Texas, EUA).
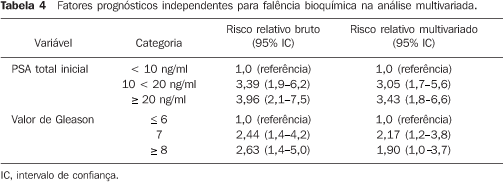
RESULTADOS Sobrevida atuarial global Sobrevida atuarial global em cinco e sete anos foi de 85,1% e 77,0%, respectivamente. Idade > 65 anos (p = 0,0458) e a ausência de irradiação de vesículas seminais (p = 0,0125) resultaram em menor sobrevida global (Tabela 2). Não foi possível encontrar associação entre dose de radiação em vesículas seminais e aumento da sobrevida global. Outras variáveis analisadas não influenciaram a sobrevida atuarial global e estão listadas na Tabela 2. Sobrevida atuarial causa específica Sobrevida atuarial causa específica em cinco e sete anos foi de 97% e 94,5%, respectivamente. Valor de Gleason (p = 0,0179), porcentagem de fragmentos positivos (p = 0,0222), estádio clínico T (p = 0,0006), recidiva bioquímica (p < 0,0001) e realização de ressecção transuretral pré—RTC3D (p = 0,0206) foram fatores prognósticos para morte por câncer de próstata. Analisando os grupos de risco, houve tendência a significância estatística (p = 0,0677). Entretanto, quando analisamos os grupos de risco separadamente, verificamos que os grupos de risco 1 e 2 são iguais (p = 0,2403) e o grupo 1 tem melhor sobrevida causa específica que o 3 (p = 0,0327). Outras características analisadas estão listadas na Tabela 2. Sobrevida atuarial livre de metástases Sobrevida atuarial livre de metástases em cinco e sete anos foi de 94,2% e 93,1%, respectivamente. Dezessete pacientes tiveram metástases a distância. Idade < 65 anos (p = 0,0220), valor de Gleason (p = 0,0005), estádio clínico T (p = 0,0041), grupo de risco (p = 0,0033), recidiva bioquímica (p < 0,0001), ressecção transuretral pré-RTC3D (p = 0,0039) e tempo maior que cinco meses do diagnóstico ao início da RTC3D (p = 0,0016) foram fatores prognósticos para metástases a distância (Tabela 3). Sobrevida atuarial livre de recidiva bioquímica Sobrevida atuarial livre de recidiva bioquímica em cinco e sete anos foi de 75,8% e 64,0%, respectivamente. Sessenta e nove pacientes mostraram recidiva bioquímica (24,21%). Valor de Gleason (p = 0,0004), porcentagem de fragmentos positivos > 50% (p = 0,0211), PSA inicial total (p < 0,0001), estádio clínico T (p = 0,0204) e grupo de risco (p < 0,0001) implicaram maior falência bioquímica na análise univariada (Tabela 3). Na análise multivariada, valor do PSA total inicial pré-RTC3D e valor de Gleason foram fatores prognósticos independentes (p < 0,0001 e p = 0,0011, respectivamente) (Tabela 4).
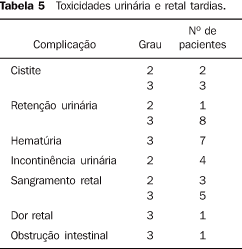
RTC3D pélvica Pacientes que foram submetidos à radioterapia pélvica apresentaram menor sobrevida atuarial livre de recidiva bioquímica e livre de metástases. Entretanto, pacientes submetidos a esse procedimento tinham características tumorais mais agressivas, permitindo um erro de amostragem na análise estatística. Grupo de baixo risco Sobrevida atuarial global e a livre de recidiva bioquímica em sete anos para os pacientes do grupo de baixo risco foram de 87,2% e 87,8%, respectivamente. Não foram identificados fatores prognósticos que implicaram menor sobrevida para esse grupo de pacientes. Somente uma tendência a maior sobrevida atuarial global com doses > 76 Gy na próstata (p = 0,0524) foi observada. Não foi possível avaliar a sobrevida atuarial causa específica e a livre de metástases a distância para esse grupo de pacientes, em função da baixa incidência de mortes por câncer de próstata e de metástases a distância. Grupo de risco intermediário Sobrevida atuarial global e a livre de recidiva bioquímica em sete anos foram de 78,9% e 59,2%, respectivamente. Irradiação das vesículas seminais resultou em maior sobrevida atuarial global e livre de recidiva bioquímica (p = 0,0034 e p = 0,0301, respectivamente). Outras variáveis não apresentaram associação. Não foi possível avaliar a sobrevida atuarial causa específica e a livre de metástases a distância para esse grupo de pacientes, em função da baixa incidência de mortes por câncer de próstata e de metástases a distância. Grupo de alto risco Sobrevida atuarial global e a livre de recidiva bioquímica em sete anos foram de 67,1% e 49,0%, respectivamente. Supressão androgênica neoadjuvante e concomitante resultou em maior sobrevida atuarial global (p = 0,0217 e p = 0,0238, respectivamente), e irradiação de vesículas seminais aumentou a sobrevida atuarial livre de recidiva bioquímica (p = 0,0040). Outras variáveis não foram significativas na análise. Não foi possível avaliar a sobrevida atuarial causa específica e a livre de metástases a distância para esse grupo de pacientes, em função da baixa incidência de mortes por câncer de próstata e de metástases a distância. Toxicidade retal tardia Sobrevida atuarial livre de toxicidade retal tardia grau 2-3 em sete anos foi de 96,38%. Três pacientes apresentaram toxicidade retal tardia grau 2 e sete, grau 3 (Tabela 5). Em função do baixo número de pacientes com toxicidade retal tardia não foi possível identificar fatores prognósticos associados.
Toxicidade urinária tardia Sobrevida atuarial livre de toxicidade urinária tardia grau 2-3 em sete anos foi de 89,97%. Sete e 15 pacientes apresentaram toxicidade urinária graus 2 e 3, respectivamente (Tabela 5). Ressecção transuretral de próstata pré-RTC3D e doses > 70 Gy em 30% volume da bexiga implicaram maior toxicidade urinária tardia graus 2 e 3 (p = 0,0002 e p = 0,0264, respectivamente). Outras variáveis não foram significativas.
DISCUSSÃO Características do tratamento associadas aos resultados da terapia Nos pacientes de baixo risco estádios clínicos T1 e T2a os resultados em longo prazo com radioterapia externa convencional têm sido similares aos da prostatectomia radical(9,10). Entretanto, em pacientes com doença localmente avançada, o controle local do tumor primário com radioterapia externa convencional é insatisfatório, com recidiva local em 10 anos de 30% a 40%, e somente 35% a 45% e 18% a 27% dos pacientes estão vivos em 10 e 15 anos, respectivamente(10). Estudos retrospectivos têm relacionado controle local com dose de radiação no adenocarcinoma de próstata(10,11). Todavia, a administração de doses maiores que 70 Gy com técnica de radioterapia convencional tem implicado taxas de complicações severas (graus 3 e 4), de 3,5% a 6,9%(12). Com o desenvolvimento tecnológico, a associação entre tomografia computadorizada e acelerador linear tornou-se possível por intermédio de complexos programas de computador. Essa associação permitiu a visualização do alvo terapêutico e das estruturas normais com extrema fidelidade, e a estimativa de dose de radiação no volume alvo e em estruturas de risco tornou-se possível, permitindo que doses elevadas de radiação pudessem ser liberadas nos volumes alvos e restrições de dose pudessem ser colocadas sobre estruturas normais. Dessa forma, desde o início da década de 90, protocolos de escalonamento de dose têm sido realizados, e no câncer de próstata tem-se obtido maior controle bioquímico, com toxicidades tardias aceitáveis(3,4). Na presente série, a sobrevida atuarial livre de recidiva bioquímica em cinco anos para pacientes de baixo risco, risco intermediário e alto risco foram de 91,40%, 73,29% e 64,25%, respectivamente, semelhantes aos resultados de radioterapia tridimensional(13) e de prostatectomia radical(8). As séries de escalonamento de dose publicadas(3,4,13) reportam maior controle bioquímico com doses mais altas de radiação, mas sem observar aumento da sobrevida global. No entanto, os seguimentos são relativamente curtos, e um maior tempo de seguimento pode revelar benefícios em termos de sobrevida global. Todavia, a redução da falência bioquímica pode trazer benefícios mensuráveis aos pacientes, como maior sobrevida atuarial causa específica e livre de metástases, reportada na presente série, além da redução da necessidade da supressão androgênica na falha bioquímica. Valor de Gleason, estádio clínico T e valor do PSA total inicial podem predizer o risco de envolvimento das vesículas seminais(14), as quais, a depender do risco, devem ser tratadas. Entretanto, irradiação das vesículas seminais pode aumentar drasticamente o volume de tecidos normais irradiados, aumentando o risco de toxicidade tardia. Na presente série, a irradiação das vesículas seminais resultou em maior sobrevida atuarial global e livre de recidiva bioquímica em pacientes do grupo de risco intermediário e aumentou a sobrevida atuarial livre de recidiva bioquímica nos pacientes do grupo de alto risco, sem aumento de toxicidade em função da irradiação das vesículas seminais. Vários estudos prospectivos aleatorizados associando supressão androgênica com radioterapia têm sido realizados, revelando benefícios em termos de sobrevida global, livre de doença, causa específica, livre de recidiva bioquímica, livre de metástases a distância e controle local(15,16). No presente estudo, a utilização de supressão androgênica neoadjuvante e concomitante resultou em maior sobrevida atuarial global em pacientes de alto risco. Pacientes de risco intermediário e de baixo risco não se beneficiaram do procedimento. O número de pacientes submetidos a supressão androgênica adjuvante foi pequeno e não permitiu análise estatística. Neste estudo, pacientes submetidos a radioterapia pélvica apresentaram menor sobrevida atuarial livre de recidiva bioquímica e livre de metástases a distância. Entretanto, os pacientes submetidos a esse tratamento tinham características tumorais mais agressivas, causando distorção dos achados. Isto foi confirmado quando não houve diferença estatística entre pacientes que fizeram ou não radioterapia pélvica e estavam no mesmo grupo de risco. Características dos pacientes associadas aos resultados de tratamento A importância de diversos fatores prognósticos relacionados ao tumor tem sido identificada na literatura, em especial, o valor de Gleason, o estádio clínico T e o PSA total inicial(14). Na presente série, valor de Gleason, PSA inicial total e estádio clínico T foram fatores prognósticos para sobrevida causa específica e livre de recidiva bioquímica. Para sobrevida livre de metástases, valor de Gleason e estádio clínico T foram significativos; o PSA inicial total foi marginalmente significativo (p = 0,0545). A divisão em grupos de risco associando PSA inicial total, valor de Gleason e estádio clínico T nesta série foi significativa para sobrevida livre de recidiva bioquímica e livre de metástases a distância, e foi marginalmente positiva para sobrevida causa específica. Todavia, na análise dos grupos de risco separadamente, verificou-se que os grupos de risco 1 e 2 são iguais e o grupo 1 apresenta melhor sobrevida causa específica do que o grupo 3. Na literatura, a ressecção transuretral prévia à RTC3D é motivo de controvérsia com relação ao controle do câncer de próstata(17,18). Na presente série, ressecção transuretral pré-RTC3D resultou em menor sobrevida causa específica e livre de metástases, sugerindo que o procedimento pode reduzir a efetividade da RTC3D. Após o diagnóstico de câncer de próstata, pacientes que esperaram mais de três meses para iniciar a RTC3D tiveram tendência a menor sobrevida livre de metástases (p = 0,0763). No entanto, quando a espera ultrapassou cinco meses do diagnóstico pela RTC3D, a sobrevida livre de metástases a distância foi significativamente maior (p = 0,0016), sugerindo que o câncer de próstata deva ser tratado em menos de cinco meses do diagnóstico. Pacientes com mais de 65 anos provavelmente têm tumores com características menos agressivas, pois apresentaram sobrevida livre de metástases maior que pacientes com 65 anos ou menos, sugerindo que os com mais de 65 anos possam se beneficiar de tratamentos menos debilitantes. Na presente série, pacientes com 50% ou menos dos fragmentos positivos tiveram maior sobrevida causa específica e sobrevida livre de recidiva bioquímica, e tendência a maior sobrevida livre de metástases (p = 0,0524), sugerindo que este seja um fator prognóstico importante a ser levado em consideração na individualização do tratamento, como reportado na literatura(19). Toxicidade tardia A RTC3D para o tratamento do câncer de próstata reduz efeitos tardios grau > 3 quando comparada com a radioterapia bidimensional convencional. A taxa de toxicidade tardia grau > 3 para 78 Gy no PTV da próstata, no estudo RTOG 94-06-grupo 1 (seis casos), foi significativamente inferior aos 18,2 casos esperados de controles históricos (RTOG 7506 e RTOG 7706) (p = 0,0042)(6). A toxicidade retal tardia tem sido associada fortemente com o volume de reto irradiado com determinada dose de radiação em diversos estudos(20). Tem-se reconhecido não ser um único ponto de dose de radiação em um volume do órgão normal que tem resultado em toxicidade retal tardia, mas um contínuo de relações entre dose e volume. Os estudos do M.D. Anderson Cancer Center, associando dose absoluta de radiação à porcentagem de volume retal, têm trazido grande auxílio para a prática clínica, tornando o tratamento radioterápico mais seguro. Em análise retrospectiva de 163 pacientes tratados com RTC3D no M.D. Anderson Cancer Center, Huang et al.(20) sugeriram que doses de 60 Gy, 70 Gy, 75,6 Gy e 78 Gy deveriam ser limitadas a 40%, 25%, 15% e 5% do volume retal, respectivamente. Em nossa análise, provavelmente em função do baixo número de pacientes com toxicidade retal tardia grau > 2, não foi observada nenhuma relação entre esta variável e a dose de radiação em determinado volume de reto ou sua associação com outra variável qualquer. Liu et al.(21) avaliaram 1.192 pacientes tratados com radioterapia e observaram que doença geniturinária coexistente, ressecção transuretral da próstata ou ressecção transuretral de tumor vesical e a presença de toxicidade urinária aguda durante a radioterapia foram fatores significativos para toxicidade urinária tardia grau 3. Na nossa série, doses maiores que 70 Gy em 30% volume de bexiga implicaram maior toxicidade urinária tardia grau 2-3. Pacientes com ressecção transuretral pré-RTC3D apresentaram maior toxicidade urinária tardia. Entretanto, o achado pode ter ocorrido em função de erro de amostra, pois pode ter havido uma seleção de pacientes com propensão a maior toxicidade urinária, vista a necessidade prévia de ressecção transuretral de próstata.
CONCLUSÕES A primeira experiência brasileira relatada de RTC3D com altas doses de radiação mostrou-se efetiva para controle de pacientes com câncer de próstata, com toxicidade retal e urinária tardias baixas, como reportado na literatura. Apesar do caráter retrospectivo e do número de pacientes relativamente limitado, o estudo sugere recomendações para a prática clínica. A irradiação de vesículas seminais pode ser benéfica em pacientes de risco intermediário, como sugere o estudo, pois houve aumento da sobrevida global e da sobrevida livre de recidiva bioquímica. O uso de supressão androgênica neoadjuvante e concomitante nos pacientes de alto risco pode aumentar a sobrevida atuarial global, e a irradiação de vesículas seminais pode resultar em maior sobrevida livre de recidiva bioquímica. A ressecção transuretral pré-RTC3D pode reduzir o controle tumoral e aumentar a toxicidade urinária tardia grau 2-3. Os dados apresentados sugerem que a restrição de dose de radiação < 70 Gy em 30% volume de bexiga pode reduzir a toxicidade urinária tardia grau 2-3.
REFERÊNCIAS 1. Instituto Nacional de Câncer. Estimativa 2008: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2007. p. 33-4. [ ] 2. Esteves SCB, Oliveira ACZ, Cardoso H, et al. Braquiterapia de alta taxa de dose no tratamento do carcinoma da próstata: análise da toxicidade aguda e do comportamento bioquímico. Radiol Bras. 2006;39:127-30. [ ] 3. Pollack A, Zagars GK, Starkschall G, et al. Prostate cancer radiation dose response: results of the M. D. Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys. 2002;53:1097-105. [ ] 4. Zietman AL, DeSilvio ML, Slater JD, et al. Comparison of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA. 2005;294:1233-9. [ ] 5. Kuban D, Pollack A, Huang E, et al. Hazards of dose escalation in prostate cancer radiotherapy. Int J Radiat Oncol Biol Phys. 2003;57:1260-8. [ ] 6. Michalski JM, Winter K, Purdy JA, et al. Toxicity after three-dimensional radiotherapy for prostate cancer on RTOG 9406 dose level V. Int J Radiat Oncol Biol Phys. 2005;62:706-13. [ ] 7. Common Terminology Criteria for Adverse Effects version 3. [cited 2005Jun 9]. Available from: http://ctep.cancer.gov/forms/CTCAEv3.pdf [ ] 8. Consensus statement: guidelines for PSA following radiation therapy. American Society for Therapeutic Radiology and Oncology Consensus Panel. Int J Radiat Oncol Biol Phys. 1997;37:1035-41. [ ] 9. Hull GW, Rabbani F, Abbas F, et al. Cancer control with radical prostatectomy alone in 1,000 consecutive patients. J Urol. 2002;167(2 Pt 1): 528-34. [ ] 10. Hanks GE, Asbell S, Krall JM, et al. Outcome for lymph node dissection negative T-1b, T-2 (A-2, B) prostate cancer treated with external beam radiation therapy in RTOG 77-06. Int J Radiat Oncol Biol Phys. 1991;21:1099-103. [ ] 11. Zagars GK, Johnson DE, von Eschenbach AC, et al. Adjuvant estrogen following radiation therapy for stage C adenocarcinoma of the prostate: long-term results of a prospective randomized study. Int J Radiat Oncol Biol Phys. 1988;14:1085-91. [ ] 12. Leibel SA, Hanks GE, Kramer S. Patterns of care outcome studies: results of the national practice in adenocarcinoma of the prostate. Int J Radiat Oncol Biol Phys. 1984;10:401-9. [ ] 13. Zelefsky MJ, Fuks Z, Hunt M, et al. High dose radiation delivered by intensity modulated conformal radiotherapy improves the outcome of localized prostate cancer. J Urol. 2001;166:876-81. [ ] 14. Partin AW, Kattan MW, Subong EN, et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA. 1997;277:1445-51. [ ] 15. Bolla M, Collette L, Blank L, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet. 2002;360: 103-6. [ ] 16. Pilepich MV, Winter K, Lawton CA, et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma - long-term results of phase III RTOG 85-31. Int J Radiat Oncol Biol Phys. 2005;61:1285-90. [ ] 17. Kupelian PA, Elshaikh M, Reddy CA, et al. Comparison of the efficacy of local therapies for localized prostate cancer in the prostate-specific antigen era: a large single-institution experience with radical prostatectomy and external-beam radiotherapy. J Clin Oncol. 2002;20:3376-85. [ ] 18. Zagars GK, Pollack A, Kavadi VS, et al. Prostate-specific antigen and radiation therapy for clinically localized prostate cancer. Int J Radiat Oncol Biol Phys. 1995;32:293-306. [ ] 19. D'Amico AV, Renshaw AA, Cote K, et al. Impact of the percentage of positive prostate cores on prostate cancer-specific mortality for patients with low or favorable intermediate-risk disease. J Clin Oncol. 2004;22:3726-32. [ ] 20. Huang EH, Pollack A, Levy L, et al. Late rectal toxicity: dose-volume effects of conformal radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys. 2002;54:1314-21. [ ] 21. Liu M, Pickles T, Agranovich A, et al. Impact of neoadjuvant androgen ablation and other factors on late toxicity after external beam prostate radiotherapy. Int J Radiat Oncol Biol Phys. 2004;58: 59-67. [ ]
Recebido para publicação em 11/11/2007
* Trabalho realizado no Instituto do Radium de Campinas (IRC), Campinas, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554