Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 42 nº 1 - Jan. / Fev. of 2009
Vol. 42 nº 1 - Jan. / Fev. of 2009
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Homero José de Farias e Melo, Denis Szejnfeld, Cristiano Silveira Paiva, Nitamar Abdala, Homero Oliveira de Arruda, Suzan Menasce Goldman, Jacob Szejnfeld |
|
|
Descritores: Espectroscopia por ressonância magnética, Próstata, Neoplasia prostática |
|
|
Resumo: VDoutor, Docente, Assistente e Pesquisador no Hospital do Servidor Público Estadual de São Paulo (IAMSPE) e no Hospital São Paulo - Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP, Brasil
INTRODUÇÃO O aumento da incidência do câncer de próstata, de 86.000 casos em 1985 para 218.890 casos em 2007 só nos Estados Unidos, fez com que esta doença tenha se tornado um importante problema médico, de saúde pública e socioeconômico(1,2). No Brasil, em 2008, estimam-se 49.530 casos novos deste tipo de câncer, segundo o Instituto Nacional de Câncer(3). Todavia, apesar do exame palpatório da próstata ser a primeira ferramenta diagnóstica, este se limita por apresentar resultado negativo para nódulos não palpáveis (estádio T1c) (4). A incerteza a respeito do valor do limite superior para o rastreamento de câncer com o antígeno prostático específico (PSA) e sua pouca especificidade contribuem para dois desafios clínicos atuais: somente um em quatro homens com PSA > 4,0 ng/ml apresenta câncer de próstata na biópsia, e cerca de um terço dos cânceres de próstata é detectado em homens com PSA normal(5). O ultrassom, amplamente utilizado em virtude do seu custo relativamente baixo, ao ser realizado com a sonda transretal oferece a melhor oportunidade de guiar a biópsia da glândula(6,7). Porém, limita-se ao estadiamento local, pela dificuldade no diagnóstico precoce da extensão extracapsular e a alta dependência do operador, o qual limita a reprodutibilidade da técnica(8,9). Entre as demais técnicas radiológicas, a ressonância magnética (RM) é a ferramenta diagnóstica mais útil para avaliação dos estádios do tumor, principalmente quando se a utiliza com a bobina endorretal(8). A imagem por RM possui sensibilidade significativamente maior (51-89%) na detecção do tumor quando comparada com a ultrassonografia transretal (USTR) (27-86%). Mas, da mesma forma, ambas têm baixa especificidade (58-94%)(8,9). Recentemente, surgiu a espectroscopia por ressonância magnética (ERM) como nova esperança diagnóstica. Ela é capaz de, a partir das informações anatômicas provenientes das imagens de RM, demonstrar os indicadores metabólicos detectados na glândula prostática, aprimorando a acurácia na provável localização do tumor(8,10-14). No Brasil, ainda são poucos os serviços de RM que possuem condições técnicas para realizar o exame da próstata com espectroscopia. Além disso, esta técnica não possui cobertura nem pelos planos de saúde, nem pelo Sistema Único de Saúde. Diante da perspectiva real da melhora significativa no diagnóstico do câncer de próstata com a ERM, procurou-se implementar um protocolo de aquisição de dados espectroscópicos no Departamento de Diagnóstico por Imagem (DDI) da Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM).
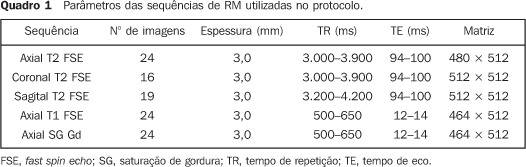
MATERIAIS E MÉTODOS O estudo foi realizado de forma prospectiva, entre fevereiro de 2004 e dezembro de 2005, em 41 pacientes do sexo masculino com idades entre 51 e 80 anos (média de 67 anos), encaminhados pelo Núcleo de Pesquisa em Próstata (Nuppro) da Unifesp/EPM. Neste período, o Nuppro atendeu cerca de 2.000 pacientes. Os pacientes foram divididos em dois grupos, caracterizados como segue: Grupo A - Pacientes com suspeita diagnóstica clínico-laboratorial de câncer, constituído por 28 pacientes, selecionados por possuírem uma ou mais biópsias negativas, e persistência de PSA elevado e/ou exame de toque retal alterado. Grupo B - Pacientes com diagnóstico confirmado de câncer de próstata, constituído por 13 pacientes, selecionados por possuírem biópsia positiva (um Gleason 3, um Gleason 5, três Gleason 6, seis Gleason 7, dois Gleason 8). Os pacientes do grupo A com suspeita diagnóstica apresentaram indicação de biópsia prostática por persistência de PSA elevado. Nestes, foi realizada a ERM para se identificar as possíveis áreas alteradas a serem abordadas na biópsia guiada por US. Nos pacientes do grupo B, além da identificação do local do tumor, também foi realizado estadiamento locorregional do câncer prostático pela RM. Os pacientes pertencentes a este grupo não foram biopsiados após a ERM, uma vez que as biópsias anteriores já eram positivas. Este protocolo foi previamente submetido e aprovado pelo Comitê de Ética Médica da Unifesp/EPM. Todos os pacientes assinaram termo de consentimento informado e esclarecido. Protocolo de exame Preparo e posicionamento do paciente O preparo do paciente para realizar o exame se resumiu ao jejum de quatro horas e aplicação de droga antiespasmódica por via intravenosa. Não foi realizada lavagem intestinal. Todos os pacientes foram instruídos previamente quanto ao exame. A colocação da bobina endorretal foi feita em decúbito lateral esquerdo. As características da bobina indicam que a linha azul presente em sua haste deve ficar voltada para a direção ventral, em relação ao paciente, e a primeira porção da haste esteja posicionada ao nível da borda anal. A cabeça da bobina endorretal foi protegida com preservativo sem lubrificante, internamente, e lubrificada com Xilocaína® em gel, por fora do preservativo. Em seguida, foi feita a insuflação do balão presente na cabeça da bobina com 100 ml de ar, para distender a parede do reto, mantendo o suporte de segurança para evitar escape da bobina e a perda do preservativo. Completada a operação, o paciente foi posicionado, lentamente, em decúbito dorsal, segurando-se a haste da bobina. O posicionamento consistiu em conectar as bobinas endorretal, arranjo-de-fase e as bobinas de coluna (SP's), com o objetivo de otimizar a aquisição das imagens e da espectroscopia. Com essas manobras, o paciente ficou posicionado em decúbito dorsal, com os pés entrando primeiro no equipamento e os braços para baixo. Por fim, o paciente foi instruído para que durante o exame se mantivesse imóvel, respirando suavemente e sem contrair o canal anal. Técnica do exame Protocolo de aquisição de imagens por RM Todos os exames foram realizados em equipamento Magnetom Sonata (Siemens Medical Systems; Erlangen, Alemanha) de 1.5 T e gradiente de 43 mT/m, no DDI-Unifesp/EPM. A bobina de radiofrequência de corpo, presente no próprio equipamento, foi usada para a excitação, e a bobina endorretal, combinada com a bobina matricial, na região pré-púbica do paciente; as SP's, localizadas na região pré-sacral do paciente, foram usadas na recepção do sinal de RM. A programação do exame de RM foi realizada conforme preconizado na literatura e demonstrado na Figura 1(8,10-13,15-18). No Quadro 1 tem-se um resumo dos parâmetros das sequências utilizadas.
No plano sagital, o posicionamento foi realizado de acordo com o maior eixo da próstata, alinhando-se a sínfise púbica à coluna lombar. No plano coronal, angulou-se o bloco pelo maior eixo da próstata. No plano axial angulou-se de acordo com o maior eixo da próstata, de modo a posicionar as imagens da sínfise púbica até o final das vesículas seminais. A injeção de contraste paramagnético (10 ml) foi realizada de forma sistemática nos pacientes, após realizar a espectroscopia, em sequências ponderadas em T1, com saturação de gordura. Protocolo para captação dos dados espectroscópicos Empregou-se um sistema de múltiplos volumes na seleção do volume espectroscópico de interesse, adquirido pela sequência PRESS CSI 3D híbrida (TR 1.300/TE 120 ms; FOV 60-100 cm2; voxel 0,10-0,22 cm3; 4-5 aquisições), disponível comercialmente pela Siemens Med-ical Systems, de modo a minimizar possíveis artefatos das estruturas periprostáticas. A programação da ERM foi realizada com as imagens ponderadas em T2 nos três planos ortogonais. Dessa forma, foi realizado o estudo de todo o volume prostático, conforme mostra a Figura 2. Além de ser angulada livremente, sem prejuízo na aquisição espectroscópica, a sequência de ERM ofereceu a possibilidade de se utilizar oito barras de saturação externas, com 30 mm de espessura, posicionadas ao redor da próstata, minimizando os efeitos da não homogeneização de campo pelo efeito de suscetibilidade magnética, originadas no ar do interior da bobina, nas estruturas ósseas, na gordura periprostática e na urina presente na bexiga e na uretra peniana. Para a espectroscopia de próstata utilizou-se a supressão espectral, tanto da água quanto da gordura, de acordo com o preconizado na literatura(8,10-13,15-18), fazendo com que os lipídios presentes na glândula prostática não interferissem na aquisição. O tempo total de exame, incluindo o posicionamento do paciente, a aquisição de imagens de RM e dos dados espectroscópicos, ficou em torno de 45 minutos. Análise das imagens e dos dados espectroscópicos Os exames foram analisados por dois examinadores em consenso, a respeito da análise morfológica, e por um examinador, em relação à análise espectral. A primeira etapa constou da análise das sequências para avaliação da morfologia prostática, áreas de alteração de sinal na zona periférica e na zona de transição, identificação de possíveis resíduos hemáticos, avaliação da gordura periprostática e integridade da vesícula seminal. A segunda etapa constou da análise da aquisição pela espectroscopia. O pós-processamento foi realizado numa estação de trabalho Leonardo® (Siemens Medical Systems; Erlangen, Alemanha). Os dados espectroscópicos foram medidos após a correção da linha de base, do desvio químico, com a água como referência e os três planos ortogonais ponderados em T2 para verificar o posicionamento do voxel. Deu-se prioridade à transformação de Fourier em três direções espaciais, aplicando-se o filtro Hamming. Todo o volume prostático foi avaliado qualitativamente. Inicialmente, foi feita verificação das áreas de interesse, ou seja, aquelas que aprresentavam aumento dos níveis de colina e diminuição dos níveis de citrato, chamadas pois de áreas-alvo. Após isto, fez-se o levantamento quantitativo e quantitativo, verificando-se a relação entre as amplitudes dos picos dos metabólitos da área-alvo. Concluídas as duas etapas, as análises foram comparadas em consenso e classificadas em três grupos: 1 - áreas detectadas pela RM em concordância com a ERM; 2 - áreas detectadas pela RM não concordantes com a ERM; 3 - áreas não detectadas pela RM e caracterizadas pela ERM. Biópsia da área-alvo As biópsias guiadas pelos resultados da RM e da ERM foram realizadas no Setor de Ultra-sonografia do DDI-Unifesp/EPM, utilizando-se um equipamento Philips SD 800 (Philips Medical Systems; Eindhoven; Holanda) e agulha 18 G. Os radiologistas foram informados da posição da área-alvo, de acordo com a nomenclatura de McNeal(19). Nos pacientes com RM e ERM sem áreas suspeitas, foram realizadas biópsias randomizadas, com obtenção de 18 fragmentos. Análise estatística Foi realizado estudo descritivo da amostra, por conta do número reduzido de pacientes. Mesmo com esta limitação, procurou-se demonstrar os achados mais relevantes por medidas de associação (sensibilidade, especificidade, acurácia, valor preditivo positivo e valor preditivo negativo).
RESULTADOS Em relação às alterações identificadas à ERM e/ou à RM, comparadas aos resultados das biópsias após a ERM, nos 28 pacientes do grupo A (PSA elevado e biópsia negativa), 12 apresentaram alteração tanto na RM quanto na ERM, 8 somente na ERM, em 7 não se observaram alterações, e em um, apenas na RM. Relacionou-se, no grupo A, a relação das amplitudes citrato/colina (positivo: 0,221 ± 0,166; negativo: 1,441 ± 0,562) e (colina + creatina)/citrato (positivo: 7,922 ± 4,976; negativo: 2,151 ± 1,089). Estes dados foram mensurados de forma sistemática, utilizando-se o mesmo protocolo de análise na área-alvo de todos os pacientes estudados. Para o grupo A obtiveram-se sensibilidade de 100%, especificidade de 47%, acurácia de 58%, valor preditivo positivo de 37% e valor preditivo negativo de 100%, para os pacientes que apresentaram alterações tanto à RM quanto à ERM (Figura 3). Dos 13 pacientes pertencentes ao grupo B, todos apresentaram alteração, tanto na RM quanto na ERM. As amplitudes da relação citrato/colina (média: 0,369 ± 0,231) e (colina + creatina)//citrato (média: 5,471 ± 4,355) do grupo B foram medidas de forma sistemática, utilizando o mesmo protocolo de análise, na área com câncer de todos os pacientes estudados. Para o grupo B obtiveram-se sensibilidade, especificidade, acurácia, valor preditivo positivo e valor preditivo negativo de 100%.
DISCUSSÃO O rastreamento do câncer de próstata se apóia no fato de que os assim detectados tendem a apresentar um estádio mais favorável quando comparados com os cânceres diagnosticados clinicamente e com uma possível diminuição da mortalidade específica pelo câncer de próstata. A imagem obtida por RM é comumente usada para o estadiamento depois do diagnóstico ser estabelecido pela biópsia prostática. Na doença confinada à próstata a cápsula aparecerá intacta, mesmo se existir um contato extenso ou abaulamento regular entre ela e o tumor(8,20). Além disso, a RM pode demonstrar também a anatomia da próstata, ao identificar áreas de alteração de intensidade de sinal, as quais podem representar lesão focal na glândula. Assim, propicia uma extensa avaliação dos pacientes com câncer de próstata, pela capacidade de observação da doença primária e o envolvimento de linfonodos locorregionais(20,21). Nas imagens ponderadas em T1, a próstata aparece homogênea com isossinal e não são demonstradas a anatomia zonal e as doenças intraprostáticas. Estas são observadas em imagens ponderadas em T2, pois o câncer apresenta-se como uma área de hipossinal na zona periférica, que é hiperintensa(21). Os avanços técnicos para melhor detecção dos sinais pelas antenas de RM levaram ao desenvolvimento da bobina endorretal(22). As imagens de RM com a bobina endorretal apresentam acurácia acima de 97% na localização de lesões conhecidas da próstata, no entanto, sua performance é baixa na detecção de tumores focais menores que 5 mm de diâmetro(23). A ERM da próstata aumenta as possibilidades de diagnóstico de câncer, ao acrescentar às informações morfológicas da RM dados metabólicos da glândula. Apresenta variação, na sensibilidade, de 68% a 95%, e na especificidade, de 70% a 91%(21,24). Entre as vantagens apontadas para o uso dessa técnica na determinação do câncer de próstata, incluem-se: localização espectral acurada de cada pequena região de morfologia anormal; correlação exata do mapa espectral com as imagens de alta resolução da RM; avaliação da extensão do metabolismo anormal; cobertura tridimensional de toda a glândula(17). Observa-se uma variação quando se combinam os resultados das imagens por RM com as informações metabólicas da ERM. Elas produzem, somadas, sensibilidade entre 56% e 94% e especificidade de 70% a 98%(10,24,25). Em 2004, Yuen et al.(26) observaram que as informações da RM, juntamente com as da ERM, tiveram sensibilidade de 100% e especificidade de 70,3% na determinação das áreas suspeitas. Em 2005, Prando et al.(27) verificaram que a RM combinada com a ERM apresentou alta sensibilidade (84% a 100%) e baixa especificidade (44% a 71%) na identificação de áreas-alvo. Observou-se, no presente trabalho, que alterações na RM ou na ERM isoladas apresentam especificidade muito baixa. Assim, a valorização dos achados ocorre quando tanto o hipossinal da zona periférica na RM quanto as inversões metabólicas da ERM estiverem presentes (acurácia de 58%). Com relação à sensibilidade da RM somada à ERM na detecção do câncer prostático (grupo A), este trabalho está em concordância com os anteriores. Porém, no que se refere à especificidade, ficou abaixo (47%) do descrito pela literatura, concordando apenas com Prando et al.(27), inclusive no que se refere ao grupo de estudo. Assim, informações detectadas pela ERM em relação à provável localização do câncer de próstata podem ajudar na programação de biópsias guiadas por USTR, principalmente em pacientes com PSA indicativo de câncer e com biópsias prévias negativas. Podem também melhorar a estratificação dos pacientes na triagem clínica e o monitoramento dos pacientes, desde o simples acompanhamento clínico ao tratamento minimamente agressivo(17). A implantação do protocolo de trabalho passou por várias etapas. Com a instalação do equipamento de RM Magnetom Sonata no Departamento de Diagnóstico por Imagem, deu-se a primeira etapa de implantação, no ano de 2004, onde se adaptaram as sequências de pulso de RM e de espectroscopia disponível comercialmente pela Siemens às condições de trabalho. A segunda etapa de implantação do protocolo de ERM da próstata consistiu na elaboração dos critérios da análise espectral. Com isto, padronizou-se uma forma de análise dos dados espectrais, envolvendo tanto um estudo qualitativo quanto quantitativo, adaptando-se o que é preconizado pela literatura(8,10-13,15-18,21,24-27,28) . Além disso, procurou-se também normatizar o laudo desses exames e a programação da biópsia guiada pela USTR a partir das informações da RM e da ERM. Porém, estas etapas foram modificadas para melhor se adequar às necessidades do diagnóstico, sem contar ainda com o aspecto de se estar no início da curva de aprendizagem. A valorização de determinadas inversões metabólicas nos primeiros pacientes contribuíram para que o resultado da acurácia do método ficasse abaixo do da literatura, em torno de 58%. Esta dificuldade no diagnóstico pode ser explicada pelo fato de a ERM, assim como as imagens por RM, também serem influenciadas pelos processos inflamatórios (prostatite), pela hemorragia pós-biópsia e pelos diversos tipos de tratamento como hormonioterapia, radioterapia, crioterapia, entre outros(21,25,29). No que se refere à relação matemática, verificou-se que o uso da creatina precisa ser mais bem avaliado, verificando-se até que ponto sua amplitude está sofrendo influência da colina e das espermidinas. Isto foi demonstrado pelo maior número de falso-positivos, com a relação matemática (colina + creatina)/citrato.
CONCLUSÃO A implantação e padronização da ERM permitiu a obtenção de informações importantes para o diagnóstico presuntivo da existência de câncer de próstata, combinando as imagens por RM com os dados metabólicos da ERM. Agradecimento À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), pelo suporte financeiro.
REFERÊNCIAS 1. Silverberg E. Cancer statistics, 1985. CA Cancer J Clin. 1985;35:19-35. [ ] 2. American Cancer Society. Cancer facts & figures 2007. Atlanta: ACS; 2007. [ ] 3. Instituto Nacional de Câncer. Coordenação de Prevenção e Vigilância de Câncer. Estimativas 2008: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2007. [ ] 4. Carter HB, Sauvageot J, Walsh PC, et al. Prospective evaluation of men with stage T1C adenocarcinoma of the prostate. J Urol. 1997;157:2206-9. [ ] 5. Thompson I, Leach RJ, Pollock BH, et al. Prostate cancer and prostate-specific antigen: the more we know, the less we understand. J Natl Cancer Inst. 2003;95:1027-8. [ ] 6. Clements R. Contemporary ultrasound guided biopsy in the diagnosis of prostate cancer. Imaging. 2001;13:18-26. [ ] 7. Halpern EJ, Rosenberg M, Gomella LG. Prostate cancer: contrast-enhanced US for detection. Radiology. 2001;219:219-25. [ ] 8. Yu KK, Hricak H. Imaging prostate cancer. Radiol Clin North Am. 2000;38:59-85. [ ] 9. Punglia RS, D'Amico AV, Catalona WJ. Effect of verification bias on screening for prostate cancer by measurement of prostate-specific antigen. N Engl J Med. 2003;349:335-42. [ ] 10. Scheidler J, Hricak H, Vigneron DB, et al. Prostate cancer: localization with three-dimensional proton MR spectroscopic imaging - clinicopathologic study. Radiology. 1999;213:473-80. [ ] 11. Qayyum A, Coakley FV, Lu Y, et al. Organ-confined prostate cancer: effect of prior transrectal biopsy on endorectal MRI and MR spectroscopic imaging. AJR Am J Roentgenol. 2004;183:1079-83. [ ] 12. Yu KK, Scheidler J, Hricak, H, et al. Prostate cancer: prediction of extracapsular extension with endorectal MR imaging and three-dimensional proton MR spectroscopic imaging. Radiology. 1999;213:481-8. [ ] 13. Kurhanewicz J, Vigneron DB, Males RG, et al. The prostate: MR imaging and spectroscopy. Present and future. Radiol Clin North Am. 2000; 38:115-38. [ ] 14. Westphalen AC, Coakley FV, Qayyum A, et al. Peripheral zone prostate cancer: accuracy of different interpretative approaches with MR and MR spectroscopic imaging. Radiology. 2008;246: 177-84. [ ] 15. van der Graaf M, Schipper RG, Oosterhof GON, et al. Proton MR spectroscopy of prostatic tissue focused on the detection of spermine, a possible biomarker of malignant behavior in prostate cancer. Magn Reson Mat Biol Phys Med. 2000;10: 153-9. [ ] 16. Rajesh A, Coakley FV. MR imaging and MR spectroscopic imaging of prostate cancer. Magn Reson Imaging Clin N Am. 2004;12:557-79. [ ] 17. Kurhanewicz J, Vigneron DB, Hricak H, et al. Three-dimensional H-1 MR spectroscopic imaging of the in situ human prostate with high (0.24-0.7 cm3) spatial resolution. Radiology. 1996;198: 795-805. [ ] 18. Thomas MA, Narayan P, Kurhanewicz J, et al. 1H MR spectroscopy of normal and malignant human prostates in vivo. J Magn Reson. 1990;87:610-9. [ ] 19. McNeal JE. The prostate gland: morphology and pathobiology. Monogr Urol. 1983;4:5-13. [ ] 20. Outwater EK, Petersen RO, Siegelman ES, et al. Prostate carcinoma: assessment of diagnostic criteria for capsular penetration on endorectal coil MR images. Radiology. 1994;193:333-9. [ ] 21. Shukla-Dave A, Hricak H, Eberhardt SC, et al. Chronic prostatitis: MR imaging and 1H MR spectroscopic imaging findings - initial observations. Radiology. 2004;231:717-24. [ ] 22. Draisma G, Boer R, Otto SJ, et al. Lead times and overdetection due to prostate-specific-antigen screening: estimates from the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst. 2003;95:868-78. [ ] 23. Beyersdorff D, Taupitz M, Winkelmann B, et al. Patients with a history of elevated prostate-specific antigen levels and negative transrectal US-guided quadrant or sextant biopsy results: value of MR imaging. Radiology. 2002;224:701-6. [ ] 24. Ackerstaff E, Pflug BR, Nelson JB, et al. Detection of increased choline compounds with proton nuclear magnetic resonance spectroscopy subsequent to malignant transformation of human prostatic epithelial cells. Cancer Res. 2001;61:3599-603. [ ] 25. Zakian KL, Eberhardt S, Hricak H, et al. Transition zone prostate cancer: metabolic characteristics at 1H MR spectroscopic imaging - initial results. Radiology. 2003;229:241-7. [ ] 26. Yuen JS, Thng CH, Tan PH, et al. Endorectal magnetic resonance imaging and spectroscopy for the detection of tumor foci in men with prior negative transrectal ultrasound prostate biopsy. J Urol. 2004;171:1482-6. [ ] 27. Prando A, Kurhanewicz J, Borges AP, et al. Prostatic biopsy directed with endorectal MR spectroscopic imaging findings in patients with elevated prostate specific antigen levels and prior negative biopsy findings: early experience. Radiology. 2005;236:903-10. [ ] 28. Amsellem-Ouazana D, Younes P, Conquy S, et al. Negative prostatic biopsies in patients with a high risk of prostate cancer: is the combination of endorectal MRI and magnetic resonance spectroscopy imaging (MRSI) a useful tool? A preliminary study. Eur Urol. 2005;47:582-6. [ ] 29. Ikonen S, Kivisaari L, Tervahartiala P, et al. Prostatic MR imaging. Accuracy in differentiating cancer from other prostatic disorders. Acta Radiol. 2001;42:348-54. [ ]
Recebido para publicação em 28/5/2008.
* Trabalho realizado no Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554