Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 43 nº 3 - Maio / Jun. of 2010
Vol. 43 nº 3 - Maio / Jun. of 2010
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): José Leite Gondim Cavalcanti Filho, Léa Mirian Barbosa da Fonseca, Romeu Côrtes Domingues, Roberto Côrtes Domingues, Luiz Souza de Machado Neto, Emerson Leandro Gasparetto |
|
|
Descritores: Fluordeoxiglicose, FDG, Tomografia por emissão de pósitrons, PET, Imagem por ressonância magnética, Fusão, Neurologia |
|
|
Resumo: VMestre, Médico Nuclear da Clínica Multi-Imagem PET, Rio de Janeiro, RJ, Brasil
INTRODUÇÃO Trabalhos clínicos recentes têm demonstrado que a tomografia por emissão de pósitrons/tomografia computadorizada (PET/TC) tem mais precisão na avaliação de pacientes com suspeita de malignidade e para estadiamento do que outros aparelhos nos quais o exame é feito por interpretação pelo PET ou pela TC separadamente(1). Na prática clínica, o uso de métodos de imagem multimodalidade já é uma realidade, especialmente no campo da medicina nuclear, e praticamente todos os aparelhos de PET representam, na verdade, sistemas integrados PET/TC. A interpretação do PET sem a fusão com outras modalidades de imagem, com melhor definição anatômica, como TC e ressonância magnética (RM), apresenta baixa especificidade e valor preditivo positivo diminuído. Nesses últimos anos, muito tem-se pesquisado a respeito da integração do PET com a RM(2). Supõe-se grande potencial nessa integração para o diagnóstico de doenças neurológicas, isto porque o PET é um método muito sensível para a detecção de alterações metabólicas, mas com limitada resolução espacial. Por outro lado, a RM, além de apresentar importante resolução espacial, avaliando com excelente contraste estruturas com sinal de partes moles como o cérebro, possui ainda capacidades funcionais.
ASPECTOS TÉCNICOS Basicamente, existem três maneiras de integrar o PET com a RM(3): 1) os aparelhos PET e RM são independentes e ficam localizados em salas distintas. A integração das imagens é feita por programas especializados, gerando, assim, uma flexibilidade, já que os sistemas podem ser usados separadamente; 2) imagens sequenciais são realizadas em aparelhos distintos, só que, neste caso, o paciente fica na mesma maca de exame, sendo que esta é transferida entre as máquinas. É, portanto, hardware-fused; 3) por último, por meio de sistemas completamente integrados, em que se realiza a aquisição simultânea das imagens. Por exemplo, em uma única posição de mesa, nem o paciente, nem a maca movimentam-se. Em alguns casos, a aquisição simultânea de imagens é fundamental, já que determinados radiofármacos têm farmacocinéticas diferentes. Por exemplo, a H2O-15O entra e sai do volume de interesse em minutos, sendo, neste caso, necessário este tipo de aquisição. Já a fluordeoxiglicose (FDG) necessita de uns 45 minutos para a sua biodistribuição, não sendo, assim, a aquisição simultânea um fato relevante. A fusão de imagens por programas especializados já era usada mesmo antes do advento dos aparelhos híbridos. De fato, foi este método de fusão que iniciou o caminho da integração das imagens por sistemas híbridos. O corregistro de imagens do cérebro por software já está bem validado, em virtude da natureza sólida deste órgão(4). Em uma comparação com vários softwares disponíveis para fusão de PET-RM e PET-TC, a acurácia atingida foi de 2-3 mm, que é menor do que a dimensão de um pixel do PET(4). Dessa forma, a fusão de imagens de PET cerebral com FDG e RM torna-se um método atraente na avaliação não invasiva de doenças neurológicas.
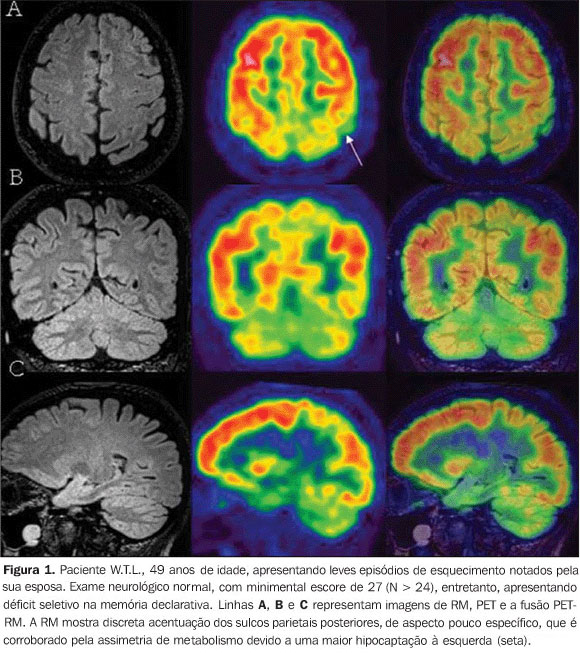
PET-RM NO DÉFICIT COGNITIVO/DEMÊNCIA Recentemente, foi introduzido o conceito de déficit cognitivo leve, que diz respeito a um déficit de memória similar à doença de Alzheimer, mas sem outros critérios desta(5). Pacientes com déficit cognitivo leve têm uma taxa de conversão para doença de Alzheimer de aproximadamente 10-15% ao ano. Por essa razão, é muito importante identificar esses pacientes para que se possa instituir o tratamento mais precocemente. Cerca de 60-70% dos pacientes com quadro de déficit cognitivo leve e que apresentem hipometabolismo moderado a grave em córtex associativo (Figura 1), mesmo com testes como o minimental com escores normais, podem evoluir para demência dentro de dois anos. Doença de Alzheimer precoce tende a ter hipometabolismo nos lobos parietal, temporal e cíngulo posterior, sendo essas alterações facilmente identificadas pelo PET (Figura 2)(6).
A importância da fusão com a RM é a identificação de alterações metabólicas em pequenas estruturas de difícil localização anatômica pelo PET, como, por exemplo, o hipocampo (Figura 3), que está intimamente relacionado com um déficit cognitivo futuro e doença de Alzheimer, assim como o giro angular e o precuneus. A demência frontotemporal não é uma entidade clínica específica, tendo um espectro que inclui desde a doença de Pick clássica até a afasia progressiva primária. Ela pode ser identificada pelo PET através de um hipometabolismo frontal ou frontotemporal (Figura 4). O diagnóstico clínico de demência vascular é sempre um desafio, já que não existe um consenso e a convergência entre os existentes é fraca. Além disso, 20-40% dos pacientes com demência vascular têm associada doença de Alzheimer(7). Como a RM é muito sensível na identificação de lesões estruturais, mas pouco específica para doença de Alzheimer, é comum pacientes terem diagnóstico tendencioso de demência vascular. Por isso, a fusão das imagens estruturais da RM e metabólicas do PET aparecem como uma ferramenta relevante na correta classificação dessas demências.
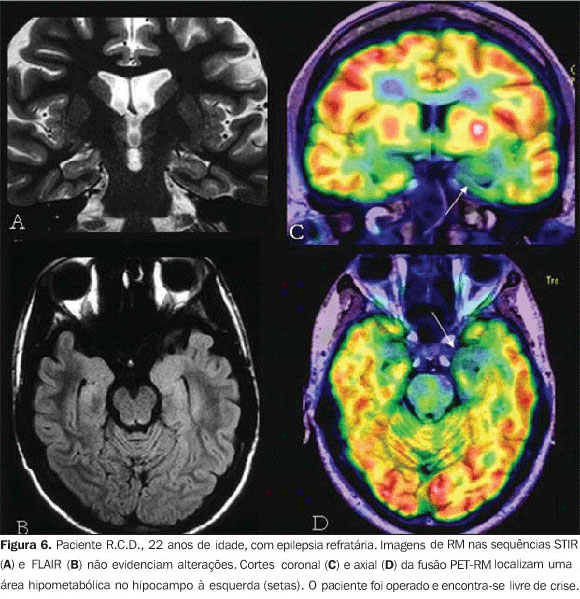
PET-RM EM EPILEPSIA O tratamento medicamentoso para epilepsia é ineficaz em considerável número de pacientes. A ressecção completa do foco epileptogênico pode levar ao fim das crises em 90% dos pacientes com epilepsia de lobo temporal mesial e em até 70% dos pacientes com displasia cortical. A RM é o método de escolha na busca da lesão epileptogênica. O PET-FDG traz importante informação prognóstica, pois é sabido que hipometabolismo de localização restrita ao lobo temporal está 75% correlacionado a cura pela cirurgia desses pacientes, em contrapartida com apenas 45% daqueles com hipometabolismo extratemporal (Figuras 5 e 6)(8).
A fusão do PET-FDG com a RM tem papel muito importante na identificação da displasia cortical (Figura 7), especialmente pacientes com displasia tipo I de Palmini, levando a um aumento de 18% na detecção desta doença(9).
PET-RM NO PARKINSONISMO Diferenciar clinicamente as síndromes parkinsonianas nos estágios iniciais pode ser muito difícil. Exames morfológicos como a TC e a RM são normalmente usados para excluir outras causas que podem estar levando ao parkinsonismo. O PET-FDG pode ser usado nos casos duvidosos (Figura 8)(10). Além da doença de Parkinson já descrita, outros parkinsonismos podem ser investigados, como a paralisia supranuclear progressiva, a atrofia de múltiplos sistemas e a degeneração corticobasal. Traçadores como a FDOPA-18F e o Racloporide-11C são mais específicos, já que são um indicador da função e integridade dos terminais dopaminérgicos pré-sinápticos e pós-sinápticos, entretanto, ainda não estão disponíveis no mercado brasileiro.
CONCLUSÃO O corregistro de imagens cerebrais do PET com RM torna-se ferramenta diagnóstica não invasiva extremamente atraente. Isto porque, como a fusão de imagens do encéfalo por meio de programas tem ótima acurácia, é possível unir a modalidade mais sensível e específica na detecção de alterações metabólicas (PET) com outra que apresenta importante resolução espacial, além de avaliar estruturas com intensidade de sinal de partes moles com excelente contraste (RM).
REFERÊNCIAS 1. Ishikita T, Oriuchi N, Higuchi T, et al. Additional value of integrated PET/CT over PET alone in the initial staging and follow up of head and neck malignancy. Ann Nucl Med. 2010 Jan 8. [Epub ahead of print] [ ]. 2. Yamamoto S, Imaizumi M, Kanai Y, et al. Design and performance from an integrated PET/MRI system for small animals. Ann Nucl Med. 2010 Jan 8. [Epub ahead of print] [ ]. 3. von Schulthess GK, Schlemmer HP. A look ahead: PET/MR versus PET/CT. Eur J Nucl Med Mol Imaging. 2009;36 Suppl 1:S3-9. [ ] 4. West J, Fitzpatrick JM, Wang MY, et al. Comparison and evaluation of retrospective intermodality brain image registration techniques. J Comput Assist Tomogr. 1997;21:554-66. [ ] 5. Petersen RC, Doody R, Kurz A, et al. Current concepts in mild cognitive impairment. Arch Neurol. 2001;58:1985-92. [ ] 6. Silverman DH, Small GW, Chang CY, et al. Positron emission tomography in evaluation of dementia: regional brain metabolism and long term outcome. JAMA. 2001;286:2120-7. [ ] 7. Jellinger KA. The pathology of ischemic-vascular dementia: an update. J Neurol Sci. 2002;203-204:153-7. [ ] 8. Goffin K, Dedeurwaerdere S, Van Laere K, et al. Neuronuclear assessment of patients with epilepsy. Semin Nucl Med. 2008;(38):227-39. [ ] 9. Salamon N, Kung J, Shaw SJ, et al. FDG-PET/MRI coregistration improves detection of cortical dysplasia in patients with epilepsy. Neurology. 2008;71:1594-601. [ ] 10. Eidelberg D, Moeller JR, Ishikawa T, et al. Early differential diagnosis of Parkinson's disease with 18F-fluorodeoxyglucose and positron emission tomography. Neurology. 1995;45:1995-2004. [ ]
Recebido para publicação em 1/2/2010.
* Trabalho realizado nas Clínicas de Diagnóstico Por Imagem (CDPI) e Multi-Imagem PET, Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554