Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 55 nº 3 - Maio / Jun. of 2022
Vol. 55 nº 3 - Maio / Jun. of 2022
|
ENSAIO PICTÓRICO
|
|
|
|
|
Autho(rs): João Luiz Veloso Mourão1,a; Luiz Fernando Monte Borella1,b; Juliana Ávila Duarte2,c; Mariana Dalaqua3,d; Daniel Alvarenga Fernandes1,e; Fabiano Reis1,f |
|
|
Descritores: Doença de von Hippel-Lindau; Hemangioblastoma; Saco endolinfático/patologia; Ressonância magnética; Tomografia computadorizada. |
|
|
Resumo: INTRODUÇÃO
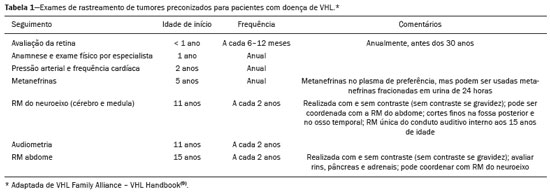
A doença de von Hippel-Lindau (VHL) é uma doença tumoral hereditária autossômica dominante que está relacionada a mutações na linha germinativa no gene VHL, que atua como um gene supressor tumoral, localizado no braço curto do cromossomo 3 (3p25–26)(1,2). A incidência estimada é de 1:36.000 indivíduos, com penetrância > 90% a partir dos 65 anos(3). A doença geralmente se manifesta na idade adulta jovem, com idade média de início aos 33 anos, e predispõe os pacientes afetados ao desenvolvimento de tumores benignos e malignos, envolvendo principalmente o sistema nervoso central (SNC) e vísceras(4). A média da expectativa de vida dos pacientes com esta doença é de 49 anos, sendo as causas mais comuns de óbito o carcinoma renal de células claras e os hemangioblastomas(5). A maioria das lesões relacionadas à doença é tratável e a vigilância é recomendada de acordo com vários protocolos. A doença de VHL pode ser classificada de acordo com fenótipos clínicos e a classificação se correlaciona com genótipos particulares: tipo 1 – baixo risco para feocromocitoma, alto risco para hemangioblastomas, carcinoma renal de células claras, cistos e tumores neuroendócrinos pancreáticos; tipo 2A – alto risco para feocromocitoma, baixo risco para carcinoma renal de células claras; tipo 2B – alto risco para feocromocitoma e carcinoma renal de células claras; tipo 2C – alto risco apenas para feocromocitoma(1). Os tumores característicos do SNC na doença de VHL incluem hemangioblastomas retinianos, cerebelares e medulares e os tumores do saco endolinfático(3). O diagnóstico clínico da doença de VHL pode ser considerado nas seguintes circunstâncias: a) nos pacientes com história familiar de doença de VHL e pelo menos um dos tumores característicos relacionados a ela (hemangioblastomas retinianos e do SNC, carcinoma renal de células claras, tumores neuroendócrinos pancreáticos e tumores do saco endolinfático); b) na presença de dois ou mais hemangioblastomas retinianos ou no SNC; c) na presença de um hemangioblastoma retiniano ou no SNC, mais ao menos um dos tumores viscerais característicos da doença de VHL, excluindo cistos renais e epididimários(1). O teste genético de mutações germinativas no gene VHL pode também confirmar o diagnóstico. Nesse contexto, os exames de imagem têm papel importante no diagnóstico e seguimento dos pacientes portadores de doença de VHL. MANIFESTAÇÕES INTRACRANIANAS A doença de VHL é caracterizada pelos hemangioblastomas no SNC, afetando de 60% a 80% dos pacientes portadores da doença. Esses tumores são benignos (grau I pela Organização Mundial da Saúde), multifocais e histologicamente se caracterizam por ampla rede vascular e células estromais vacuolizadas, que podem apresentar grande volume. Os hemangioblastomas podem se apresentar como lesões nodulares ou sólido-císticas(3), acometendo principalmente o cerebelo e a medula espinhal(6). Tais lesões costumam evoluir com fases de crescimento e fases de estabilidade, com a idade média de início dos sintomas aos 33 anos. Os sintomas são variáveis, dependentes do efeito expansivo e da localização dos tumores(1,3). HEMANGIOBLASTOMAS CEREBELARES A prevalência dos hemangioblastomas cerebelares na doença de VHL é de 44% a 72%. Aproximadamente, 5% a 30% de todos os hemangioblastomas cerebelares são atribuídos à doença de VHL(6). Os pacientes acometidos podem apresentar ataxia, dismetria, cefaleia, diplopia, vertigem e vômitos. Tais sintomas ocorrem porque os cistos relacionados aos hemangioblastomas crescem mais rapidamente que os próprios tumores primários e exercem importante efeito expansivo local(1). A localização nos hemisférios cerebelares pode estar relacionada ao aparecimento de ataxia e dismetria. As lesões cerebelares são próximas à superfície pial, comumente císticas, de paredes finas e com componentes sólidos excêntricos(6). Imagens de tomografia computadorizada (TC) mostram cistos homogêneos com paredes bem definidas e nódulo mural excêntrico e isodenso no estudo pré-contraste, e com intenso realce pós-contraste. Na ressonância magnética (RM), os hemangioblastomas apresentam componente cístico hipointenso em T1 e isointenso ou hiperintenso em T2 (Figura 1). O componente sólido classicamente é caracterizado por facilitação à difusão e intenso realce pós-contraste(1). Flow voids exuberantes relacionados aos vasos tumorais podem ser observados com frequência. Quando um hemangioblastoma cerebelar é identificado, é importante pesquisar ativamente outros focos de realce em todo o neuroeixo, pois a presença de outros hemangioblastomas sugere a doença de VHL(2,6). Hemangioblastomas apresentam abundantes vasos tumorais devido à expressão aumentada de fator de crescimento endotelial vascular(7), justificando o aumento do volume sanguíneo cerebral relativo desses tumores nas sequências de perfusão (Figura 2). 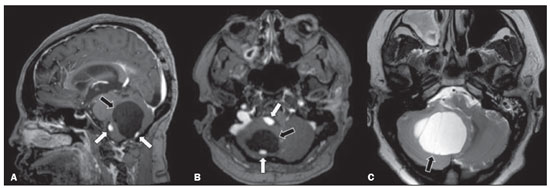 Figura 1. Paciente do sexo feminino, 30 anos, com doença de VHL e hemangioblastomas cerebelares. As imagens T1 pós-contraste sagital (A) e axial (B) revelam lesões sólido-císticas com efeito expansivo no hemisfério cerebelar direito, nas quais o componente cístico apresenta hipossinal (setas pretas) e os nódulos sólidos excêntricos (setas brancas) têm intenso realce, o conjunto determinando compressão sobre o IV ventrículo e desvio contralateral do vérmis. A imagem axial T2 (C) destaca o componente cístico com intenso hipersinal (seta) comprimindo o bulbo e promovendo sua discreta rotação no sentido horário. 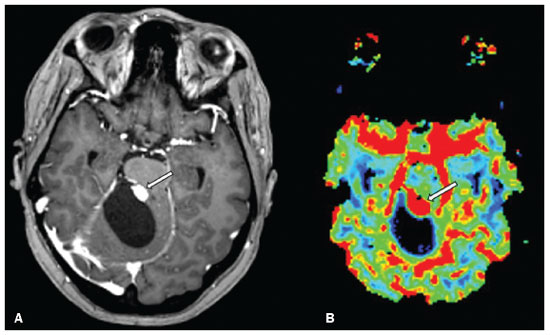 Figura 2. Paciente do sexo feminino, 30 anos, com doença de VHL e hemangioblastomas cerebelares. Imagem axial de RM T1 pós-contraste (A) mostra lesão sólido-cística no hemisfério cerebelar direito, caracterizada por hipossinal do seu componente cístico e intenso realce do seu componente sólido excêntrico (seta). O mapa de volume sanguíneo cerebral (B) revela aumento perfusional na região captante de contraste (seta). HEMANGIOBLASTOMAS NA MEDULA ESPINHAL Na medula espinhal, os hemangioblastomas ocorrem em 13% a 59% dos casos de doença de VHL. Qualquer segmento da medula espinhal pode ser acometido, porém, são mais prevalentes nos segmentos torácico e cervical(6). Os sintomas predominantes estão relacionados a radiculopatia e mielopatia, como hiperestesia, fraqueza, ataxia, hiperreflexia, dor, incontinência e até quadriplegia. A TC sem contraste revela nódulo isodenso na medula espinhal, com intenso realce na fase pós-contraste. Nas imagens de RM, o nódulo tumoral tende a ser hipointenso nas aquisições ponderadas em T1 e hiperintenso nas aquisições ponderadas em T2, frequentemente com flow voids regionais (Figura 3). Os nódulos apresentam intenso realce pós-contraste e há siringomielia associada em 50% a 100% dos casos(1). 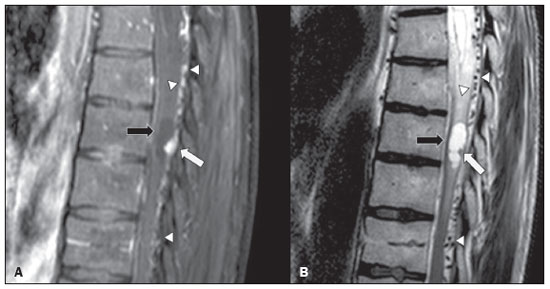 Figura 3. Paciente do sexo masculino, 52 anos, com doença de VHL e hemangioblastomas na medula espinhal. As imagens sagitais T1 pós-contraste (A) e T2 (B) revelam uma lesão sólido- cística intramedular na altura de T9. Na imagem A destaca-se nódulo sólido excêntrico com realce (seta branca) e seu componente cístico (seta preta). Na imagem B nota-se o hipersinal em T2 do componente cístico (seta preta) e o componente nodular isointenso posterior (seta branca), que corresponde ao nódulo sólido excêntrico da lesão. Notam-se ainda áreas de realce superficiais na medula (A), que correspondem a flow voids em B, que representam veias perimedulares dilatadas (cabeças de setas). METÁSTASE Metástase para o SNC mais comumente se origina de carcinoma renal de células claras (Figura 4). Menos frequentemente, as metástases se originam de feocromocitoma/paraganglioma ou tumores neuroendócrinos metastáticos(8). 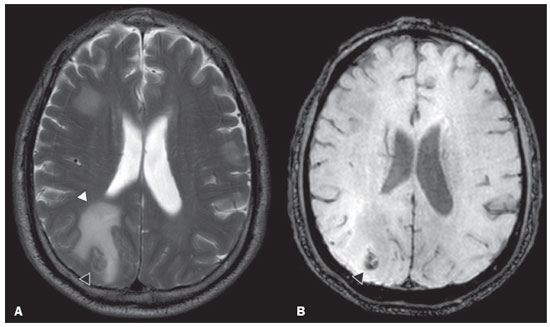 Figura 4. Paciente do sexo masculino, 55 anos, com doença de VHL e carcinoma renal de células claras, com múltiplas metástases para o encéfalo. Em área do lobo parietal direito há componente com baixo sinal em T2 (A – cabeça de seta preta) na transição corticossubcortical e moderado edema perilesional (A – cabeça de seta branca). Na sequência de suscetibilidade (B) a lesão corticossubcortical (cabeça de seta) demonstra marcado hipossinal (hemorragia), caracterizando metástase cerebral hemorrágica (posteriormente confirmada por cirurgia). HEMANGIOBLASTOMAS RETINIANOS Os hemangioblastomas retinianos são frequentes na doença de VHL, presentes em até 60% dos pacientes. A idade média de apresentação é aos 25 anos, entretanto, estima-se que em até 5% dos casos se manifestem em pacientes com menos de 10 anos de idade(3). Envolvimento bilateral pode ocorrer em até 50% dos casos. Em até 6% dos pacientes, os hemangioblastomas retinianos podem causar complicações como exsudação macular, descolamento de retina exsudativo ou tracional, hemorragia vítrea, glaucoma neovascular e amaurose. Os achados histopatológicos incluem células endoteliais fenestradas, pericitos e células estromais espumosas ricas em lipídios. O diagnóstico é confirmado pela oftalmoscopia, caracterizando-se tumor com vasos tortuosos e edema do disco óptico. A TC e a RM podem revelar lesões nodulares retinianas com realce pós-contraste, associadas ou não a descolamento de retina (Figura 5)(1). 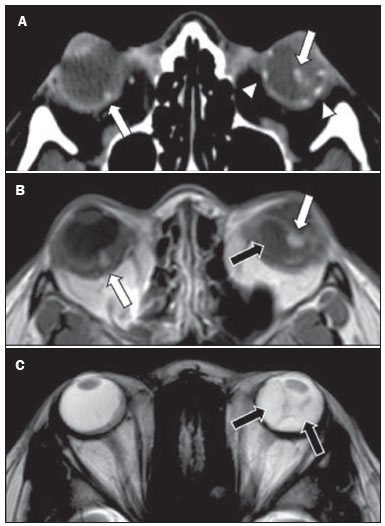 Figura 5. Paciente do sexo feminino, 30 anos, com doença de VHL e hemangioblastomas retinianos. TC pós-contraste (A) mostra nódulos com realce ao longo da retina direita e no contorno posterior do globo ocular direito e na região central do globo ocular esquerdo (setas) e focos de calcificação na região da coroide à esquerda (cabeças de setas), compatíveis com hemangioblastomas retinianos. A imagem axial de RM T1 pós-contraste (B) mostra lesões nodulares com realce, uma junto ao contorno posterior espessado do globo ocular direito, outra à esquerda junto à retina anteriorizada e descolada (setas brancas), compatíveis com hemangioblastomas. A imagem axial T2 (C) detalha o descolamento da retina à esquerda (setas). TUMORES DO SACO ENDOLINFÁTICO Os tumores do saco endolinfático ocorrem em até 15% dos casos. A média de idade de apresentação é aos 22 anos e podem ser bilaterais em até 30% dos pacientes(1,6). Os tumores do saco endolinfático são cistoadenomas papilares altamente vascularizados que crescem na região petrosa posterior do osso temporal(3). Esses tumores são benignos e se desenvolvem no aqueduto vestibular, porém são localmente invasivos e podem erodir estruturas adjacentes, como os canais semicirculares e a cóclea. Os sintomas são perda auditiva, tinnitus, vertigem e paralisia do nervo facial. A janela óssea da TC demonstra lesão óssea com padrão em “roído de traça” na região petrosa do osso temporal, com erosão do aqueduto vestibular, dos canais semicirculares e da cóclea. Na fase pós-contraste, o tumor apresenta intenso realce. A RM revela hipersinal nas aquisições ponderadas em T1 (denotando a presença de conteúdo hemorrágico/proteináceo) e hipersinal heterogêneo em T2. As imagens T1 pós-contraste demonstram intenso realce nos componentes sólidos do tumor (Figura 6)(1,6). 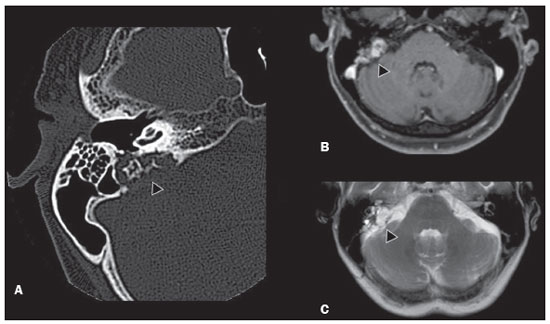 Figura 6. Paciente do sexo feminino, 70 anos, com doença de VHL e tumor do saco endolinfático. A imagem axial de TC na janela óssea (A) mostra lesão lítica (cabeça de seta) na região petrosa da mastoide direita, com comprometimento do conduto auditivo interno e da cápsula ótica adjacente. Sequência de RM T1 pós- contraste (B) revela lesão expansiva centrada na parede posterior da pirâmide petrosa direita, caracterizada por realce heterogêneo (cabeça de seta). Na sequência axial T2 (C) a lesão é heterogeneamente hiperintensa (cabeça de seta). PROTOCOLOS DE RASTREAMENTO Todos os pacientes com doença de VHL têm predisposição ao desenvolvimento de lesões benignas e malignas. Mesmo assintomáticos, devem ser submetidos a exames de rastreamento para detectar novas lesões e monitorar a progressão de lesões conhecidas. O rastreamento foca nos hemangioblastomas (incluindo retinianos), tumores do saco endolinfático, feocromocitomas, carcinomas renais de células claras, cistoadenomas pancreáticos e lesões do epidídimo e do ligamento largo do útero, podendo ser adaptados às necessidades individuais do paciente. As recomendações atuais do VHL Alliance Consensus estão resumidas na Tabela 1(9). REFERÊNCIAS 1. Ganeshan D, Menias CO, Pickhardt PJ, et al. Tumors in von Hippel-Lindau syndrome: from head to toe—comprehensive state-of-the-art review. Radiographics. 2018;38:849–66. 2. Schwingel R, Duarte SBL, Oshima MM, et al. Multiple hemangioblastomas, association with von Hippel-Lindau syndrome [Which is your diagnosis?]. Radiol Bras. 2015;48(2):xi-xii. 3. Kim JJ, Rini BI, Hansel DE. Von Hippel-Llindau syndrome. In: Ahmad S, editor. Diseases of DNA repair. Advances in experimental medicine and biology. New York, NY: Springer; 2010. p. 228–49. 4. Gläsker S, Vergauwen E, Koch CA, et al. Von Hippel-Lindau disease: current challenges and future prospects. Onco Targets Ther. 2020;13 5669–90. 5. Leung RS, Biswas SV, Duncan M, et al. Imaging features of von Hippel-Lindau disease. Radiographics. 2008;28:65–79. 6. Dornbos D 3rd, Kim HJ, Butman JA, et al. Review of the neurological implications of von Hippel-Lindau disease. JAMA Neurol. 2018;75:620–7. 7. Cuccurullo L, Prudente ME, Maffia S, et al. An ultrastructural study of the histogenesis of haemangioblastoma. Pathologica. 2009;101:1–5. 8. Vortmeyer AO, Falke EA, Gläsker S, et al. Nervous system involvement in von Hippel-Lindau disease: pathology and mechanisms. Acta Neuropathol. 2013;125:333–50. 9. VHL Alliance. The VHL handbook – What you need to know about VHL. 6th ed. International edition. Boston, MA: VHL Alliance; 2020. 1. Departamento de Radiologia, Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil 2. Departamento de Radiologia e Diagnóstico por Imagem, Hospital de Clínicas de Porto Alegre (HCPA), Porto Alegre, RS, Brasil 3. Departamento de Radiologia, Hôpitaux Universitaires de Genève, Genebra, Suíça a. https://orcid.org/0000-0002-6427-1200 b. https://orcid.org/0000-0003-2661-4791 c. https://orcid.org/0000-0003-4973-2889 d. https://orcid.org/0000-0001-9360-0547 e. https://orcid.org/0000-0001-8138-1316 f. https://orcid.org/0000-0003-2256-4379 Correspondência: Dr. Fabiano Reis. Universidade Estadual de Campinas – Radiologia e Diagnóstico por Imagem Rua Vital Brasil, 251, Cidade Universitária Campinas, SP, Brasil, 13083-872 E-mail: fabianoreis2@gmail.com Recebido para publicação em 9/5/2021 Aceito, após revisão, em 4/8/2021 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554