Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 55 nº 3 - Maio / Jun. of 2022
Vol. 55 nº 3 - Maio / Jun. of 2022
|
ENSAIO PICTÓRICO
|
|
|
|
|
Autho(rs): Natália Henz Concatto1,a; Stephanie Sander Westphalen1,b; Rubia Vanceta1,c; Alice Schuch1,d; Gustavo Felipe Luersen2,e; Caroline Lorenzoni Almeida Ghezzi1,f |
|
|
Descritores: Placenta acreta; Doenças placentárias; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
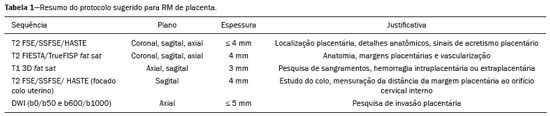
Acretismo placentário é caracterizado pela implantação anormal da placenta, quando as vilosidades coriônicas invadem o miométrio mediante um defeito da decídua basal(1). Pode ser dividido, de acordo com o seu grau de invasão, em placenta acreta (aderência ao miométrio), placenta increta (penetração do miométrio) e placenta percreta (invasão da serosa do útero ou de tecidos e órgãos adjacentes)(2–4). A incidência de acretismo placentário aumentou significativamente nas últimas décadas, principalmente em consequência do aumento de cesarianas(4,5). História de cirurgia prévia, principalmente de cesariana, e placenta prévia são os seus principais fatores de risco(1). Outros fatores de risco incluem técnicas de reprodução assistida, idade avançada, multiparidade, endometrite pós-parto e histeroscopia(4,6,7). Acretismo placentário está associado a um aumento significativo da morbimortalidade materna(8,9), e sua identificação pré-natal precisa permite aplicar o tratamento ideal, sendo os exames de escolha para seu diagnóstico a ultrassonografia (US) e a ressonância magnética (RM). A RM é um método complementar indicado principalmente quando a US é duvidosa, para pacientes com fatores de risco ou em placenta com localização posterior, sendo o período ideal para avaliação por este método entre 28 e 32 semanas(1,10–12). PROTOCOLO DE RM DE PLACENTA Os exames de RM devem ser realizados em equipamentos de 1,5 a 3,0 T, estando a paciente em posição supina e bexiga em moderada repleção, otimizando a visualização, especialmente em casos de suspeita de placenta percreta(13). As sequências básicas de RM que fornecem imagens rápidas são as gradiente-eco e spin-eco, como SSFSE, TrueFISP e FIESTA, que reduzem os artefatos de movimento materno e fetal. A contenção da respiração deve ser realizada quando possível(9,11). A difusão (DWI) é uma técnica relativamente nova para avaliar acretismo placentário, usada como ferramenta adicional para avaliação da invasão placentária, podendo ser útil para definir a interface entre a placenta e o miométrio(14). O tempo total de varredura do exame varia de 25 a 35 minutos e um radiologista deve estar presente durante o exame para orientar o técnico se um plano adicional perpendicular à interface placentária-miometrial ou à interface da bexiga-miométrio for necessário para esclarecer melhor o local do acretismo placentário(9,13). A utilização de gadolínio deve ser evitada, pois foi associada a risco aumentado de doenças reumatológicas, inflamatórias e condições infiltrativas cutâneas em crianças com histórico de exposição intrauterina ao contraste, além de aumento da incidência de natimortos e de óbito neonatal(13). No entanto, alguns autores sugerem que, dada a morbimortalidade significativa da doença, o uso de contraste gadolínio está indicado, afirmando que o gadolínio adiciona especificidade ao diagnóstico, pois a margem entre a placenta e o miométrio é mais claramente delineada nas imagens pós-contraste(3). A Tabela 1 resume o protocolo sugerido. ACHADOS NORMAIS DE RM DO ÚTERO GRAVÍDICO Placenta – Espessura uniforme, medindo 2–4 cm na porção média e diminuindo gradualmente na periferia. Com 24 a 30 semanas, a placenta normal exibe sinal intermediário homogêneo em T2 e é distinta do miométrio, que é mais heterogêneo e hiperintenso. Após a 30ª semana, a placenta se torna mais heterogênea, limitando o desempenho diagnóstico da RM para acretismo placentário(1). Alguns poucos flow voids de menos de 5 mm podem ser vistos nas regiões intraplacentária e subplacentárias(9). Miométrio – Abaixo de 30 semanas, o miométrio tem aparência trilaminar: a camada interna, que compreende a decídua basal e o miométrio interno, forma a interface uteroplacentária, enquanto a camada externa representa a serosa uterina. As camadas interna e externa possuem baixo sinal em T2, enquanto a camada intermediária, mais espessa, apresenta alto sinal em relação à placenta. À medida que o miométrio afina com a progressão da gestação (após 30 semanas), as camadas se tornam menos distintas e são visualizadas como uma banda contínua de baixo sinal em T2 ao redor da placenta(1,9). Interface placentária-miometrial – A placenta geralmente é claramente distinta do miométrio subjacente por uma interface placentária-miometrial de baixo sinal em T2 (linha ou banda retroplacentária) (Figura 1)(9). 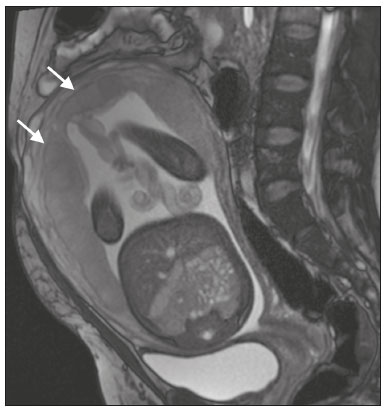 Figura 1. T2 Sagital HASTE. Paciente de 30 anos com placenta normal apresentando útero com formato de pera invertida e demonstrando a interface placentária-miometrial preservada (setas). Contorno uterino – Liso, com fundo e corpo mais largos do que o segmento inferior (Figura 1)(9). ACHADOS DE ACRETISMO PLACENTÁRIO NA RM Várias características da RM de acretismo placentário com sensibilidades e especificidades diferentes são descritas na literatura. Durante a interpretação da imagem, esses achados não são avaliados isoladamente; usar mais de um critério aumenta a confiabilidade do diagnóstico(6,9). Bandas hipointensas intraplacentárias – Áreas de baixo sinal em T2 que se estendem na interface placenta-miométrio (Figura 2). Essas bandas são mais espessas que os septos finos placentários normais e mostram distribuição randômica(1,6,9). 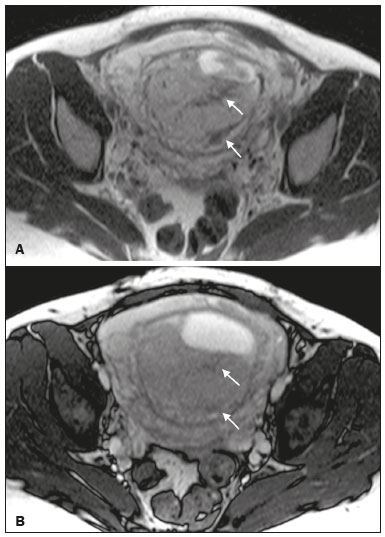 Figura 2. T2 axial HASTE (A) e B-T2 axial TrueFISP (B). Paciente de 30 anos com placenta prévia total apresentando bandas de hipossinal em T2 (setas) intraplacentárias sugestivas de acretismo placentário. Placenta heterogênea – Causada pela interação entre hemorragia, bandas hipointensas intraplacentárias e flow voids profundos (Figura 3). A placenta homogênea pode excluir a placentação anormal com altos níveis de confiança. Um grau leve a moderado de intensidade de sinal heterogênea é considerado um sinal menos útil de acretismo placentário, podendo ser visto normalmente no terceiro trimestre da gravidez. Esse sinal é relativamente inespecífico, em razão da sua subjetividade na avaliação(1,6,9). 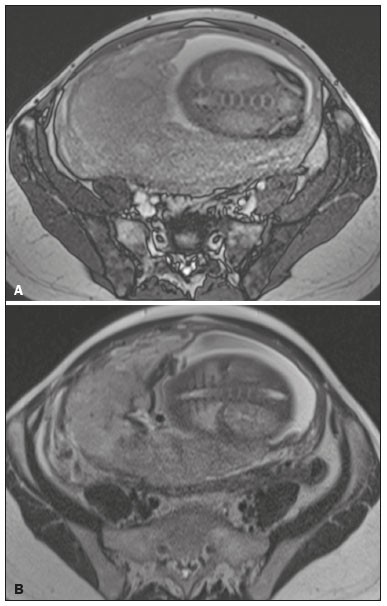 Figura 3. T2 axial TrueFISP (A) e B-T2 axial HASTE (B). Paciente de 36 anos com acretismo placentário apresentando placenta difusamente heterogênea. Protuberância uterina anormal – É considerada por alguns autores o sinal mais útil isoladamente(15). Existem duas formas de protuberância placentária: a difusa, que resulta na perda da forma típica de pera invertida, desenvolvendo uma configuração de ampulheta (pode ser observada em gestações normais), e a protuberância focal no miométrio, que foi relatada como mais útil para o diagnóstico de acretismo placentário (Figura 4). A presença de uma protuberância placentária está associada a invasões miometriais mais profundas(9,15). 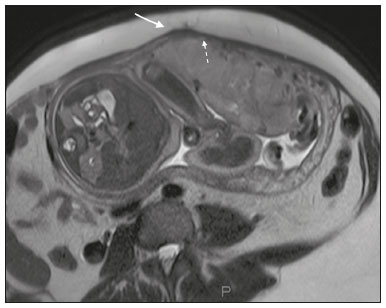 Figura 4. T2 axial HASTE. Paciente de 36 anos apresentando protuberância uterina anormal, com abaulamento do contorno uterino externo anteriormente (seta contínua) associado a afilamento miometrial (seta tracejada). Foi confirmada placenta percreta. Contorno irregular e borda arredondada – O contorno irregular e a borda arredondada são características de imagem que podem ser identificadas no acretismo placentário (Figura 5). Estes achados são frequentemente observados com uma protuberância placentária(1,6,9). 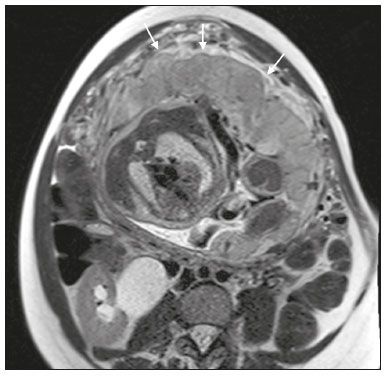 Figura 5. T2 coronal HASTE. Paciente de 35 anos com placenta de contorno lobulado (setas). Vascularização intraplacentária e subplacentária anormal ou desorganizada – Flow voids tortuosos dilatados (> 6 mm) em T2 HASTE que apresentam alto sinal na sequência TrueFISP, consistente com vascularização anormal (Figura 6), frequentemente próximos a bandas intraplacentárias de baixo sinal em T2 e que podem, ocasionalmente, se estender além da placenta. A vascularização subplacentária pode cruzar a serosa uterina e se associar a extensa neovascularização ao redor do útero, colo do útero, vagina e bexiga (Figuras 7 e 8)(9). 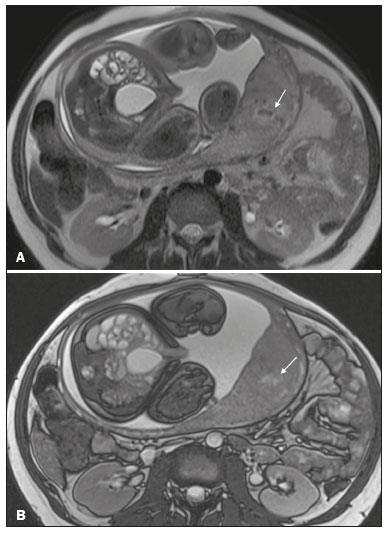 Figura 6. T 2 a xial H ASTE (A) e T2 axial TrueFISP (B). Paciente de 33 anos apresentando vasos intraplacentários proeminentes (setas) sugestivos de acretismo placentário. 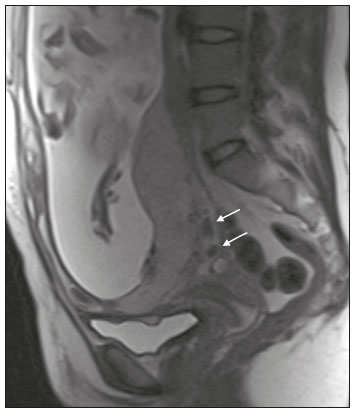 Figura 7. T2 Sagital HASTE. Paciente de 30 anos com placenta prévia total apresentando vasos retroplacentários proeminentes (setas) ao nível da região ístmica e corporal posterior do útero, sugestivos de acretismo placentário. 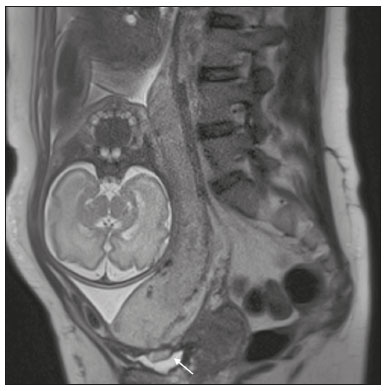 Figura 8. T2 Sagital HASTE. Paciente de 30 anos com placenta prévia total e sinais sugestivos de acretismo placentário apresentando vasos subplacentários proeminentes, especialmente na interface miométrio-vesical (seta). Afilamento ou perda da zona de baixo sinal em T2 retroplacentária – A interface placentária-miometrial é interrompida nos casos de acretismo placentário (Figura 9). 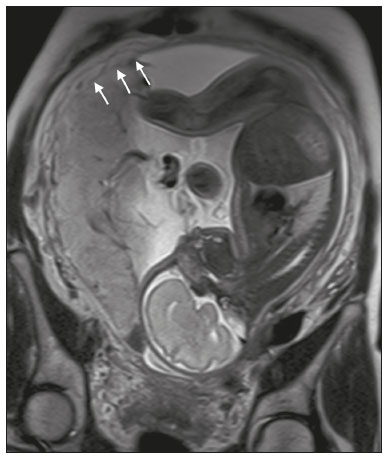 Figura 9. T2 coronal HASTE. Paciente de 39 anos apresentando áreas de perda do halo de baixo sinal em T2 retroplacentário (setas), associado a afilamento miometrial. Afilamento miometrial – É o primeiro sinal da RM a sugerir acretismo placentário. O miométrio pode parecer fino (até menos de 1 mm) na área de inserção da placenta e se torna imperceptível no acretismo placentário (Figura 9). Este sinal possui baixa sensibilidade e especificidade para acretismo placentário, devido ao afilamento fisiológico do miométrio conforme a gravidez progride, principalmente no local de uma cicatriz anterior de cesariana(9). Ruptura focal do miométrio – É identificada no local da invasão placentária (Figura 10) e é uma característica de imagem que pode ser observada apenas quando o miométrio está bem representado(9). Alamo et al.(16) sugeriram que este sinal é o segundo critério mais comum nos casos de invasão placentária, com sensibilidade de 91%(16). 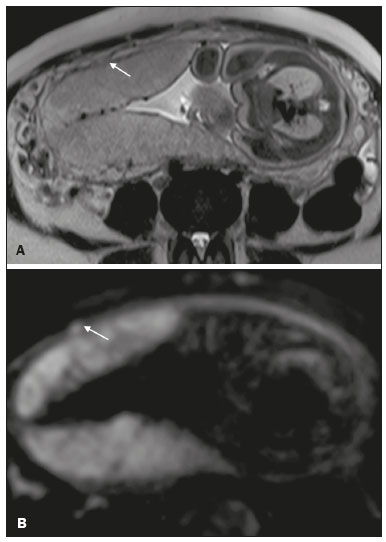 Figura 10. T2 axial HASTE (A) e T2 axial DWI (B). Paciente de 39 anos com ruptura focal do miométrio (setas). ACHADOS DE RM DE EXTENSÃO EXTRAUTERINA (PLACENTA PERCRETA) Em geral, não é necessário distinguir a placenta acreta da increta, por terem tratamentos semelhantes. Todavia, na placenta percreta, a invasão em órgãos adjacentes afeta o manejo cirúrgico e deve-se tentar identificar, pela RM, as estruturas envolvidas (Figura 11). Protuberância uterina com contorno placentário irregular é mais evidente na placenta percreta quando comparada com placenta acreta ou placenta increta(1). 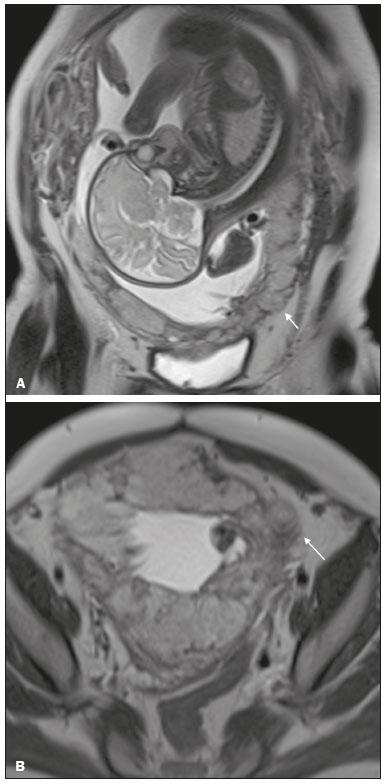 Figura 11. T2 coronal HASTE (A) e T2 axial HASTE (B). Paciente de 35 anos apresentando lobulação do contorno externo do útero na parede anterolateral esquerda da porção inferior, com sinais de extensão extrauterina (setas) nesta localização sugerindo placenta percreta. O diagnóstico definitivo de placenta percreta pela RM, no entanto, requer achados adicionais, como perda total da espessura miometrial, obliteração do plano adiposo entre o tecido placentário e órgãos adjacentes, e interrupção da linha hipointensa em T2 da bexiga, parede intestinal ou músculos da parede abdominopélvica(1). Critérios adicionais para extensão vesical incluem inclinação da cúpula da bexiga e vascularização caótica na sua interface com o útero(9). No caso de invasão placentária de órgãos adjacentes, a RM é preferível à US, oferecendo um campo de visão mais amplo, o que melhora o planejamento cirúrgico(9). A Tabela 2 resume os achados da RM em cada grau de invasão.  ARMADILHAS DIAGNÓSTICAS Vascularização placentária – Alguns flow voids normais (< 6 mm) podem ser identificados nas regiões subplacentária e intraplacentária, geralmente no ponto de inserção do cordão umbilical (Figura 12)(1,9). 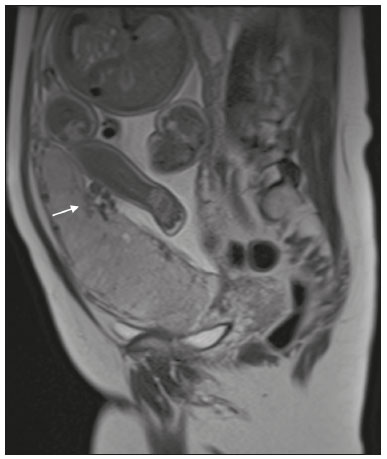 Figura 12. T2 axial HASTE. Paciente de 39 anos sem sinais de acretismo placentário apresentando flow voids normais intraplacentários próximos à inserção do cordão umbilical (seta). Bandas de hipossinal intraplacentárias – Podem ser observadas na placenta normal acima de 30 semanas de gestação, usualmente na superfície fetal da placenta, enquanto bandas anormais geralmente ocorrem na superfície materna da placenta(1,9). Também podem ser vistas em gestantes com infarto placentário e trombo interviloso(9). Varizes da bexiga – Podem mimetizar o abaulamento focal do contorno uterino. A DWI é útil, mostrando baixo sinal nas varizes da bexiga, enquanto a protuberância placentária mostra alto sinal na DWI(1,9). Protuberância focal no umbigo materno – No final do terceiro trimestre da gestação, a bainha dos músculos retoabdominais pode se separar e causar protuberância focal da face anterior do miométrio (Figura 13)(9). 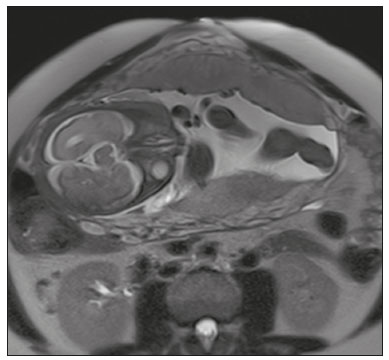 Figura 13. T2 axial HASTE. Paciente de 38 anos sem sinais de acretismo placentário, com protuberância uterina no umbigo devida a diástase abdominal. Perda da zona de hipossinal em T2 retroplacentária – Frequentemente ausente na gravidez normal de curto prazo(1,9). CONCLUSÃO O espectro do acretismo placentário tornou-se mais frequente e a RM desempenha papel importante no diagnóstico pré-natal e no planejamento terapêutico, que deve ser realizado por equipe multidisciplinar experiente, minimizando a morbimortalidade materna. REFERÊNCIAS 1. Kilcoyne A, Shenoy-Bhangle AS, Roberts DJ, et al. MRI of placenta accreta, placenta increta, and placenta percreta: pearls and pitfalls. AJR Am J Roentgenol. 2017;208:214–21. 2. Wortman AC, Alexander JM. Placenta accreta, increta, and percreta. Obstet Gynecol Clin North Am. 2013;40:137–54. 3. Elsayes KM, Trout AT, Friedkin AM, et al. Imaging of the placenta: a multimodality pictorial review. Radiographics. 2009;29:1371–91. 4. Jauniaux E, Chantraine F, Silver RM, et al. FIGO consensus guidelines on placenta accreta spectrum disorders: epidemiology. Int J Gynaecol Obstet. 2018;140:265–73. 5. Publications Committee, Society for Maternal-Fetal Medicine, Belfort MA. Placenta accreta. Am J Obstet Gynecol. 2010;203:430–9. 6. Fadl S, Moshiri M, Fligner CL, et al. Placental imaging: normal appearance with review of pathologic findings. Radiographics. 2017; 37:979–98. 7. Santana DSN, Maia Filho NL, Mathias L. Conceito, diagnóstico e tratamento de placenta prévia acreta com invasão de bexiga: revisão sistemática da literatura. Femina. 2010;38:147–53. 8. Silver RM, Barbour KD. Placenta accreta spectrum: accreta, increta, and percreta. Obstet Gynecol Clin North Am. 2015;42:381–402. 9. Srisajjakul S, Prapaisilp P, Bangchokdee S. Magnetic resonance imaging of placenta accreta spectrum: a step-by-step approach. Korean J Radiol. 2021;22:198–212. 10. Rahaim NSA, Whitby EH. The MRI features of placental adhesion disorder and their diagnostic significance: systematic review. Clin Radiol. 2015;70:917–25. 11. Jha P, Pōder L, Bourgioti C, et al. Society of Abdominal Radiology (SAR) and European Society of Urogenital Radiology (ESUR) joint consensus statement for MR imaging of placenta accreta spectrum disorders. Eur Radiol. 2020;30:2604–15. 12. Agostini TCF, Figueiredo R, Warmbrand G, et al. Placental adhesion disorder: magnetic resonance imaging features and a proposal for a structured report. Radiol Bras. 2020;53:329–36. 13. Novis MI, Moura APC, Watanabe APF, et al. Placental magnetic resonance imaging: normal appearance, anatomical variations, and pathological findings. Radiol Bras. 2021;54:123–9. 14. Morita S, Ueno E, Fujimura M, et al. Feasibility of diffusion-weighted MRI for defining placental invasion. J Magn Reson Imaging. 2009;30:666–71. 15. Leyendecker JR, DuBose M, Hosseinzadeh K, et al. MRI of pregnancy-related issues: abnormal placentation. AJR Am J Roentgenol. 2012;198:311–20. 16. Alamo L, Anaye A, Rey J, et al. Detection of suspected placental invasion by MRI: do the results depend on observer’ experience? Eur J Radiol. 2013;82:e51–7. 1. Hospital Moinhos de Vento, Porto Alegre, RS, Brasil 2. Hospital Cruz Vermelha, Lisboa, Portugal a. https://orcid.org/0000-0002-7236-3631 b. https://orcid.org/0000-0001-9941-7065 c. https://orcid.org/0000-0002-1299-6381 d. https://orcid.org/0000-0001-8145-9478 e. https://orcid.org/0000-0003-3186-7646 f. https://orcid.org/0000-0001-6275-6119 Correspondência: Dra. Natalia Henz Concatto Rua Quintino Bocaiuva, 159/1702, Rio Branco Porto Alegre, RS, Brasil, 90440-051 E-mail: naticoncatto@hotmail.com Recebido para publicação em 6/7/2021 Aceito, após revisão, em 1/8/2021 Data de publicação: 11/01/2022 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554