Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 55 nº 2 - Mar. / Abr. of 2022
Vol. 55 nº 2 - Mar. / Abr. of 2022
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Luiz Otávio de Andrade Damázio1,2,a; Esdras Marques Lins1,2,3,b; Álvaro Antônio Bandeira Ferraz3,c; Camila de Moraes Bezerra2,d; Fernando Antônio Carneiro Borba Carvalho Neto2,e; Lívia Lócio Rosado de Oliveira2,f; Miguel Calado Soares da Costa2,g; Paula Marina Carneiro Santos2,h |
|
|
Descritores: Pneumonia; Kidney transplantation; Computed tomography. |
|
|
Resumo: INTRODUÇÃO
A infecção é importante causa de mortalidade e perda da função do enxerto em receptores de transplante renal, especialmente durante o primeiro ano pós-cirúrgico, quando a imunossupressão é maior(1). Dentre as causas de infecção, a pneumonia é uma das principais, sendo a gravidade da infecção pulmonar influenciada pelo balanço de forças entre a virulência do agente causal e as defesas do hospedeiro(2,3). Os exames de diagnóstico por imagem têm papel crucial na detecção da pneumonia, sendo a tomografia computadorizada (TC) exame-chave, por sua alta resolução espacial e temporal, especialmente dos aparelhos mais modernos com múltiplas fileiras de detectores(4). Os patógenos relacionados a infiltrado pulmonar de característica infecciosa podem ser categorizados como de natureza viral, bacteriana, micobacteriana e fúngica(5), com a probabilidade de diagnóstico de determinado agente causal sendo em parte definida no período pós-transplante(6), bem como pelas condições socioeconômicas e geográficas dos pacientes(7). Os achados da TC podem direcionar a terapia antimicrobiana para os agentes mais prováveis de pneumonia na população de transplantados renais enquanto as culturas ainda estão em andamento. O objetivo desta pesquisa foi avaliar os padrões tomográficos relacionados aos agentes etiológicos da pneumonia em pacientes durante o primeiro ano após o transplante renal. MATERIAIS E MÉTODOS Este é um estudo retrospectivo, transversal e descritivo, baseado na análise de dados de pacientes adultos submetidos a transplante renal no Instituto de Medicina Integral Professor Fernando Figueira (IMIP), Recife, PE, entre janeiro de 2013 e junho de 2018. O estudo teve aprovação do Comitê de Ética em Pesquisa do IMIP (CAAE: 03221718.3.0000.5201). Foram excluídos do estudo pacientes que realizaram transplante concomitante de mais de um órgão, pacientes que perderam seguimento ou que vieram a falecer de causa que não a pneumonia durante o primeiro ano do transplante renal, e pacientes com prontuários incompletos. Os exames de tomografia foram realizados em dois aparelhos disponíveis no serviço, um Philips Brilliance com 64 canais de detectores (Philips Medical Systems, Haifa, Israel) e o outro um Siemens Somatom Emotion com 6 canais de detectores (Siemens Healthcare, Forchhein, Alemanha). Em ambos os tomógrafos foi utilizada a técnica de alta resolução para estudo do parênquima pulmonar, com cortes desde os ápices até as bases pulmonares. Foram feitos cortes axiais finos de 1,0 a 2,0 mm de espessura, com o paciente em decúbito dorsal, em inspiração, utilizando-se filtro de alta resolução espacial para reconstrução das imagens. Tanto as imagens como os laudos radiológicos estão armazenados no sistema digital do hospital, sendo acessados pelos pesquisadores na obtenção dos dados do estudo. Os padrões tomográficos predominantes foram classificados em quatro grupos: padrão de consolidação, padrão de broncopneumonia, padrão de pneumonia intersticial e padrão de nódulos e massas, sendo os critérios de definição desses achados os relatados no glossário de termos elaborado pelo Colégio Brasileiro de Radiologia e Diagnóstico por Imagem e Sociedade Brasileira de Pneumologia e Tisiologia(8). Em casos nos quais havia mais de um padrão tomográfico, determinou-se o padrão predominante como o que acometia maior extensão do parênquima pulmonar. No padrão de nódulos e massas, os achados foram categorizados como massas quando maiores que 3,0 cm, grandes nódulos quando entre 1,0 e 3,0 cm, pequenos nódulos quando mediam entre 0,3 e 1,0 cm, e padrão de disseminação miliar quando menores que 0,3 cm. As amostras para análise microbiológica foram obtidas mediante coleta sanguínea, coleta de escarro, lavado broncoalveolar, biópsia transbrônquica e pulmonar, com a finalidade de diagnosticar o agente causal, sendo os micro-organismos categorizados em cinco grupos: bactérias piogênicas, vírus, fungos, micobactérias e pneumonia polimicrobiana. Além da classe do agente causal, também foi anotada a espécie isolada. Hemoculturas foram realizadas por meio de coleta com três amostras e analisadas em sistema automatizado por concentração inibitória mínima ou manual. Amostras de sangue periférico foram enviadas para contagem de carga viral para citomegalovírus. Amostras de escarro espontâneo ou induzido foram colhidas antes do início da terapia específica e enviadas para coloração Gram e Ziehl-Neelsen. Tais amostras, se adequadas, foram enviadas para cultura de bactérias, Mycobacterium tuberculosis e fungos. O material obtido do lavado broncoalveolar foi enviado para análise de lâmina direta, celularidade, cultura de Nocardia sp., reação em cadeia de polimerase para detecção de M. tuberculosis e cultura de fungos. Os produtos de biópsia transbrônquica e biópsia pulmonar sob visualização direta foram processados por meio de técnicas de rotina e encaminhados ao laboratório de anatomia patológica. Na análise estatística utilizou-se o programa Stata 11 (StataCorp, College Station, TX, USA). Para aferir se houve associação entre agente etiológico e padrão tomográfico, foi utilizado o teste exato de Fisher. O limiar de significância adotado foi p < 0,001. RESULTADOS Foram analisados dados de prontuários de 965 pacientes que foram submetidos a transplante de rim no IMIP entre janeiro de 2013 e junho de 2018. Entre os pacientes incluídos no estudo, foram diagnosticados 101 casos de pneumonia nesse período. Dos 101 pacientes que desenvolveram pneumonia, 60 (59,4%) tiveram o agente microbiológico identificado, sendo encontrados 22 (36,6%) casos de pneumonia por bactérias piogênicas, 8 (13,3%) casos de pneumonia fúngica, 7 (11,6%) casos de pneumonia viral e 13 (21,6%). casos de pneumonia por micobactérias. Em 10 (16,7%) casos, mais de um agente causal foi identificado, os quais foram classificados como pneumonia polimicrobiana (Tabelas 1 e 2). 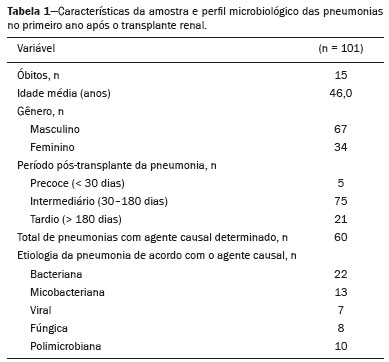  Entre os 60 pacientes que tiveram o agente causal identificado, 25 (41,7%) apresentaram nódulos e massas como padrão tomográfico único ou predominante, 16 (26,7%) apresentaram broncopneumonia, 13 (21,7%) mostraram padrão de consolidação e 6 (10%) apresentaram o padrão intersticial. São mostrados exemplos de casos encontrados dos padrões de consolidação (Figura 1), broncopneumonia (Figura 2), intersticial (Figura 3) e nódulos e massas (Figura 4). A Figura 5 mostra uma TC de pneumonia com padrão de nódulos e massas cuja investigação laboratorial não obteve sucesso no isolamento do agente causal. A distribuição dos casos do padrão de nódulos e massas é apresentada na Tabela 3. 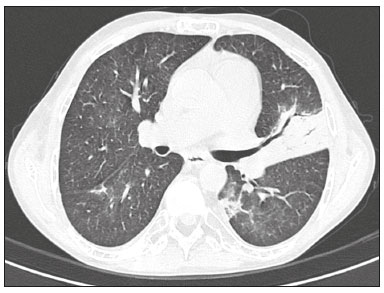 Figura 1. Homem de 34 anos evoluindo com tosse e febre no quinto mês pós-transplante. TC mostra consolidação parenquimatosa na língula. Notamse ainda discretas áreas em vidro fosco nos lobos inferiores e pequeno foco de consolidação no lobo inferior esquerdo. Hemocultura revelou A. baumannii. 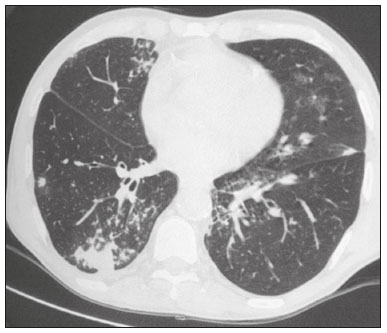 Figura 2. Homem de 60 anos no 10° mês pós-transplante com tosse produtiva há 15 dias. Padrão de broncopneumonia com nódulos centrolobulares multifocais chegando a coalescer, formando pequenos focos de consolidação, o maior no lobo inferior direito. Há ainda espessamento de paredes brônquicas e alguns poucos nódulos do espaço aéreo esparsos. Lavado broncoalveolar revelou M. tuberculosis. 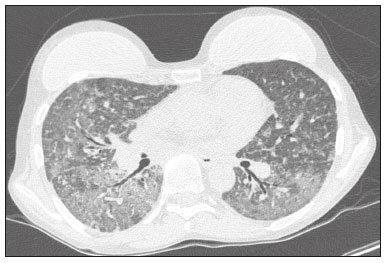 Figura 3. Mulher de 40 anos com febre, dispneia e hipoxemia no segundo mês pós-transplante. TC demonstra padrão intersticial com áreas difusas em vidro fosco. Antigenemia positiva para citomegalovírus. 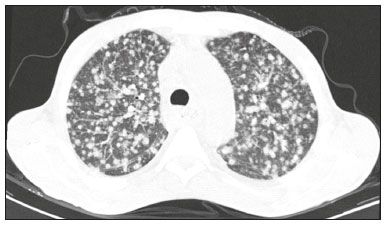 Figura 4. Homem de 34 anos no quarto mês pós-transplante com candidíase disseminada. TC mostra múltiplos nódulos pulmonares. 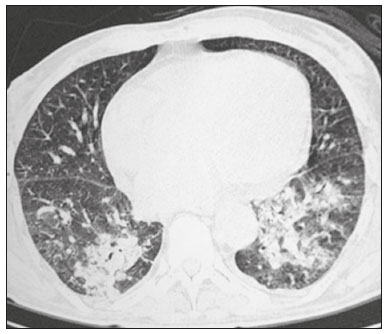 Figura 5. Homem de 70 anos no segundo mês pós-transplante com febre, dispneia e tosse produtiva há sete dias. TC mostra consolidações do espaço aéreo em ambos os lobos inferiores. A investigação laboratorial do agente etiológico foi inconclusiva.  O teste exato de Fisher foi utilizado para avaliar associação entre classe de agentes etiológicos e padrões tomográficos (Tabela 4). DISCUSSÃO A avaliação das infecções pulmonares por métodos de imagem, particularmente por TC, tem sido motivo de várias publicações recentes na literatura radiológica nacional(9–13). Segundo dados de literatura, o padrão de consolidação frequentemente associa-se às pneumonias causadas por bactérias piogênicas(7). Reittner et al., em um estudo com 114 casos de pneumonias bacterianas, sendo 35 imunodeprimidos, encontrou a consolidação como a alteração mais comum, ocorrendo em 85%(14). Coelho et al., em um estudo com transplantados de medula óssea com pneumonia bacteriana, reportaram que a consolidação ocorreu em 60% dos casos(15). No presente estudo, de aspecto similar ao da literatura, em cerca de 60% dos casos as bactérias piogênicas foram as responsáveis pela pneumonia com este padrão. No padrão radiológico de broncopneumonia destacam-se, como causadoras, as bactérias atípicas, bem como é o padrão mais prevalente na pneumonia de origem hospitalar(14). Na TC, a presença de nódulos centrolobulares sinaliza inflamação bronquiolar, sendo este o principal achado neste padrão de infecção pulmonar. Na presente pesquisa, as bactérias piogênicas foram as principais causadoras da broncopneumonia, sendo responsáveis por metade dos casos com agente etiológico determinado, apesar de não ter havido significância estatística entre classe de agentes etiológicos e broncopneumonia. O padrão de pneumonia intersticial resulta de inflamação e edema que ocorrem predominantemente no interstício pulmonar, decorrentes da agressão provocada por um agente infeccioso, geralmente um vírus, sendo o citomegalovírus o micro-organismo mais prevalente após o transplante renal(16). No presente estudo, foram identificados seis casos de pacientes com padrão intersticial com micro-organismo identificado, todos eles decorrentes de citomegalovírus. Recentemente, o SARS-CoV-2, um coronavírus identificado inicialmente na cidade de Wuhan, China, em dezembro de 2019, tem causado pneumonia com padrão intersticial também em transplantados, porém, ainda há poucos estudos de pneumonia por este agente etiológico nesta população(17). Nódulos pulmonares são achados frequentes nas infecções pulmonares em imunossuprimidos. Copp et al.(18) relataram, em seu estudo, que nódulos de natureza infecciosa foram encontrados em 56% dos pacientes submetidos a diversos tipos de transplante de órgão sólido e que desenvolveram pneumonia. Gandhi et al.(19), em estudo apenas com transplantados renais, reportaram 25% dos casos cursando com padrão nodular, exceto nódulos de padrão centrolobular, além de 6% de casos com nódulos miliares, sendo assinalado leve predomínio de doenças fúngicas. Na nossa série, o padrão nodular foi o mais encontrado, com cerca de 40% dos casos deste padrão com agente etiológico determinado. A maioria foi de doenças fúngicas, com 32% dos casos. Possivelmente, o predomínio do padrão de nódulos e massas na presente pesquisa ocorreu em razão de uma maior investigação do agente causal nesse grupo por meio de testes diagnósticos específicos, considerando que apenas os pacientes com agente etiológico definido foram avaliados. É provável que, se acrescentados todos os pacientes, incluindo os com pneumonia por micro-organismo indefinido, houvesse predominância do padrão de consolidação. Neste grupo, muitos pacientes não foram submetidos a investigação etiológica porque responderam a terapia empírica. Na abordagem tomográfica do padrão nodular, Franquet et al.(20) reportaram que de 78 pacientes imunossuprimidos com nódulos de natureza infecciosa, foi encontrado pelo menos um nódulo maior que 1,0 cm em 64 deles, e que no caso de doenças fúngicas, em 86% foram encontrados massas ou nódulos maiores que 1,0 cm. Segundo Torres et al., nódulos são frequentemente encontrados nas micoses pulmonares, sendo estas infecções graves no imunocomprometido, nas quais o acometimento pulmonar se mantém como a forma documentada mais comum de infecção invasiva tecidual(21). Na presente pesquisa, o teste de Fisher revelou associações estatísticas esperadas levando-se em conta a literatura, ou seja, de consolidação com bactérias piogênicas, nódulos e massas com fungos, além de padrão intersticial com vírus(22,23). Porém, há poucos dados na literatura com análise multivariada em transplantados renais, como o estudo realizado por Jiang et al.(24), que teve o mesmo objeto do presente estudo, mas considerou uma variação maior de aspectos tomográficos, utilizando subdivisões dos padrões estabelecidos na nossa pesquisa. Provavelmente, foi este o motivo de não encontrarem associação estatisticamente significante entre as variáveis, como no nosso estudo. A presente pesquisa tem como limitações o modelo retrospectivo e a pequena quantidade de casos com agente causal definido. Mesmo assim, estabeleceu a incidência e mortalidade de pneumonia durante o primeiro ano após o transplante renal no maior centro de transplante renal do norte e nordeste do Brasil, além de demonstrar associação estatística entre micro-organismos causadores de pneumonia e padrões tomográficos, contribuindo, dessa maneira, para o planejamento da terapia de futuros pacientes transplantados renais. CONCLUSÃO O padrão tomográfico mais encontrado foi o de nódulos e massas. Houve uma frequência maior que a esperada, com associação estatística de pneumonia bacteriana com o padrão tomográfico de consolidação, bem como igualmente se verificou frequência maior do que a esperada do padrão intersticial com os agentes virais. Houve ainda associação estatística maior que a esperada dos fungos com o padrão tomográfico de nódulos e massas. Os padrões tomográficos encontrados na pneumonia durante o primeiro ano após o transplante renal são potencialmente úteis para o diagnóstico diferencial dos diferentes tipos de agentes etiológicos. Estes achados poderiam ser importantes no início do tratamento precoce desses pacientes. REFERÊNCIAS 1. Gopalakrishnan V, Agarwal SK, Aggarwal S, et al. Infection is the chief cause of mortality and non-death censored graft loss in the first year after renal transplantation in a resource limited population: a single centre study. Nephrology (Carlton). 2019;24:456–63. 2. Dizdar OS, Ersoy A, Akalin H. Pneumonia after kidney transplant: incidence, risk factors, and mortality. Exp Clin Transplant. 2014; 12:205–11. 3. Gunderman RB, Lydon BT. Respiratory disease: an update for radiologists. Acad Radiol. 2016;23:108–11. 4. Seeram E. Computed tomography: a technical review. Radiol Technol. 2018;89:279–302. 5. Trubiano JA, Chen S, Slavin MA. An approach to a pulmonary infiltrate in solid organ transplant recipients. Curr Fungal Infect Rep. 2015;9:144–54. 6. Fishman JA. Infection in organ transplantation. Am J Transplant. 2017;17:856–79. 7. Eyüboglu FÖ, Küpeli E, Bozbas SS, et al. Evaluation of pulmonary infections in solid organ transplant patients: 12 years of experience. Transplant Proc. 2013;45:3458–61. 8. Silva CIS, Marchiori E, Souza Júnior AS, et al. Consenso brasileiro ilustrado sobre a terminologia dos descritores e padrões fundamentais da TC de tórax. J Bras Pneumol. 2010;36:99–123. 9. Barbosa PNVP, Bitencourt AGV, Miranda GD, et al. Chest CT accuracy in the diagnosis of SARS-CoV-2 infection: initial experience in a cancer center. Radiol Bras. 2020;53:211–5. 10. Müller CIS, Müller NL. Chest CT target sign in a couple with COVID-19 pneumonia. Radiol Bras. 2020;53:252–4. 11. Oliveira RR, Rodrigues TP, Savoia P, et al. Lung ultrasound: an additional tool in COVID-19. Radiol Bras. 2020;53:241–5. 12. Francisco Neto MJ, Queiroz MRG. Rational use of chest ultrasound to confront COVID-19. Radiol Bras. 2020;53(5):ix–x. 13. Farias LPG, Strabelli DG, Fonseca EKUN, et al. Thoracic tomographic manifestations in symptomatic respiratory patients with COVID-19. Radiol Bras. 2020;53:255–61. 14. Reittner P, Ward S, Heyneman L, et al. Pneumonia: high-resolution CT findings in 114 patients. Eur Radiol. 2003;13:515–21. 15. Coelho LOM, Gasparetto TD, Escuissato DL, et al. Achados de TCAR nas pneumonias bacterianas após transplante de medula óssea. J Bras Pneumol. 2009;35:431–5. 16. De Keyzer K, Van Laecke S, Peeters P, et al. Human cytomegalovirus and kidney transplantation: a clinician’s update. Am J Kidney Dis. 2011;58:118–26. 17. Fung M, Babik JM. COVID-19 in immunocompromised hosts: what we know so far. Clin Infect Dis. 2021;72:340–50. 18. Copp DH, Godwin JD, Kirby KA, et al. Clinical and radiologic factors associated with pulmonary nodule etiology in organ transplant recipients. Am J Transplant. 2006;6:2759–64. 19. Gandhi SP, Kute V, Patel KN, et al. Role of high resolution computed tomography of chest in posttransplant pulmonary infection. Indian J Transplant. 2017;11:49–54. 20. Franquet T, Müller NL, Giménez A, et al. Infectious pulmonary nodules in immunocompromised patients: usefulness of computed tomography in predicting their etiology. J Comput Assist Tomogr. 2003;27:461–8. 21. Torres PPTS, Rabahi MF, Moreira MAC, et al. Tomographic assessment of thoracic fungal diseases: a pattern and signs approach. Radiol Bras. 2018;51:313–20. 22. Franquet T. Imaging of pneumonia: trends and algorithms. Eur Respir J. 2001;18:196–208. 23. Franquet E. Pneumonia. Semin Roentgenol. 2017;52;27–34. 24. Jiang T, Xue F, Zheng X, et al. Clinical data and CT findings of pulmonary infection caused by different pathogens after kidney transplantation. Eur J Radiol. 2012;81:1347–52. 1. Instituto de Medicina Integral Professor Fernando Figueira (IMIP), Recife, PE, Brasil 2. Faculdade Pernambucana de Saúde (FPS), Recife, PE, Brasil 3. Universidade Federal de Pernambuco (UFPE), Recife, PE, Brasil a. https://orcid.org/0000-0002-1563-196X b. https://orcid.org/0000-0001-6603-6944 c. https://orcid.org/0000-0002-3832-3927 d. https://orcid.org/0000-0002-1261-614X e. https://orcid.org/0000-0003-2125-5398 f. https://orcid.org/0000-0002-6673-8687 g. https://orcid.org/0000-0002-7466-2475 h. https://orcid.org/0000-0001-7257-4175 Correspondência: Dr. Luiz Otávio de Andrade Damázio Rua Capitão Rebelinho, 580, ap. 301, Pina Recife, PE, Brasil, 51011-010 E-mail: loadamazio@yahoo.com.br Recebido para publicação em 20/4/2021 Aceito, após revisão, em 18/6/2021 Data de publicação: 14/09/2021 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554