Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 54 nº 6 - Nov. / Dez. of 2021
Vol. 54 nº 6 - Nov. / Dez. of 2021
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Bruna Arrais Dias1,2,a; Karenn Barros Bezerra1,b; Alexandre Sérgio de Araújo Bezerra1,2,3,c; Vanessa Garcia Santana1,d; Raquel Rodrigues Borges1,e; Juliana Cavalcanti de Freitas Reinaux1,f; Daniel Lima Souza1,g; Fernando Bisinoto Maluf1,h |
|
|
Descritores: Isquemia encefálica; Acidente vascular cerebral/etiologia; Infarto encefálico; Angiotomografia por tomografia computadorizada; Artérias cerebrais/diagnóstico por imagem. |
|
|
Resumo: INTRODUÇÃO
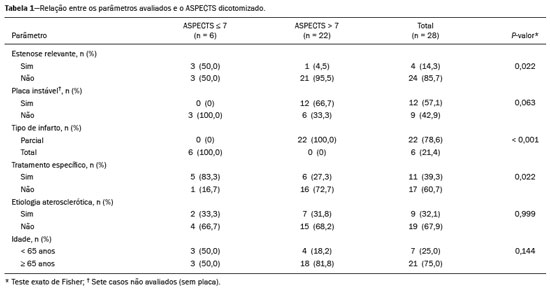
A tomografia computadorizada sem contraste (TCSC) do crânio é o exame inicial de escolha na avaliação de pacientes com acidente vascular encefálico (AVE), utilizada para excluir hemorragia intracraniana e outras doenças que simulem isquemia cerebral, e identificar sinais precoces de isquemia e sua extensão(1,2). A extensão das alterações isquêmicas precoces, avaliada de forma padronizada pela classificação Alberta Stroke Program Early CT Score (ASPECTS), apresenta correlação com o tamanho do infarto nos exames de acompanhamento e prediz o risco de transformação hemorrágica(3,4). Amplamente utilizada na prática clínica, essa classificação orienta a definição do tratamento e avaliação do prognóstico do paciente no contexto do AVE agudo, com escores mais baixos relacionados a desfechos piores(4,5). Inicialmente projetada para selecionar os pacientes que se beneficiariam da trombólise intravenosa, posteriormente a classificação foi estendida para seleção de paciente para trombectomia mecânica(6,7). Inicialmente, estudos demonstraram que o ponto de corte utilizado para indicar o tratamento trombolítico com indícios de melhor prognóstico seria ASPECTS acima de 7(8). Porém, estudos recentes já mostraram benefícios no tratamento de pacientes com escore entre 5 e 7(7,9,10). Pela grande disponibilidade, velocidade de aquisição da imagem e baixo custo da TC(1,5), estudos multicêntricos randomizados concluíram que o acréscimo da angiografia por TC (ATC) ao protocolo dos pacientes com AVE agudo acarreta pequeno aumento do tempo e custo, comparativamente à ressonância magnética(5), sem comprometer significativamente o tempo do início do tratamento(2). A ATC fornece informações adicionais importantes para o diagnóstico e tratamento precoce do paciente com AVE, identificando oclusão de grandes vasos, localização e extensão do coágulo(2), estenose extracraniana e alterações isquêmicas no parênquima encefálico(5). Também auxilia na seleção dos pacientes para trombectomia mecânica, direcionando a intervenção endovascular apenas ao vaso ocluído, evitando a realização da angiografia nos vasos não alvos(11). Outra vantagem bem estabelecida é a possibilidade de avaliar a anatomia do vaso antes do planejamento dos procedimentos endovasculares(12). A avaliação precoce da circulação intracraniana e extracraniana pela ATC auxilia na identificação da causa da isquemia cerebral, possibilitando a instituição precoce do tratamento de reperfusão, auxiliando na redução da morbidade, além de contribuir na definição da terapia de prevenção secundária, reduzindo a chance de recorrência do AVE(13,14). O objetivo do nosso estudo foi avaliar a importância do uso da TC e da ATC no protocolo de AVE, seu papel na identificação precoce de lesões encefálicas isquêmicas agudas/hiperagudas, bem como seu impacto na instituição do tratamento precoce com trombólise intravenosa e trombectomia mecânica, e seu papel na determinação da etiologia do evento isquêmico. MATERIAIS E MÉTODOS Foram incluídos no estudo pacientes com AVE isquêmico agudo/hiperagudo (com até 24 horas do início dos sintomas) da circulação anterior, atendidos no pronto- socorro, que realizaram TCSC e ATC intracraniana e cervical, no período de abril de 2018 a agosto de 2019. Os critérios de exclusão foram presença de hemorragia ou tumor, sintomas há mais de 24 horas, acometimento da circulação posterior, impossibilidade de realizar ATC por alergia ao contraste iodado ou comprometimento da função renal (clearance de creatinina menor que 30 em paciente não dialítico), pacientes com ataque isquêmico transitório (com desaparecimento completo dos sintomas dentro de 24 horas do seu início e ausência de alterações nos exames de imagem) e com hipótese de AVE excluída. Os exames de TCSC e ATC foram realizados em tomógrafo Philips Brilliance de 64 canais (Philips Health Care, Amsterdam, Holanda). Os parâmetros de aquisição das imagens foram 120 kV, 300 mAs e espessura de corte de 5 mm. A ATC foi adquirida do arco aórtico até os vasos intracranianos corticais, com 1,3 a 1,5 mL/kg de contraste iodado não iônico Optiray 350 (Gerbet, Paris, França) e fluxo de 4,5 mL/s via bomba injetora, seguido de bolus de 30 mL de soro fisiológico, com fluxo de 5,5 mL/s. Análise A análise da extensão das alterações isquêmicas precoces foi realizada pela classificação ASPECTS, que divide o território da artéria cerebral média (ACM) em dez regiões anatômicas, sendo três subcorticais (núcleo caudado, núcleo lentiforme e cápsula interna) e sete corticais (M1 a M6 e ínsula)(4,15). O ASPECTS inicial é 10, sendo subtraído um ponto para cada área com alterações isquêmicas precoces, caracterizadas por hipoatenuação com perda da diferenciação corticossubcortical ou edema focal(16). A placa aterosclerótica mais grave situada no mesmo lado da lesão isquêmica foi avaliada quanto ao grau de estenose e tipo de placa. O grau da estenose foi quantificado pelo método North American Symptomatic Carotid Endarterectomy Trial, subdividido em estenose inferior a 50%, estenose entre 50% e 70% e estenose acima de 70%, ou oclusão total, sendo considerada estenose relevante se maior que 50%, de acordo com o critério Trial of ORG 10172 in Acute Stroke Treatment (TOAST)(17). As placas foram também classificadas de acordo com sua atenuação em placa calcificada (maior que 130 UH), placa mista (entre 50 e 130 UH) e placa fibrolipídica (menor que 50 UH). De acordo com a sua superfície, foi classificada em regular ou irregular, com ou sem ulceração. A placa foi ainda classificada como estável (placa calcificada com superfície regular) ou instável (placa mista ou fibrolipídica, que apresentasse superfície irregular e/ou ulceração)(18). De acordo com a classificação TOAST, a etiologia do infarto foi dividida em cinco grupos, a saber: aterosclerose de grandes artérias, cardioembólico, doença de pequenos vasos, outras etiologias e etiologia indeterminada(17). Aterosclerose de grandes artérias foi definida na presença de aterosclerose relevante ou oclusão de artérias intracranianas ou extracranianas do mesmo lado da isquemia cerebral, com área acometida maior que 1,5 cm, sendo excluída causa cardíaca(17,19,20). O AVE foi classificado como causa cardioembólica quando confirmada fonte cardíaca de êmbolo pela existência de fatores de alto risco, como prótese valvar mecânica, fibrilação atrial não isolada, trombo intracavitário, cardiomiopatias dilatadas e endocardite, com ausência de aterosclerose cervical relevante(17). Oclusão de pequenos vasos cerebrais (infarto lacunar) foi considerada quando a área acometida era menor que 1,5 cm, na ausência de aterosclerose cervical relevante em artéria ipsilateral à lacuna ou fonte cardioembólica potencial. A categoria "outras etiologias" engloba causas diferentes das supracitadas, como vasculopatias não ateroscleróticas (moyamoya, dissecção arterial), desordens hematológicas, coagulopatias, vasculites e outras. A etiologia foi definida como indeterminada quando houve duas possíveis causas concorrentes ou não foi identificada causa específica(17,19,20). Os padrões radiológicos topográficos dos infartos cerebrais foram definidos com base na classificação Oxfordshire Community Stroke Project, em infarto da circulação anterior total (ICAT), infarto da circulação anterior parcial (ICAP), infarto lacunar, infarto no centro semioval e infarto de fronteira, destacando-se que a circulação posterior não foi incluída no estudo(21). O ICAT engloba as lesões com qualquer uma das seguintes características: infarto em todo o território da artéria carótida interna (ACI), envolvendo mais de um terço do território da ACM ou infarto cortical no território da artéria cerebral anterior (ACA) ou da ACM, associado a infarto ipsilateral dos núcleos da base no território da ACM. O ICAP envolve os infartos nos territórios da ACM e da ACA que não se enquadram nos critérios do ICAT e nem do lacunar. O infarto lacunar compreende infartos na substância branca profunda, núcleos da base ou tronco cerebral, com diâmetro máximo de 1,5 cm(21). Os infartos de fronteira ocorrem na transição entre dois ou três territórios arteriais(21). Análise estatística Os dados foram analisados com auxílio do programa R, versão 3.1.2 (The R Foundation for Statistical Computing, Viena, Áustria) pela frequência absoluta (n) e relativa (%) para variáveis qualitativas, e por estatística resumo para variáveis quantitativas. Foram avaliados os parâmetros relacionados a estenose, placa, tipo do infarto, tratamento, etiologia, idade e ASPECTS. Para efeito de análise estatística, pelo fato de a amostra ser pequena (28 pacientes), optou-se por dicotomizar em "total" ou "parcial" o tipo do infarto e, em "sim" ou "não", os seguintes parâmetros: estenose relevante, placa instável, tratamento específico, etiologia aterosclerótica, idade ≥ 65 anos e ASPECTS > 7. Foi aplicado o teste exato de Fisher para verificar a existência de relação entre os parâmetros estenose, placa, tipo de infarto, tratamento, etiologia e idade, com o ASPECTS dicotomizado. Os mesmos parâmetros foram correlacionados com o ASPECTS total pelo teste não paramétrico de Mann-Whitney. Também foi verificada a relação entre os parâmetros de estenose e placa com etiologia aterosclerótica pelo teste exato de Fisher. Significância estatística foi considerada para valores de p ≤ 0,05. RESULTADOS Foram incluídos no estudo 28 pacientes com AVE agudo/hiperagudo. Desses 28 pacientes, quatro (14,3%) tinham menos de 55 anos, três (10,7%) tinham entre 55 e 64 anos, oito (28,6%) tinham entre 65 e 74 anos e 13 (46,4%) tinham 75 anos ou mais de idade. A média de idade foi de 70 ± 18 anos). Com relação ao grau de estenose, sete pacientes (25,0%) não apresentavam estenose, 16 (57,1%) apresentaram estenose menor que 50% e cinco (17,9%) tinham estenose relevante. Quanto ao tipo de placa, observou-se presença de placa calcificada em sete (25,0%) dos 28 pacientes, mista com maior componente calcificado em quatro (14,3%), mista com maior componente fibrolipídico em dois (7,1%), fibrolipídica em cinco (17,9%) e ausência de placa em 10 (35,7%). Quanto à estabilidade da placa, quatro (21,4%) pacientes tinham placas consideradas estáveis e 12 (42,9%), placas consideradas instáveis. Em relação ao ASPECTS, a maioria dos pacientes (n = 16) apresentou escore 10 (57,1%). Nota-se que apenas um (3,6%) paciente apresentou ASPECTS menor que 5, 5 (17,9%) apresentaram ASPECTS entre 5 e 7 e 22 (78,6%) tinham ASPECTS maior ou igual a 7. Quanto ao tipo de infarto, seis (21,4%) pacientes apresentaram ICAT, 16 (57,1%) apresentaram ICAP, cinco (17,9%) tiveram infarto lacunar e um (3,6%) paciente teve infarto no centro semioval. Não houve padrão de infarto de fronteira. A etiologia do infarto cerebral foi definida como aterosclerose de grandes vasos em 32,1% dos casos, doença de pequenas artérias em 7,1%, cardioembólica em 7,1% e indeterminada em 53,6%. Nenhum caso se enquadrou na categoria de outras etiologias. Na nossa amostra, quatro pacientes (14,3%) realizaram tratamento trombolítico, sete (25,0%) foram submetidos a trombectomia mecânica e 17 (60,7%) realizaram apenas tratamento conservador. Ao correlacionarmos o ASPECTS dicotomizado com os demais parâmetros avaliados (Tabela 1), constatamos relação estatisticamente significante com a estenose relevante e o tipo de infarto, ou seja, pacientes com ASPECTS inferior a 7 tinham maior chance de apresentar estenose relevante e infarto total do que os pacientes com ASPECTS acima de 7 (p = 0,022 e p < 0,001, respectivamente). A relação entre presença de placa instável e ASPECTS não foi estatisticamente significante, entretanto, destaca- se o fato de que nove pacientes não apresentavam placa detectável, portanto, não entraram nesta análise. Dos pacientes com ASPECTS acima de 7, 66,7% apresentavam placa instável, enquanto nenhum dos pacientes com escore inferior a 7 foram caracterizados com placa instável. Avaliados os demais parâmetros (etiologia aterosclerótica e idade), não houve relação estatisticamente significante com o ASPECTS dicotomizado. A correlação estatística entre o ASPECTS total e os demais parâmetros avaliados (Tabela 2) mostrou relação estatisticamente significante com a estenose relevante e o tipo de infarto. Os pacientes com estenose relevante tiveram ASPECTS menor que os sem estenose (p = 0,008), assim como os pacientes com infarto total também apresentaram ASPECTS menor que os com infarto parcial (p < 0,001). A correlação entre placa instável, etiologia aterosclerótica e idade não apresentou relação estatisticamente significante com o ASPECTS total. Também não houve associação significativa entre a etiologia aterosclerótica e os parâmetros de estenose relevante e placa instável. DISCUSSÃO A TCSC realizada precocemente no contexto do AVE pode ser normal, sendo as alterações isquêmicas demonstradas posteriormente na TC de seguimento(2). Nosso estudo corrobora a importância da ATC no protocolo de AVE, contribuindo com informações complementares à TCSC, uma vez que 53% dos pacientes incluídos não apresentavam alterações visíveis na TCSC, e dentre estes, 53% já apresentavam alterações na ATC, sendo um dos pacientes tratado com trombectomia mecânica. No estudo de von Kummer et al.(22), a TCSC também não detectou alterações em um terço dos casos de AVC posteriormente confirmados, contudo, os autores correlacionaram essa falha na detecção com isquemias menos graves, que levam a um dano tecidual isquêmico mais tardio. A ATC acrescenta informações relevantes, uma vez que auxilia na identificação da oclusão, na avaliação de seu local e sua extensão, contribuindo na decisão da melhor abordagem terapêutica para cada paciente. Nosso estudo confirma a importância desta técnica no protocolo inicial dos pacientes com AVC, ao identificar 11 oclusões arteriais (39,3% dos casos), ilustrados nas Figuras 1 e 2, sendo indicada a trombectomia mecânica em sete desses pacientes. 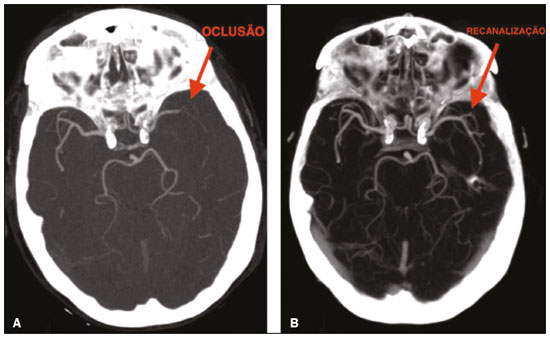 Figura 1. Paciente com oclusão na bifurcação da ACM esquerda em ramos M2 (A), com recanalização completa após trombectomia (B). 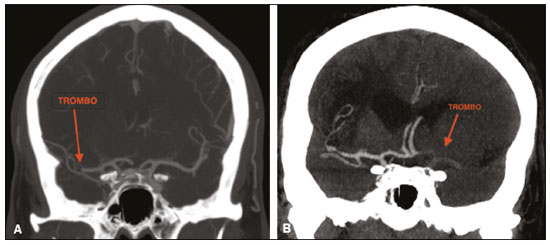 Figura 2. Paciente com oclusão no segmento M2 da ACM direita (A); outro paciente com oclusão na bifurcação da ACI esquerda (B). Em três pacientes que tiveram oclusões distais em ramos da ACM e na ACA não foi indicado tratamento por via hemodinâmica, em razão das evidências ainda incertas do benefício da trombectomia mecânica nesses casos(12). As diretrizes de 2018 da American Heart Association sobre o manejo do AVE agudo classificam a trombectomia com stent em casos de oclusão dos segmentos M2 e M3 da ACM como evidência IIb, com benefícios incertos; entretanto, a conduta terapêutica nos casos de oclusão distal no segmento M2 encontra-se em processo de mudança(6,12). Cinco estudos (MR CLEAN, ESCAPE, REVASCAT, SWIFT PRIME e EXTEND-IA), citados nos trabalhos de Mokin et al.(6) e Powers et al.(12), incluíram pacientes com oclusão de M2 na trombectomia, apresentando resultados favoráveis. Pela escassez de estudos com evidência de benefício da trombectomia para oclusões mais distais da ACM (segmentos M3) ou oclusões da ACA, ainda não se preconiza tal medida nessas localizações(6). Para determinar a melhor abordagem terapêutica, é importante levar em consideração todos os sinais patológicos na artéria carótida. Classicamente, o parâmetro de escolha era o grau de estenose extracraniana, um indicador indireto do processo aterosclerótico. Contudo, estudos mostraram que alguns pacientes com doença aterosclerótica sem estenose relevante podem apresentar alto risco dependendo da morfologia da placa, sendo a avaliação direta da estrutura e composição da placa de grande importância para prever o desenvolvimento de futuros eventos isquêmicos, bem como para direcionar o tratamento(22-24). No presente estudo, 16 pacientes (57%) apresentaram placas ateromatosas sem estenose relevante, dos quais 62% apresentavam placas instáveis. Portanto, com base apenas no parâmetro indireto da estenose, perder-se-ia a chance de tratar adequadamente quase 36% dos pacientes. O mesmo achado foi observado no estudo de Pacheco et al.(18), em que 34% dos pacientes apresentavam estenose não relevante, e destes, 59% exibiam placas vulneráveis, o que corresponde a 20% do total dos casos que não seriam tratados adequadamente considerando-se apenas o critério de estenose indireta. No nosso estudo foi observado que pacientes com estenose significativa apresentaram menor ASPECTS e maior ocorrência de infarto total. Yoo et al.(10) observaram que pacientes com ASPECTS menores tinham maior incidência de oclusão terminal da ACI, e constataram, ainda, que pacientes com ASPECTS menores tiveram tempos mais longos do início do AVE até a realização da TC do que os pacientes com ASPECTS maiores, fornecendo evidências de que o atraso do tratamento apresenta um efeito deletério mediado pela expansão do infarto. Não foi encontrada correlação estatisticamente significante entre a presença de placa instável e o ASPECTS dicotomizado no nosso estudo, contudo, devemos levar em consideração que a maioria dos pacientes com ASPECTS menor ou igual 7 apresentou causa indeterminada e não aterosclerótica, inviabilizando tal correlação. No presente estudo, a maior parte dos AVEs foi classificada como de etiologia indeterminada (53%), seguida de aterosclerose de grandes vasos (32%). Já nos estudos de Pacheco et al.(18) e Silva et al.(20), a aterosclerose foi a principal causa, ocorrendo em 50% e 41% dos casos, respectivamente. Contudo, vários estudos apresentam uma grande parcela dos pacientes com causa indeterminada, sendo uma das limitações da classificação TOAST, que superestima este grupo ao englobar particularidades muito heterogêneas nesta categoria(25-27). Na nossa pesquisa, a maioria dos pacientes tinha mais de 65 anos no momento do evento isquêmico, concordante com a idade média de estudos publicados(2,13,20). A literatura aponta a isquemia cerebral como incomum em pacientes jovens, porém, tem sido registrado um aumento dessa incidência nos últimos anos(27-30), correspondendo a cerca de 5% a 20% do total dos AVEs(27). Yamamoto(25relatou que na sua prática clínica não raramente se defronta com pacientes jovens com AVE sem a identificação da causa, mesmo após extensa avaliação clínica. No artigo de revisão de Correia et al.(28), a causa não foi identificada em 30% dos casos, mesmo após extensa avaliação clínica. No nosso estudo, 14% dos pacientes apresentavam idade inferior a 55 anos, não sendo possível identificar corretamente a etiologia isquêmica nesses casos. Uma das possíveis explicações descritas na literatura é a possibilidade de a etiopatogenia estar relacionada a fenômenos transitórios e completamente reversíveis, para os quais seria necessária uma investigação mais precoce ou mesmo prolongada para sua identificação(25,28). Nosso estudo apresenta algumas limitações, como amostra pequena e limitada a apenas uma instituição, avaliação restrita aos infartos da circulação anterior, investigação inconclusiva, perda do seguimento ambulatorial ou óbito antes da determinação da causa do infarto de alguns pacientes. Apesar disso, observaram-se várias relações interessantes entre AVE, ASPECTS e aterosclerose, que podem servir de auxílio na avaliação dos pacientes com infarto agudo. CONCLUSÃO Nossos dados revelaram que a ATC dos vasos intracranianos e cervicais no AVE agudo/hiperagudo possibilita a identificação do trombo, direcionando alguns pacientes para a trombectomia mecânica. Proporciona melhor avaliação de placas ateromatosas e sua possível correlação como causa do evento isquêmico, direcionando a terapêutica conforme suas características. Dessa forma, corroboramos a importância da ATC no protocolo do AVE no direcionamento dos tratamentos precoce e secundário mais adequados ao paciente. REFERÊNCIAS 1. Mainali S, Wahba M, Elijovich L. Detection of early ischemic changes in noncontrast CT head improved with "stroke windows". ISRN Neurosci. 2014;2014:654980. 2. Coutts SB, Lev MH, Eliasziw M, et al. ASPECTS on CTA source images versus unenhanced CT: added value in predicting final infarct extent and clinical outcome. Stroke. 2004;35:2472-6. 3. Puetz V, Sylaja PN, Hill MD, et al. CT angiography source images predict final infarct extent in patients with basilar artery occlusion. AJNR Am J Neuroradiol. 2009;30:1877-83. 4. Schröder J, Thomalla G. A critical review of Alberta Stroke Program Early CT Score for evaluation of acute stroke imaging. Front Neurol. 2017;7:245. 5. van Seeters T, Biessels GJ, van der Schaaf IC, et al. Prediction of outcome in patients with suspected acute ischaemic stroke with CT perfusion and CT angiography: the Dutch acute stroke trial (DUST) study protocol. BMC Neurol. 2014;14:37. 6. Mokin M, Ansari SA, McTaggart RA, et al. Indications for thrombectomy in acute ischemic stroke from emergent large vessel occlusion (ELVO): report of the SNIS Standards and Guidelines Committee. J Neurointerv Surg. 2019;11:215-20. 7. Yoo AJ, Zaidat OO, Chaudhry ZA, et al. Impact of pretreatment noncontrast CT Alberta Stroke Program Early CT Score on clinical outcome after intra-arterial stroke therapy. Stroke. 2014;45:746-51. 8. Barber PA, Demchuk AM, Zhang J, et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score. Lancet. 2000;355:1670-4. 9. Goyal M, Menon BK, Coutts SB, et al. Effect of baseline CT scan appearance and time to recanalization on clinical outcomes in endovascular thrombectomy of acute ischemic strokes. Stroke. 2011;42:93-7. 10. Yoo AJ, Berkhemer OA, Fransen PSS, et al. Effect of baseline Alberta Stroke Program Early CT Score on safety and efficacy of intra-arterial treatment: a subgroup analysis of a randomised phase 3 trial (MR CLEAN). Lancet Neurol. 2016;15:685-94. 11. Papanagiotou P, Ntaios G. Endovascular thrombectomy in acute ischemic stroke. Circ Cardiovasc Interv. 2018;11:e005362. 12. Powers WJ, Rabinstein AA, Ackerson T, et al. 2018 Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2018;49:e46-e110. 13. Coutts SB, Modi J, Patel SK, et al. CT/CT angiography and MRI findings predict recurrent stroke after transient ischemic attack and minor stroke: results of the prospective CATCH study. Stroke. 2012;43:1013-7. 14. Hankey GJ, Wee CK. Predicting early recurrent stroke with the recurrence risk estimator. JAMA Neurol. 2016;73:376-8. 15. Dubey P, Pandey S, Moonis G. Acute stroke imaging: recent updates. Stroke Res Treat. 2013;2013:767212. 16. Mokin M, Primiani CT, Siddiqui AH, et al. ASPECTS (Alberta Stroke Program Early CT Score) measurement using Hounsfield unit values when selecting patients for stroke thrombectomy. Stroke. 2017;48:1574-9. 17. Adams HP Jr, Bendixen BH, Kappelle LJ, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24:35-41. 18. Pacheco FT, Littig IA, Gagliardi RJ, et al. Multidetector computed tomography angiography in clinically suspected hyperacute ischemic stroke in the anterior circulation: an etiological workup in a cohort of Brazilian patients. Arq Neuropsiquiatr. 2015;73:408-14. 19. Radu RA, Terecoasa EO, Bajenaru OA, et al. Etiologic classification of ischemic stroke: where do we stand? Clin Neurol Neurosurg. 2017;159:93-106. 20. Silva DA, Woon FP, Lee MP, et al. South Asian patients with ischemic stroke: intracranial large arteries are the predominant site of disease. Stroke. 2007;38:2592-4. 21. Asdaghi N, Jeerakathil T, Hameed B, et al. Oxfordshire community stroke project classification poorly differentiates small cortical and subcortical infarcts. Stroke. 2011;42:2143-8. 22. von Kummer R, Bourquain H, Bastianello S, et al. Early prediction of irreversible brain damage after ischemic stroke at CT. Radiology. 2001;219:95-100. 23. Saba L, Anzidei M, Marincola BC, et al. Imaging of the carotid artery vulnerable plaque. Cardiovasc Intervent Radiol. 2014;37:572-85. 24. Saba L, Sanfilippo R, Pirisi R, et al. Multidetector-row CT angiography in the study of atherosclerotic carotid arteries. Neuroradiology. 2007;49:623-37. 25. Yamamoto FI. Ischemic stroke in young adults: an overview of etiological aspects. Arq Neuropsiquiatr. 2012;70:462-6. 26. Amarenco P, Bogousslavsky J, Caplan LR, et al. Classification of stroke subtypes. Cerebrovasc Dis. 2009;27:493-501. 27. Smajlovic D. Strokes in young adults: epidemiology and prevention. Vasc Health Risk Manag. 2015;11:157-64. 28. Correia JP, Figueiredo AS, Costa HM, et al. Investigação etiológica do acidente vascular cerebral no adulto jovem. Medicina Interna. 2018;25:213-23. 29. Kissela BM, Khoury JC, Alwell K, et al. Age at stroke: temporal trends in stroke incidence in a large, biracial population. Neurology. 2012;79:1781-7. 30. Hauer AJ, Ruigrok YM, Algra A, et al. Age-specific vascular risk factor profiles according to stroke subtype. J Am Heart Assoc. 2017; 6:e005090. 1. Hospital Santa Marta (HSM), Brasília, DF, Brasil 2. Hospital Universitário de Brasília, Brasília, DF, Brasil 3. Universidade de Brasília (UnB), Brasília, DF, Brasil a. https://orcid.org/0000-0002-7737-8031 b. https://orcid.org/0000-0002-3046-8494 c. https://orcid.org/0000-0001-6385-2954 d. https://orcid.org/0000-0003-4539-283X e. https://orcid.org/0000-0002-9734-5157 f. https://orcid.org/0000-0003-0290-8963 g. https://orcid.org/0000-0002-6783-4523 h. https://orcid.org/0000-0003-2791-2109 Correspondência: Dra. Bruna Arrais Dias Hospital Santa Marta – Radiologia Setor E Sul, Área Especial 01 e 17, s/n Taguatinga Sul. Brasília, DF, Brasil Email: bruninha_arrais@hotmail.com Recebido para publicação em 19/11/2020 Aceito, após revisão, em 11/1/2021 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554