Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 54 nº 6 - Nov. / Dez. of 2021
Vol. 54 nº 6 - Nov. / Dez. of 2021
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Sérgio Ferreira Alves Júnior1,a; Klaus Loureiro Irion2,b; Alessandro Severo Alves de Melo3,c; Gustavo de Souza Portes Meirelles4,d; Rosana Souza Rodrigues1,e; Arthur Soares Souza Jr.5,f; Bruno Hochhegger6,g; Gláucia Zanetti1,h; Edson Marchiori1,i |
|
|
Descritores: Neurofibromatoses; Cistos; Pneumopatias; Tomografia computadorizada. |
|
|
Resumo: INTRODUÇÃO 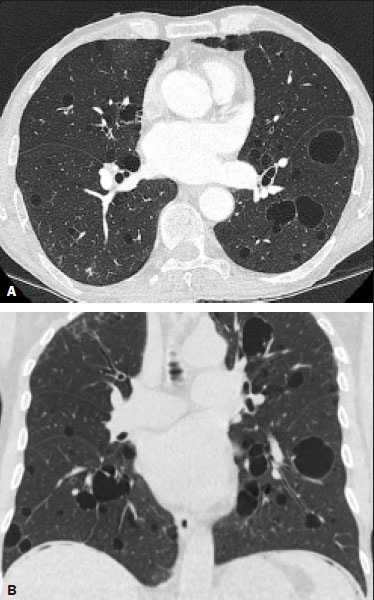 Figura 1. Homem, 75 anos, portador de NF1, não tabagista. TC do tórax. Cortes nos planos axial (A) e coronal (B) mostram múltiplos cistos, alguns maiores que 10 mm, de paredes finas, com predomínio em lobos inferiores, distribuição randômica e bilateral. Notam-se ainda múltiplos nódulos cutâneos na parede torácica. 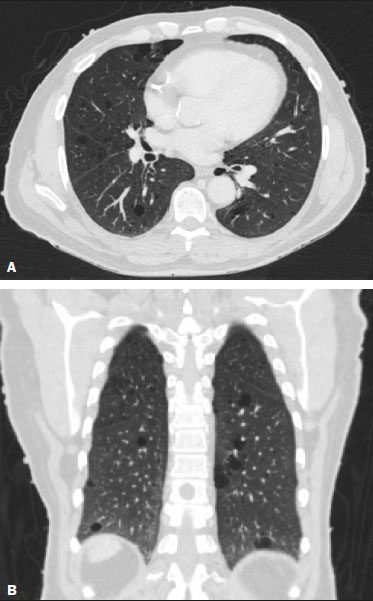 Figura 2. Homem, 65 anos, portador de NF1, história tabágica não disponível. TC do tórax. Cortes nos planos axial (A) e coronal (B) demonstram múltiplos cistos, menores que 10 mm, de paredes finas, com predomínio em lobos inferiores, distribuição randômica e bilateral. Notam-se ainda múltiplos nódulos cutâneos na parede torácica. 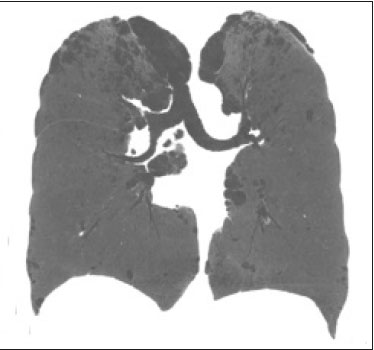 Figura 3. Mulher, 55 anos, portadora de NF1, não tabagista. TC do tórax com projeção em intensidade mínima. Corte no plano coronal mostra enfisema centrolobular e bolhas subpleurais bilateralmente, com predomínio em lobos superiores. 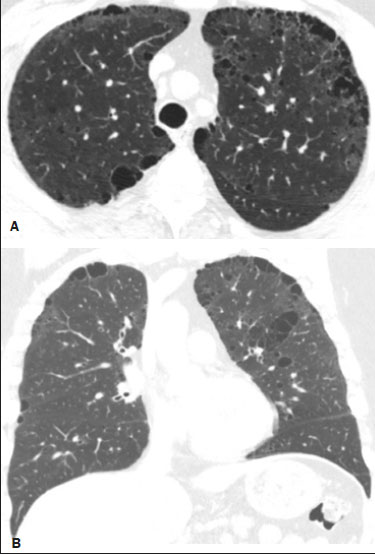 Figura 4. Homem, 45 anos, portador de NF1, não tabagista. TC do tórax. Cortes nos planos axial (A) e coronal (B) demonstram pequenas bolhas subpleurais, enfisema parasseptal em lobos superiores, bilaterais, com distribuição periférica, e pequenos cistos parenquimatosos de paredes finas. 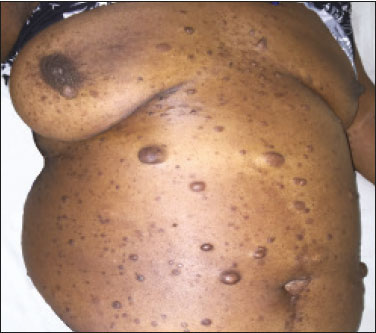 Figura 5. Mulher, 48 anos, portadora de NF1. Avaliação ectoscópica mostra múltiplos neurofibromas cutâneos pedunculados nas paredes torácica anterior e abdominal.  Distribuição das alterações tomográficas Comprometimento pulmonar foi bilateral em 12 dos casos estudados (85,7%) e unilateral em dois (14,3%).A doença tinha distribuição difusa em quatro (28,6%) pacientes, predominava nas zonas superiores em oito casos (57,1%) e nas zonas inferiores em dois (14,3%).Quanto à distribuição no eixo axial, os achados tiveram predomínio periférico em um (7,1%) caso, central em dois (14,3%) e eram randômicos em 11 (78,6%). Os cistos pulmonares foram encontrados em 13 dos casos estudados (92,9%), sendo bilaterais em 11 (84,6%) e unilaterais em dois (15,4%).Esses cistos eram difusos em quatro (30,8%) pacientes, predominavam nas zonas inferiores em dois (15,4%) e nas zonas superiores em sete (53,8%).Quanto à distribuição no eixo axial, os múltiplos cistos foram caracterizados como randômicos em 10 (76,9%) casos, como centrais em dois (15,4%) e periféricos em um (7,7%).Em relação à associação com tabagismo, sete (53,8%) pacientes não eram tabagistas.Os três pacientes tabagistas apresentavam cistos pulmonares. O enfisema pulmonar foi encontrado em oito dos casos estudados (57,1%), sendo bilateral e com predomínio nas zonas pulmonares superiores nos oito casos.Quanto à classificação, foi considerado centrolobular em cinco (62,5%) casos e parasseptal em cinco (62,5%).Em relação a associação com tabagismo, todos os tabagistas tinham alterações enfisematosas, porém, em dois (25,0%) pacientes não tabagistas essas alterações estavam presentes. As bolhas foram encontradas em seis dos casos estudados (42,9%), e em todos eram bilaterais, predominavam nas zonas superiores e tinham localização periférica (subpleural). As opacidades em vidro fosco e as reticulações foram encontradas em apenas um dos casos estudados (7,1%), sendo bilaterais, com distribuição periférica e sem predomínio evidente no eixo craniocaudal.Este paciente com opacidades em vidro fosco/reticulações era tabagista. DISCUSSÃO Houve discreto predomínio do sexo feminino na nossa série (57% dos casos), com uma razão entre sexos de 1:1,3 (masculino:feminino).Tal achado é concordante com a literatura, que estima não haver predileção por sexo(15–18). A idade dos pacientes variou de 11 a 75 anos, com mediana de 55 anos.Na literatura, a idade no diagnóstico é estimada entre 16 e 72 anos(19), achado concordante com nosso estudo.Sabe-se que o acometimento pulmonar na NF-DPD se dá mais tardiamente no curso da doença, não sendo evidentes antes de o paciente atingir a vida adulta, tipicamente na terceira ou quarta décadas de vida(20). A nossa série incluiu pacientes com NF-DPD não fumantes e fumantes.A literatura revisada sugere que tanto pacientes fumantes com NF1 quanto não fumantes podem evoluir com NF-DPD, ratificando a existência real desse acometimento pulmonar independentemente do uso do cigarro. No nosso estudo, o principal achado na TC do tórax foram os múltiplos cistos pulmonares, observados em 13 pacientes (92,9%), o enfisema pulmonar, em oito (57,1%), as bolhas subpleurais, em seis (42,9%), as opacidades em vidro fosco/reticulações, em um paciente (7,1%), e os nódulos traqueobrônquicos, em um (7,1%). Com relação à distribuição das lesões nos três eixos, nossa série mostrou comprometimento pulmonar bilateral em 12 pacientes (85,7%), predomínio em campos pulmonares superiores em oito (57,1%) e distribuição randômica em 11 (78,6%).A avaliação pormenorizada dos três principais achados de imagem (cistos pulmonares, enfisema pulmonar e bolhas subpleurais) demonstrou, com relação aos cistos pulmonares, bilateralidade em 11 pacientes (84,6%), predomínio em campos pulmonares superiores em sete (53,8%) e distribuição randômica em 10 (76,9%); em relação ao enfisema pulmonar, bilateralidade e predomínio em campos pulmonares superiores em todos os pacientes e morfologia centrolobular e parasseptal igualitária (62,5% cada) em cinco pacientes; e em relação às bolhas subpleurais, bilateralidade, predomínio em campos pulmonares superiores e distribuição periférica em todos os pacientes. Uma série de trabalhos recentes publicados no Brasil têm ressaltado a importância dos métodos de imagem na avaliação do tórax(21–26).Contudo, existem poucos estudos na literatura descrevendo os achados tomográficos pulmonares nos pacientes portadores de NF1.Em nossa revisão, encontramos apenas uma série de casos detalhando os porcentuais de prevalência específicos de cada achado tomográfico, em trabalho desenvolvido por Ueda et al.(19), em que 88 pacientes com diagnóstico de NF1 tiveram suas alterações torácicas descritas, sendo os principais achados encontrados os nódulos subcutâneos (51% dos casos), os nódulos cutâneos (39%), a escoliose (23%), o enfisema (18%), os cistos pulmonares (15%), as massas mediastinais (15%) e os nódulos em vidro fosco (9%).Além disso, cistos nas zonas pulmonares superiores foram observados em 85% dos casos, enquanto os nas zonas média e inferior foram observados em 46% e 54% dos casos, respectivamente.Cistos de distribuição periférica foram encontrados em todos os casos, mas apenas 31% mostraram cistos na porção central.A respeito do enfisema, houve uma distribuição dominante superior e periférica (94%), estatisticamente significante.A discrepância dos porcentuais de prevalência das alterações pulmonares nesse estudo em comparação ao nosso se deve ao fato de Ueda et al.(19) não terem estudado somente pacientes com NF-DPD, mas sim terem incluído todas as alterações torácicas na NF1, o que fez as proporções caírem.Ainda assim, a demonstração majoritária de localização das lesões nos campos pulmonares superiores é concordante com o nosso trabalho. Além da morfologia das lesões pulmonares, Ueda et al.avaliaram também a relação do tabagismo com a frequência dos achados pulmonares na NF-DPD.Os autores concluíram não haver diferença na taxa dos cistos pulmonares entre pacientes fumantes (1/19 casos) e não fumantes (3/42 casos), sugerindo que o tabagismo não afeta a presença nem o aspecto morfológico dos cistos nos pacientes com NF1(19).Antagonicamente, os resultados da série de Ueda et al.(19) sugeriram que o enfisema pulmonar é fortemente afetado pela história de tabagismo, sendo mais frequentes em pacientes NF1 fumantes (12/19 casos) do que em pacientes não fumantes (2/42 casos). Ao se analisar os resultados da nossa série, verificamos que a característica mais importante encontrada foi a elevada frequência dos múltiplos cistos pulmonares (92,9%), com apenas um caso sem tal padrão tomográfico.Ademais, os nossos resultados também sinalizam não haver diferença na frequência dos cistos pulmonares entre pacientes fumantes (3/3 casos) e não fumantes (7/8 casos).Nossos achados, contudo, mostram uma maior incidência de enfisema pulmonar em pacientes fumantes (3/3 casos) do que em pacientes não fumantes (2/8 casos), o que não nos permite estabelecer o enfisema como devido puramente à NF1 isolada de um contexto de tabagismo. De nota, ressalta-se que houve apenas um paciente com apresentação tomográfica com vidro fosco/reticulação no nosso estudo, sendo este paciente tabagista.Em revisões anteriores, os infiltrados intersticiais na TC do tórax foram descritos em alguns casos de NF-DPD, mas também foi observado que esses casos apresentavam outras causas para o infiltrado, como o próprio tabagismo(6,19). A presença de cistos e/ou bolhas foi detectada tanto em pacientes fumantes como em ex-fumantes, fazendo com que sua real associação com a NF1 seja questionada(6,27).Contudo, há evidências crescentes do envolvimento pulmonar em indivíduos não fumantes com NF1.Zamora et al.(28) mostraram que 4 de 16 (25%) pacientes com NF- DPD e história tabágica conhecida eram não fumantes.O estudo de Oikonomou et al.(29) identificou seis pacientes com NF1, todos não fumantes (23 a 61 anos), que foram submetidos a TC do tórax para investigar a presença de NF-DPD.Todos os seis pacientes apresentaram evidência de doença pulmonar cística.Os cistos predominavam no lobo superior, mostravam-se com “paredes extremamente finas, pouco perceptíveis, mas bem definidas”, e tamanhos variando de 2 a 18 mm.Cinco desses pacientes tinham menos de 20 cistos no total, enquanto o último paciente tinha mais de 100 cistos(29). O nosso estudo apresentou algumas limitações.Foi um estudo transversal, não permitindo avaliação evolutiva das alterações parenquimatosas pulmonares, e o desenho retrospectivo limitou uma melhor análise dos dados clínicos e da história tabágica para um pequeno porcentual dos pacientes.A despeito das limitações, a NF1 é uma doença rara e o acometimento pulmonar é um achado ainda mais incomum.Só encontramos na literatura uma única série de casos com foco de estudo nos padrões tomográficos de pacientes com NF-DPD que supera a nossa casuística, mostrando a relevância do nosso estudo. Em conclusão, a NF-DPD se apresentou essencialmente como três padrões na TC do tórax, em ordem de frequência: múltiplos cistos pulmonares, enfisema pulmonar e bolhas.As alterações tiveram distribuição predominantemente bilateral, superior e randômica.Pacientes fumantes e não fumantes apresentaram cistos pulmonares.Embora presente em não fumantes, não foi possível estabelecer que o enfisema pulmonar fosse devido à NF1. REFERÊNCIAS 1. Riccardi VM.Von Recklinghausen neurofibromatosis.N Engl J Med.1981;305:1617–27. 2. Alves Júnior SF, Zanetti G, Alves de Melo AS, et al.Neurofibromatosis type 1: state-of-the-art review with emphasis on pulmonary involvement.Respir Med.2019;149:9–15. 3. Reviron-Rabec L, Girerd B, Seferian A, et al.Pulmonary complications of type 1 neurofibromatosis.Rev Mal Respir.2016;33:460–73. 4. Alves Júnior SF, Carneiro LH, Niemeyer B, et al.A recurrent laryngeal nerve malignant peripheral nerve sheath tumor in a child with neurofibromatosis type 1.Arq Neuropsiquiatr.2018;76:635. 5. Alves Júnior SF, Pessoa Corrêa JA, Marchiori E.Malignant peripheral nerve sheath tumor arising within a lumbar spinal plexiform neurofibroma.World Neurosurg.2019;130:264–6. 6. Ryu JH, Parambil JG, McGrann PS, et al.Lack of evidence for an association between neurofibromatosis and pulmonary fibrosis.Chest.2005;128:2381–6. 7. Irion KL, Gasparetto TD, Marchiori E, et al.Neurofibromatosis type 1 with tracheobronchial neurofibromas: case report with emphasis on tomographic findings.J Thorac Imaging.2008;23:194–6. 8. Prudhomme L, Delleci C, Trimouille A, et al.Severe thoracic and spinal bone abnormalities in neurofibromatosis type 1.Eur J Med Genet.2020;63:103815. 9. Louza GF, Zanetti G, Marchiori E.Neurofibromatosis type I with pulmonary involvement.Arch Bronconeumol.2018;54:106–7. 10. Alves de Melo AS, Alves Jr SF, Antunes PM, et al.Lung cancer and parenchymal lung disease in a patient with neurofibromatosis type 1.J Bras Pneumol.2019;45:e20180285. 11. No authors listed.Neurofibromatosis.Conference statement.National Institutes of Health Consensus Development Conference.Arch Neurol.1988;45:575–8. 12. Hansell DM, Bankier AA, MacMahon H, et al.Fleischner Society: glossary of terms for thoracic imaging.Radiology.2008;246:697–722. 13. Silva CIS, Marchiori E, Souza Júnior AS, et al.Illustrated Brazilian consensus of terms and fundamental patterns in chest CT scans.J Bras Pneumol.2010;36:99–123. 14. Souza Jr AS, Araujo Neto C, Jasinovodolinsky D, et al.Terminologia para a descrição de tomografia computadorizada do tórax: sugestões iniciais para um consenso brasileiro.Radiol Bras.2002; 35:125–8. 15. Burkhalter JL, Morano JU, McCay MB.Diffuse interstitial lung disease in neurofibromatosis.South Med J.1986;79:944–6. 16. Ferner RE.Neurofibromatosis 1 and neurofibromatosis 2: a twenty first century perspective.Lancet Neurol.2007;6:340–51. 17. Hunt JC, Pugh DG.Skeletal lesions in neurofibromatosis.Radiology.1961;76:1–20. 18. Nardecchia E, Perfetti L, Castiglioni M, et al.Bullous lung disease and neurofibromatosis type-1.Monaldi Arch Chest Dis.2012; 77:105–7. 19. Ueda K, Honda O, Satoh Y, et al.Computed tomography (CT) findings in 88 neurofibromatosis 1 (NF1) patients: prevalence rates and correlations of thoracic findings.Eur J Radiol.2015;84:1191–5. 20. Patchefsky AS, Atkinson WG, Hoch WS, et al.Interstitial pulmonary fibrosis and von Recklinghausen’s disease.An ultrastructural and immunofluorescent study.Chest.1973;64:459–64. 21. Barbosa PNVP, Bitencourt AGV, Miranda GD, et al.Chest CT accuracy in the diagnosis of SARS-CoV-2 infection: initial experience in a cancer center.Radiol Bras.2020;53:211–5. 22. Oliveira RR, Rodrigues TP, Savoia P, et al.Lung ultrasound: an additional tool in COVID-19.Radiol Bras.2020;53:241–5. 23. Louza GF, Nobre LF, Mançano AD, et al.Lymphocytic interstitial pneumonia: computed tomography findings in 36 patients.Radiol Bras.2020;53:287–92. 24.Tibana TK, Camilo DMR, Nunes TF, et al.Congenital lobar emphysema.Radiol Bras.2019;52:62–3. 25. Santos RFT, Tibana TK, Adôrno IF, et al.Mounier-Kuhn syndrome: an unusual cause of bronchiectasis.Radiol Bras.2019;52:130–1. 26. Adôrno IF, Santos RFT, Faria BB, et al.Pleuropulmonary blastoma manifesting as spontaneous pneumothorax: an unusual presentation.Radiol Bras.2019;52:202–3. 27. Trisolini R, Livi V, Agli LL, et al.Diffuse lung disease in neurofibromatosis.Lung.2012;190:249–50. 28. Zamora AC, Collard HR, Wolters PJ, et al.Neurofibromatosis-associated lung disease: a case series and literature review.Eur Respir J.2007;29:210–4. 29. Oikonomou A, Vadikolias K, Birbilis T, et al.HRCT findings in the lungs of non-smokers with neurofibromatosis.Eur J Radiol.2011; 80:e520–3. 1. Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil 2. Manchester University, NIHR Biomedical Research Centre, Manchester, United Kingdom 3. Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil 4. Grupo Fleury, São Paulo, SP, Brasil 5. Faculdade de Medicina de São José do Rio Preto (Famerp), São José do Rio Preto, SP, Brasil 6. Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil a.https://orcid.org/0000-0001-6249-450X b.https://orcid.org/0000-0002-7860-7879 c.https://orcid.org/0000-0002-9536-6608 d.https://orcid.org/0000-0002-4964-4160 e.https://orcid.org/0000-0002-9952-3834 f.https://orcid.org/0000-0001-8079-6712 g.https://orcid.org/0000-0003-1984-4636 h.https://orcid.org/0000-0003-0261-1860 i.https://orcid.org/0000-0001-8797-7380 Correspondência: Dr. Edson Marchiori Rua Thomaz Cameron, 438, Valparaíso. Petrópolis, RJ, Brasil, 25685-120 E-mail: edmarchiori@gmail.com Recebido para publicação em 4/10/2020 Aceito, após revisão, em 2/11/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554