Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 54 nº 2 - Mar. / Abr. of 2021
Vol. 54 nº 2 - Mar. / Abr. of 2021
|
ENSAIO PICTÓRICO
|
|
|
|
|
Autho(rs): Maria Inês Novis1,a; Ana Paula Carvalhal Moura1,b; Agnes de Paula Fernandes Watanabe1,c; Luciana CarlaLongo e Pereira1,d; Gisele Warmbrand1,e; Giuseppe D’Ippolito1,2,f |
|
|
Descritores: Ressonância magnética; Placenta/diagnóstico por imagem; Placenta acreta/diagnóstico. |
|
|
Resumo: INTRODUÇÃO
A análise placentária faz parte da avaliação pré-natal de rotina, inicialmente realizada por ultrassonografia (US) com Doppler. A ressonância magnética (RM) é reservada para situações de US duvidosa, por apresentar boa resolução tecidual, independentemente do biotipo materno ou da posição fetal, e permitir aquisição de imagens multiplanares sem radiação ionizante(1). O crescente número de manipulações cirúrgicas uterinas nos últimos anos provocou aumento de casos suspeitos de doenças adesivas placentárias (DAPs), com consequente aumento nas solicitações de RM placentária(2). Os radiologistas precisam se familiarizar com esses exames, pois as doenças placentárias, embora raras, apresentam potencial morbimortalidade materno-fetal. Este ensaio procura revisar a anatomia placentária normal, variações anatômicas, terminologias atuais e principais alterações, por meio de exemplos didáticos. ANATOMIA NORMAL NA RM Os exames de RM devem ser realizados em equipamentos de 1,5 a 3,0 T, com bobina tipo phased-array, a paciente em posição supina, bexiga em pequena/média repleção, idealmente entre 28 e 32 semanas de gestação. A utilização de gadolínio deve ser evitada, pois foi associada a risco aumentado de doenças reumatológicas, inflamatórias e condições infiltrativas cutâneas em crianças com histórico de exposição intrauterina ao contraste, além de aumento da incidência de natimortos e de óbito neonatal(3). Nosso protocolo sugerido tem duração de 20–30 minutos e encontra-se resumido na Tabela 1. O útero gravídico tem contornos lisos e formato de pera invertida, com região fundo-corporal mais larga que o segmento inferior (Figura 1)(2). 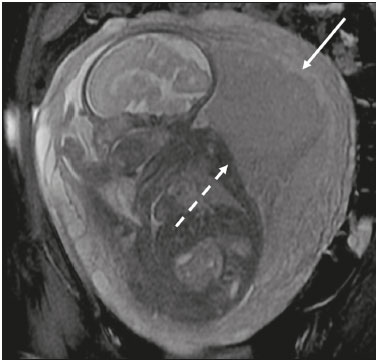 Figura 1. Coronal T2 FIESTA fat sat. Útero gravídico, com formato de pera invertida, com placenta corporal esquerda exibindo faces materna (seta sólida) e fetal (seta tracejada). A placenta apresenta superfícies fetal (placa coriônica) e materna (placa basal), junto ao espaço retroplacentário (Figura 1). No segundo trimestre de gestação, a placenta tem morfologia discoide, achatada, superfície lisa e sinal homogêneo, há boa visibilização da interface miométrio-placentária e o miométrio tem aspecto trilaminar com hipersinal central nas imagens ponderadas em T2 (Figura 2). Com o amadurecimento placentário no terceiro trimestre, há melhor definição dos cotilédones (sobretudo em aparelhos de 3,0 T), progressivo afilamento miometrial, lobulações na face fetal e vascularização subplacentária caracterizada por flow voids (Figura 3)(2). 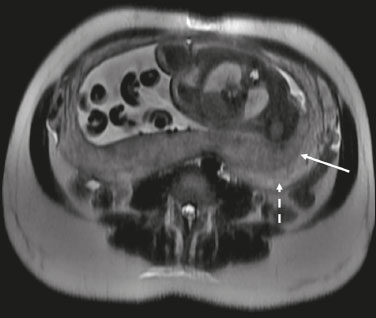 Figura 2. Axial T2, idade gestacional de 26 semanas. Placenta corporal posterior, com nítida interface miométrio-placentária (seta sólida), miométrio trilaminar com hipersinal central (seta tracejada). 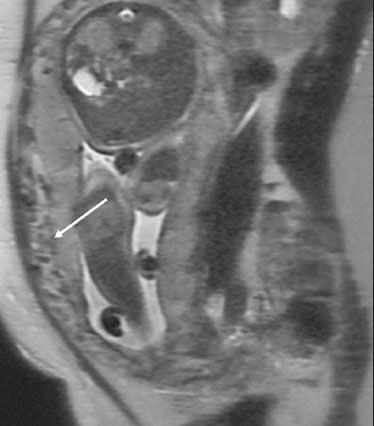 Figura 3. Sagital T2, idade gestacional de 33 semanas. Afilamento miometrial e flow voids retroplacentários (seta). A espessura placentária aumenta no decorrer da idade gestacional e deve ser mensurada na sua porção média, junto à inserção do cordão umbilical e perpendicular ao eixo longo placentário, com valor normal de 2 a 4 cm. Doenças hematológicas e vasculares sistêmicas com microinfartos cursam com afilamento placentário, enquanto hidropsia fetal, infecções pré-natais, diabetes e anemia materna cursam com espessamento placentário(2,4). VARIAÇÕES ANATÔMICAS As variações anatômicas placentárias apresentam-se na forma de(1,2,4):
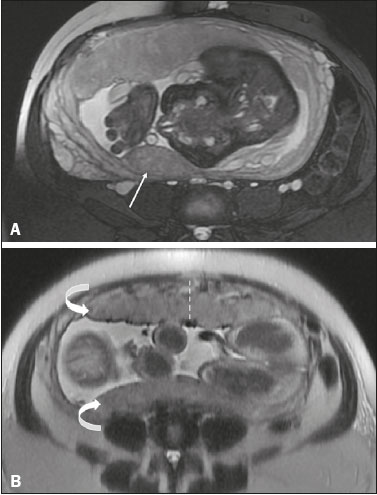
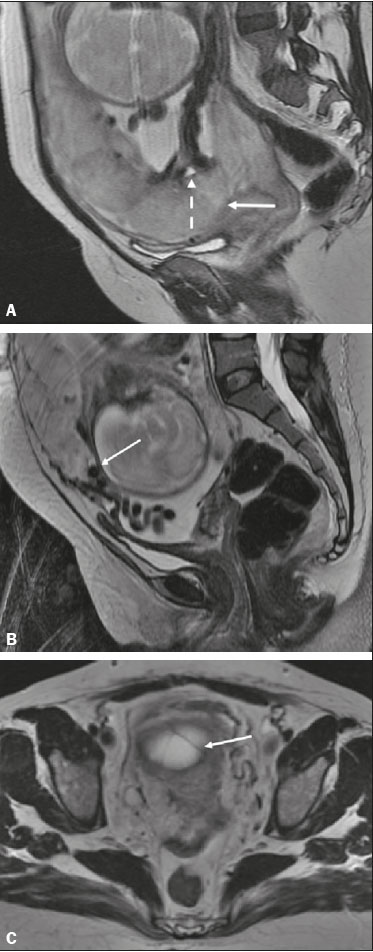
Vasa previa: finos vasos correm pelas membranas próximos ao orifício cervical interno (OCI) e abaixo da apresentação fetal (prevalência de 0,04%). Há risco aumentado de ruptura de membranas, sangramento e exsanguinação fetal, com indicação de cesárea (Figura 5C). PLACENTA BAIXA × PP Placenta de inserção baixa é quando a implantação ocorre no segmento uterino inferior, com margem placentária distando menos de 2 cm do OCI sem recobri-lo, mais bem avaliada no plano sagital do colo uterino (Figura 6A). Associa-se a maior risco de sangramento(5). O termo PP é reservado para casos em que a placenta recobre parcial ou totalmente o OCI (Figuras 6B e 6C). Esta informação deve constar no laudo de forma descritiva, devendo-se evitar os termos PP marginal, parcial, completa e centro-total. O diagnóstico de PP só deve ser realizado no terceiro trimestre (próximo de 30 semanas), pois antes disso ainda pode haver migração placentária(4,6). Os principais fatores de risco para PP são: cesárea anterior/cicatrizes uterinas, idade materna avançada, multiparidade, curetagens, gemelaridade, antecedente de PP (recorrência em 4% a 8%), tabagismo e uso de drogas ilícitas como cocaína(5). 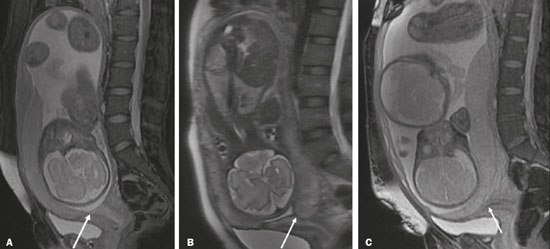 Figura 6. Sagital T2 FIESTA fat sat: A: Placenta baixa: margem placentária em contato com margem do OCI (seta), sem recobri-lo. B: PP posterior: margem placentária cobre parcialmente o OCI (seta). C: PP posterior: margem placentária cobre totalmente o OCI (seta). DESCOLAMENTO PREMATURO DE PLACENTA Consiste em situação rara (< 1%), causa parto pre- maturo e aumento da mortalidade fetal. A US pode ser falso-negativa em mais de 50% dos casos, devido a possível isoecogenicidade entre hematoma e placenta. Na RM, o hematoma é bem distinto da placenta, pode apresentar restrição à difusão e seu comportamento de sinal pode ajudar a diferenciar fases aguda, subaguda e crônica, colaborando na predição da estabilidade do sangramento(2,4). O hematoma é dividido em subcoriônico (cerca de 57% dos casos, pré-placentário, entre as membranas e a placenta por ruptura de veias uteroplacentárias), retroplacentário (43% dos casos, por ruptura de pequenas artérias deciduais), placentário e subamniótico (raro, entre o âmnion e o córion) (Figura 7)(1,2). 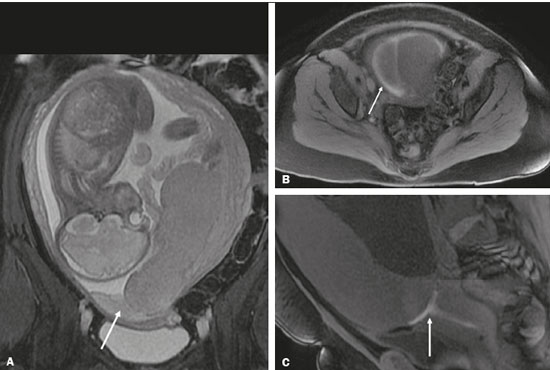 Figura 7. Coronal T2 FIESTA fat sat (A) e axial T1 fat sat (B): PP com hematoma retroplacentário, que exibe sinal intermediário em T2 (seta) e hipersinal em T1 (seta). C: Sagital T1 fat sat: PP com lâmina hemática retroplacentária e no canal cervical (seta). DAP A DAP decorre de invasão trofoblástica excessiva e decidualização anômala, com incidência crescente e proporcional ao número de cesáreas (risco de 11% para uma cesárea e 61% para três cesáreas). Outros fatores de risco são: cirurgia uterina prévia, PP, reprodução assistida, idade materna avançada e síndrome de Asherman(7,8). Representa um espectro de doenças, desde placenta acreta, em que há contato direto da placenta com o miométrio (invasão parcial), passando pela placenta percreta, na qual ocorre invasão miometrial total, até a placenta increta, caracterizada por extensão placentária além da serosa uterina e eventual invasão de órgãos adjacentes, como a bexiga. Esta diferenciação pode ser um desafio para os métodos de imagem(4,8). A suspeita de DAP é a principal indicação de RM, sendo o diagnóstico pré-natal de extrema importância por permitir melhor programação do parto com equipe multidisciplinar e possível embolização de artéria uterina, evitando histerectomia(8). Os sinais de DAP na RM são divididos em maiores ou menores, quando relacionados à especificidade diagnóstica superior ou inferior a 80%, respectivamente. Os sinais maiores consistem em: lobulação uterina anormal, protuberância placentária, heterogeneidade placentária, coexistência de bandas intraplacentárias hipointensas em T2 com retração placentária, e protrusão placentária em estruturas adjacentes (incluindo OCI). Os sinais menores descritos são: banda de hipossinal em T2 (> 2,0 cm de comprimento e > 1,0 cm de espessura), indefinição da interface miométrio-placentária, afilamento miometrial, vascularização placentária anormal e hipervascularização subserosa (Figuras 8 e 9). A sequência ideal para avaliação desses sinais é T2FSE, em que é mais bem caracterizada a heterogeneidade placentária(1,2,4,7,9). 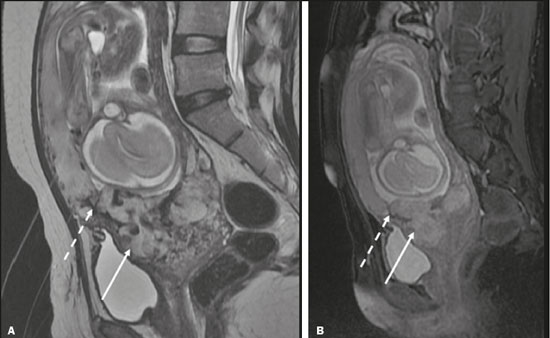 Figura 8. Paciente de 35 anos, idade gestacional de 22 semanas, um parto cesárea. A: Sagital T2 FSE: PP com lobulação uterina, protuberância placentária (seta sólida), heterogeneidade com bandas de hipossinal e retração placentária (seta tracejada), perda da interface útero-placentária e afilamento miometrial sugerindo DAP (sequência ideal para avaliação de acretismo). B: Sagital T2 FIESTA fat sat: mostra os mesmos sinais, de forma menos evidente do que na sequência FSE. Acretismo confirmado durante o parto, evoluiu para histerectomia total. 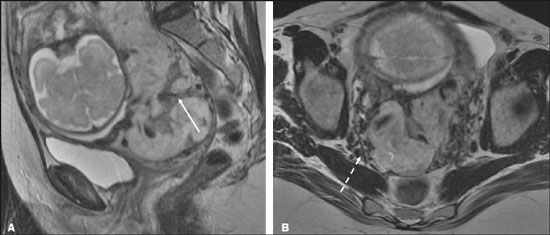 Figura 9. Paciente de 37 anos, idade gestacional de 32 semanas, um parto normal e dois abortos. Sagital T2 FSE (A) e axial T2 FSE (B): protuberância e heterogeneidade placentárias, com bandas de hipossinal (seta sólida) e aumento da vascularização subserosa (seta tracejada). Acretismo placentário confirmado no parto, com realização de histerectomia total. DOENÇA TROFOBLÁSTICA GESTACIONAL Doença relativamente incomum, com espectro de apresentações benignas e malignas, que inclui desde mola hidatiforme parcial ou completa até neoplasia trofoblástica persistente, abrangendo mola invasiva, coriocarcinoma e tumor de sítio trofoblástico. Os principais fatores de risco são doença trofoblástica prévia e idade materna avançada. Cursa com aumento de B-hCG, hiperêmese, aumento uterino desproporcional à idade gestacional, sangramento e ovários aumentados com cistos de corpo lúteo(1). A mola hidatiforme completa, sem embrião, é a forma mais comum da doença. A neoplasia trofoblástica persistente tem incidência de até 29% após a ocorrência de mola e a RM é útil na avaliação de invasão miometrial e estadiamento local (Figura 10)(2). 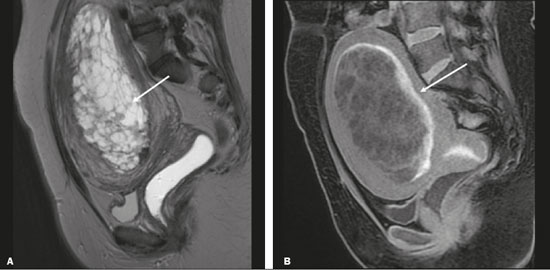 Figura 10. A: Sagital T2 FSE: cavidade uterina distendida por conteúdo heterogêneo com múltiplos cistos (seta). B: Sagital T1 fat sat: lâmina hemática circundando a formação cística e estendendo-se ao canal cervical (seta). Anatomopatológico pós-histerectomia: mola completa. O corangioma é o tumor placentário não trofoblástico mais comum (1% das placentas, situado junto à inserção do cordão umbilical), seguido pelo teratoma e pelas metástases (por exemplo: melanoma, pulmão e por infiltração leucêmica)(1,2,4). RETENÇÃO DE PRODUTOS DE CONCEPÇÃO A suspeita ocorre quando há saída incompleta da placenta ou sangramento vaginal persistente após parto ou abortamento, geralmente diagnosticado por US. Na RM apresenta-se como imagem intracavitária excêntrica e heterogênea nas sequências ponderadas em T1 e T2 (geralmente com hipersinal em T1 e sinal baixo ou intermediário em T2), com obliteração da zona juncional e afilamento miometrial, hiper ou hipovascularizada, com sangue intracavitário. O diagnóstico diferencial inclui doença trofoblástica gestacional e malformação arteriovenosa uterina adquirida(1,10). INFORMAÇÕES ADICIONAIS A avaliação da RM placentária deve incluir, ainda, o comprimento do colo uterino, de maneira descritiva, evitando termos como “colo curto”. Nos exames realizados entre 18 e 24 semanas, o comprimento cervical inferior a 3 cm pode ajudar a definir risco de parto prematuro (sobretudo se < 2 cm). A partir de 24 semanas, esta medida será valorizada pelo obstetra em correlação com os exames anteriores e o quadro clínico(5). Salienta-se, ainda, a importância de descrever eventuais achados adicionais, como miomas uterinos, massas ovarianas, anomalias fetais grosseiras ou oligo/polidrâmnio. A RM placentária tem limitações inerentes à paciente, como contrações uterinas, movimentação fetal e materna, claustrofobia, dificuldade para permanecer em decúbito no terceiro trimestre, além das limitações relacionadas ao método, como tempo de exame relativamente longo, custo elevado e necessidade de radiologistas familiarizados com doença placentária. No passado, os exames apenas informavam a localização placentária. Atualmente, acredita-se que a imagem placentária seja vital para a compreensão da fisiologia e eficiência placentárias, com provável contribuição futura no entendimento dos partos prematuros, restrição de crescimento fetal e pré-eclâmpsia. Possibilidades com imagem tridimensional, RM funcional para avaliação da vascularização placentária, maior uso da difusão e blood oxigen level dependent imaging, e análise textural placentária quantitativa (radiomic) podem agregar informações em futuro próximo(4). CONCLUSÃO A RM placentária tem sido utilizada como importante ferramenta complementar à US, sendo fundamental que o radiologista esteja familiarizado com os principais aspectos da placenta normal e alterada. O contato entre radio logistas e obstetras é crucial para a definição da conduta, visando à redução da morbimortalidade materno-fetal. REFERÊNCIAS 1. Elsayes KM, Trout AT, Friedkin AM, et al. Imaging of the placenta: a multimodality pictorial review. Radiographics. 2009;29:1371–91. 2. Masselli G, Gualdi G. MR imaging of the placenta: what a radiologist should know. Abdom Imaging. 2013;38:573–87. 3. Jha P, Poder L, Bourgioti C, et al. Society of Abdominal Radiology (SAR) and European Society of Urogenital Radiology (ESUR) joint consensus statement for MR imaging of placenta accreta spectrum disorders. Eur Radiol. 2020;30:2604–15. 4. Fadl S, Moshiri M, Fligner CL, et al. Placental imaging: normal appearance with review of pathologic findings. Radiographics. 2017; 37:979–98. 5. Cunningham FG, Leveno KJ, Bloom SL, et al., editors. Williams obstetrics. 25th ed. New York, NY: McGraw-Hill; 2018. 6. Kumar I, Verma A, Jain M, et al. Structured evaluation and reporting in imaging of placenta and umbilical cord. Acta Radiol. 2020;25: 685–704. 7. Kilcoyne A, Shenoy-Bhangle AS, Roberts DJ, et al. MRI of placenta accreta, placenta increta, and placenta percreta: pearls and pitfalls. AJR Am J Roentgenol. 2017;208:214–21. 8. Cuthbert F, Vinas MT, Whitby E. The MRI features of placental adhesion disorder–a pictorial review. Br J Radiol. 2016;89:20160284. 9. Agostini TCF, Figueiredo R, Warmbrand G, et al. Placental adhesion disorder: magnetic resonance imaging features and a proposal for a structured report. Radiol Bras. 2020;53:329–36. 10. Godoy LL, Torres US, D’Ippolito G. Subinvolution of the placental site associated with focal retained products of conception and placenta accreta mimicking uterine arteriovenous malformation on CT and MRI: a lesson to be learned. Radiol Bras. 2018;51:135–6. 1. Fleury Medicina e Saúde, São Paulo, SP, Brasil 2. Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil a. https://orcid.org/0000-0002-4714-1623 b. https://orcid.org/0000-0003-2900-6011 c. https://orcid.org/0000-0002-0235-8896 d. https://orcid.org/0000-0002-9921-6228 e. https://orcid.org/0000-0001-8304-6677 f. https://orcid.org/0000-0002-2701-1928 Correspondência: Dra. Maria Inês Novis Fleury Medicina e Saúde Rua Cincinato Braga, 282, Bela Vista São Paulo, SP, Brazil, 01333-910 Email: maria.novis@grupofleury.com.br Recebido para publicação em 19/1/2020 Aceito, após revisão, em 4/4/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554