Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 54 nº 1 - Jan. / Fev. of 2021
Vol. 54 nº 1 - Jan. / Fev. of 2021
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Giovanna Ricarte Granja Gomesa; Marcos Cordeiro D’Ornellasb; Gustavo Nogara Dottoc |
|
|
Descritores: Aneurisma da aorta abdominal/diagnóstico por imagem; Impressão tridimensional; Doenças da aorta; Materiais biocompatíveis; Procedimentos endovasculares; Implante de prótese vascular. |
|
|
Resumo: INTRODUÇÃO
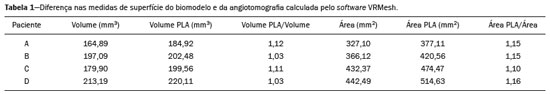
O aneurisma é definido como uma dilatação focal e permanente de no mínimo 50% do diâmetro normal do vaso. A aorta abdominal é o local de acometimento mais comum e são considerados aneurismas nesta localização quando a dilatação for igual ou superior a 3 cm(1). Os principais fatores de risco são sexo masculino, idade maior que 50 anos(2–4), tabagistas(2–5), histórico familiar positivo para aneurisma de aorta abdominal (AAA), principalmente diagnóstico em familiares de primeiro grau(2–6). O aneurisma é formado em consequência da degeneração da camada média arterial, levando a uma dilatação lenta e contínua da luz do vaso(1). Apesar dos constantes estudos técnico-científicos sobre a formação do aneurisma, ainda não há uma correlação direta com a doença aterosclerótica, usualmente atribuída como a principal causa desse processo(7). Entre as outras causas citam-se trauma, infecção, artrite, necrose cística da túnica média, doenças congênitas do tecido conjuntivo, como a síndrome de Marfan, e ruptura anastomótica(1,7). A maioria dos pacientes com AAA é assintomática, diagnosticada em exames de imagem realizados com outras finalidades(1,7). O elevado risco de ruptura e potencial letalidade é intimamente relacionado ao tamanho e crescimento do aneurisma(8), sendo indicado tratamento cirúrgico quando se iniciam os sintomas, o diâmetro do aneurisma atinge 5 cm(1) ou há expansão maior que 1 cm em um ano(1). O tratamento eletivo dos AAAs pode ser realizado com duas técnicas distintas: cirurgia convencional aberta ou reparo endovascular(1). A angiotomografia de aorta abdominal é utilizada como planejamento cirúrgico de ambas as técnicas, para detecção do tipo, localização, tamanho, acometimento dos ramos da aorta e presença de trombos e calcificações no interior do aneurisma(1). A tortuosidade, angulação e extensão do trombo intraluminal devem ser analisadas, pois influenciam no risco de embolização periprocedimento(9). Enquanto no tratamento cirúrgico aberto a escolha da prótese se faz no transoperatório, no tratamento endovascular é necessário mensurar os segmentos da doença em um modelo bidimensional ou tridimensional (3D) virtual, com o objetivo de selecionar, antes do ato cirúrgico, qual a prótese que melhor se adaptará à morfologia do paciente. A impressão 3D vem ganhando espaço na área médica principalmente no planejamento pré-operatório, por produzir modelos análogos à anatomia do paciente, o que facilita a visualização das estruturas(10), podendo reduzir a perda de sangue no transoperatório(11), assim como auxiliar na melhor comunicação com o paciente(11,12). Esta técnica também já foi utilizada para criação de implantes, próteses e instrumentos cirúrgicos(11). As especialidades cirúrgicas pioneiras a incorporar a impressão 3D foram a traumatologia e a cirurgia bucomaxilofacial, uma vez que as primeiras impressoras utilizavam apenas materiais rígidos(11). Atualmente, os biomodelos são mais utilizados em cirurgias pélvicas e craniofaciais(13), contudo, quase todas as especialidades cirúrgicas encontraram aplicabilidade para a impressão 3D(11). A cirurgia endovascular para correção do AAA requer planejamento pré-operatório minucioso em modelo 3D(13), pela necessidade de se avaliar as ramificações da aorta, proximidade de órgãos e estruturas vitais. Ao gerar um modelo físico, os cirurgiões têm a oportunidade de manipular as variações anatômicas de cada caso e explorar as estruturas circundantes, aprimorando o planejamento pré-operatório(10) e diminuindo o tempo cirúrgico(11). O planejamento pré-operatório utilizando biomodelo 3D já demonstrou ser mais vantajoso em relação à imagem 3D digital em estudos recentes. Médicos residentes de cirurgia foram convidados a analisar modelos 3D de computador ou modelos 3D impressos e posteriormente formular um plano pré-operatório. O grupo que analisou os modelos impressos obteve resultados significativamente melhores na qualidade do plano cirúrgico(10). Enquanto a imagem 3D no computador apresenta apenas informação ao sistema visual dos cirurgiões, ao abordar o modelo com as mãos e os olhos o modelo mental da anatomia em particular de cada paciente é aprimorado(10), facilitando ao cirurgião planejar seus passos no transoperatório. O objetivo deste trabalho é comparar as medidas intraluminais e a volumetria de segmentos de AAA obtidas por tomografia computadorizada (TC) dos biomodelos 3D e a angiotomografia de pacientes submetidos a correção endovascular dessa doença. MATERIAIS E MÉTODOS Seleção dos pacientes Quatro pacientes foram selecionados em pesquisa de prontuários dos pacientes internados com características relacionadas a aneurisma de aorta, no Hospital Universitário de Santa Maria, entre janeiro de 2016 e novembro de 2017. Os pacientes que realizaram angiotomografia e tratamento endovascular nesse período foram incluídos no trabalho. Reconstrução 3D e criação do biomodelo O processo para a criação dos biomodelos iniciou com a aquisição de imagens seccionais da angiotomografia dos pacientes selecionados, em formato DICOM do software Horos, transformadas em arquivo 3D em formato STL utilizando a ferramenta 3DSR do mesmo software (Figura 1). Os artefatos circundantes à região do aneurisma foram excluídos usando o software Meshmixer versão 2.9.1 (Autodesk, Inc., San Rafael, CA, EUA) (Figura 2). Este software importa os dados do Horos e produz imagens por meio de nuvens de pontos esparsas, que são processadas a fim de se obter nuvens de pontos densas, também conhecidas como malhas triangulares. 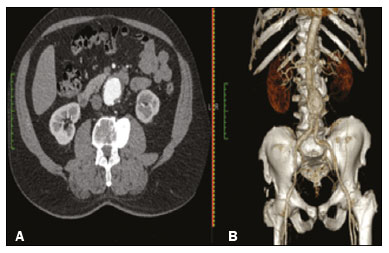 Figura 1. Angiotomografia de aorta abdominal usando o software Horos, em corte axial (A) e reconstrução 3D (B). 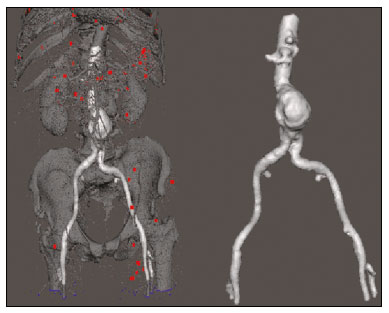 Figura 2. Seleção da região de interesse pelo software Meshmixer. Eventuais erros de preenchimento na malha foram corrigidos e cada modelo foi segmentado em quatro partes, pelo software Netfabb (Autodesk, Inc.), visando a economia de material e de tempo. Após a execução dessa etapa, o arquivo foi exportado para o software Cliever Studio 5.1 Pro (Cliever Tecnologia, Belo Horizonte, MG, Brasil). O software Cliever Studio 5.1 Pro foi desenvolvido para gerenciar as impressões nas máquinas da própria marca. É possível escolher o preenchimento interno, a espessura das bordas, a altura entre as camadas e o ângulo de ativação do suporte(14). É necessária a inclusão de um pilar de sustentação para a criação de peças com angulação menor que 45° em relação à mesa de impressão(15). No presente trabalho, foi utilizado o ácido polilático (polylactic acid – PLA) como filamento. Na impressão foram utilizados preenchimento interno de 5%, espaçamento entre as camadas (espessura) de duas unidades, altura entre as camadas de 0,25 mm e ângulo de ativação do suporte entre 30–45°, dependendo do modelo. Essas medidas foram escolhidas com a finalidade de diminuir o tempo de impressão e reduzir o tamanho do suporte, visando a economia de material e de tempo para retirada dos pilares. As espessuras dos modelos foram ampliadas em 1 mm para atender as exigências técnicas de impressão 3D. Esta condição foi necessária para obter espessura mínima para impressão e assim posicionar as partes dos modelos sobre a base, evitando imprecisões e eventuais perdas de material para a sustentação das partes. O software Cliever Studio 5.1 Pro fornece informações automáticas após a importação do arquivo, como altura, largura e comprimento do modelo, tamanho e custo de filamento e tempo estimado de impressão. O tempo médio de impressão foi de 14 horas e o custo de filamento foi de aproximadamente R$ 13,00 por biomodelo. Após finalizado o processo de impressão (Figura 3), os pilares de sustentação foram retirados e as quatro partes dos biomodelos foram coladas com acetona e/ou cianoacrilato para formar o modelo PLA em tamanho real da aorta abdominal de cada um dos pacientes envolvidos (Figura 4). As etapas foram realizadas de maneira manual.  Figura 3. Término da impressão do biomodelo.  Figura 4. Biomodelo após retirada dos suportes e colagem. Aferição métrica e volumétrica da angiotomografia e dos biomodelos Realizou-se TC dos biomodelos dentro de uma caixa de papelão, separados com isopor (Figura 5). O isopor foi utilizado para não haver sobreposição das imagens dos biomodelos e a caixa de papelão foi utilizada com fins de redução dos custos, realizando-se somente uma TC em vez de uma TC para cada paciente. Os artefatos de imagem não pertinentes ao estudo foram eliminados de maneira manual usando o software Meshmixer. 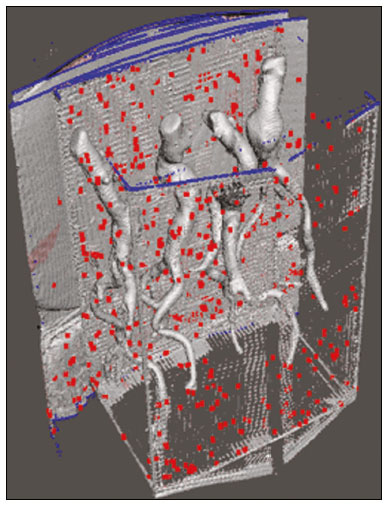 Figura 5. Antes de eliminar a imagem da caixa de papelão da TC por meio do software Meshmixer. Foram comparadas as medidas de pontos da aorta abdominal da angiotomografia dos pacientes e da TC dos biomodelos. As aferições métricas foram sobrepostas e comparadas por softwares VRMesh (VirtualGrid, Bellevue, WA, EUA), enquanto as análises volumétricas foram feitas pelo software Netfabb. Como os arquivos foram provenientes do mesmo paciente, os dados compartilhados em cada varredura possuem uma referência comum, portanto, automaticamente alinhados uns aos outros. Primeiramente, os arquivos referentes à angiotomografia pré-operatória e à tomografia dos biomodelos 3D impressos foram exportados para o software VRMesh – nuvem de pontos 3D e software de processamento de malhas. Os modelos foram sobrepostos e fundidos em um único modelo, e a cor de um dos modelos foi trocada para vermelho para melhorar a identificação pela ferramenta color. Após a seleção dos segmentos de interesse, empregando-se o VRMesh editing widget, as ramificações abaixo da bifurcação ilíaca foram retiradas. A distância entre os arquivos foi representada como um intervalo de distâncias em cores e uma tolerância aceitável entre as malhas foi ajustada para ± 10 mm (Figura 6). A sobreposição das superfícies das malhas foi verificada quanto à precisão utilizando as ferramentas de análise de comparação no VRMesh, Analyze e Inspection. 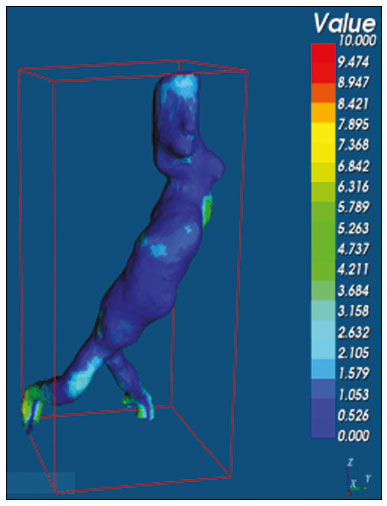 Figura 6. Visão anterior do modelo e análise das diferenças entre as distâncias, representadas em intervalo de cores, utilizando o software VRMesh. Finalizado o processo, o arquivo foi exportado para o Netfabb, que faz as aferições de volume, área e altura de maneira automática para cada modelo inserido no sistema. RESULTADOS A diferença das distâncias entre as superfícies do mesmo segmento nos dois modelos analisados – angiotomografia 3D e modelo impresso 3D – foi definida no intervalo entre 0 e 10 mm, calculado no software VRMesh e representado como um mapa de cores entre azul e vermelho. Valores acima do 6,31 mm foram demonstrados pela cor vermelha e encontrados em alguns pontos da região distal e das regiões de colagem do biomodelo, conforme mostrado na Figura 6. Diante dos quatro modelos obtidos, observa-se que ao se excluir as extremidades distais dos biomodelos, os valores das distâncias entre modelos são inferiores a 6,31 mm e representados pela cor azul, conforme demonstrado na Figura 6 e na Tabela 1. Tais valores não consideraram a necessidade da ampliação de 1 mm na espessura dos modelos, em razão de restrições técnicas de impressão 3D disponíveis (Cliever). Os resultados das volumetrias dos modelos no software Netfabb revelaram discrepância entre 3% e 12%, e a diferença entre as áreas foi de 10% a 16%. DISCUSSÃO A última década assistiu a um crescimento notável no uso da impressão 3D na medicina. O crescimento foi impulsionado pelo desenvolvimento de estudos de imagem de alta resolução, unindo-se ao rápido desenvolvimento das técnicas de impressão 3D e ao desenvolvimento de novos materiais de impressão. Esses avanços resultaram em redução nos custos e criação de modelos médicos de alta resolução. A evolução dessa técnica disruptiva tem revolucionado a prática médica. O alinhamento do modelo em STL de origem (angiotomografia pré-operatória) com a resultante da varredura do modelo impresso 3D pode ser complexo de se obter em determinados cenários. Embora existam ferramentas de alinhamento automático em alguns softwares, tais como o VRMesh, a precisão do alinhamento deve ser cuidadosamente avaliada e o ajuste manual pode ser necessário. O desalinhamento resultará em erros no processo de avaliação qualitativa. Além disso, a modalidade da imagem apropriada e os protocolos de imagem devem ser usados. Esse método também apresenta desafios para modelos construídos com materiais flexíveis. Como esses modelos podem se deformar após serem impressos, a garantia de que o modelo mantenha a sua forma original durante a digitalização pode não ser preservada. Para este cenário, é útil construir estruturas de apoio durante a construção do modelo para suporte deste, a fim de que ele retenha a forma original que possui no paciente. Atualmente, os biomodelos possuem diversas aplicações na prática médica. Dessa forma, espera-se que as réplicas tenham mensuração métrica e volumétrica fidedignas à anatomia do paciente. O uso do biomodelo torna-se importante principalmente em doenças com alterações anatômicas que variam de indivíduo a indivíduo, como no aneurisma de aorta. As imagens da angiotomografia permitem visualização 3D virtual da doença em questão. Porém, com o biomodelo impresso, o cirurgião pode realizar planejamento pré-operatório mais minucioso, analisando os detalhes de maneira visual e tátil e, por meio do manuseio, auxiliar na simulação dos casos complexos. Estudos recentes demonstram que entre os principais benefícios do modelo 3D impresso estão a superioridade no planejamento pré-operatório, melhor entendimento do paciente sobre o procedimento e menor tempo cirúrgico(10,11). A utilização de diferentes métodos de imagem pode resultar em divergências no resultado dos valores aferidos (por exemplo, aneurismas diagnosticados pela TC têm diâmetro geralmente 2 mm maior que o medido pela ultrassonografia)(16). Nota-se que na presente pesquisa a utilização dos biomodelos para mensuração de segmento de AAA produziu resultados semelhantes, exceto na extremidade distal. Isto provavelmente se deve a eventuais erros de retirada manual dos pilares de sustentação, colagem manual e encaixe no momento da composição do modelo final. Essa discrepância observada em alguns biomodelos nada influenciaria no planejamento pré-operatório de AAA, podendo ser desconsiderada, pois tais erros localizam-se abaixo da bifurcação ilíaca. Apesar do reduzido número de pacientes envolvidos no presente trabalho e existirem diversas etapas manuais, as diferenças de área e volume obtidas com o software Netfabb não ultrapassaram 12% e 16%, respectivamente. Estudos consideram dentro do limite de normalidade uma variação nas medidas de diâmetro intraobservador e interobservador de imagens da TC de 2 a 5 mm, e alteração significativa diferenças maiores que 5 mm(17). Não há na literatura estudos relacionados a impressão 3D de biomodelos com o objetivo de determinar a discrepância mínima, média e máxima entre dois objetos. CONCLUSÃO As inovações tecnológicas recentes aplicadas em saúde – por exemplo, as técnicas minimamente invasivas associadas ao maior bem-estar do paciente – estão definindo o caminho a seguir. Em razão disso, faz-se necessário delimitar as potencialidades e fragilidades da impressão 3D. Nesta pesquisa concluiu-se que, embora os biomodelos sejam compatíveis nas medidas métricas e volumétricas com as imagens 3D da angiotomografia do paciente, esses modelos não podem ser utilizados para planejamento pré-operatório de aneurismectomia de aorta abdominal, pelo fato de ser necessária a aferição dos trombos murais. Um dos principais desafios científicos da técnica de manufatura aditiva para representação de aneurisma de aorta é a viabilização da impressão dos trombos murais, separando-os dos órgãos adjacentes de mesma densidade na escala de cinza da TC. A partir disso, admite-se a necessidade de estudos com maiores casuísticas para avaliar se o biomodelo representa réplica real da anatomia humana, podendo ser utilizado como planejamento cirúrgico, além da educação de médicos e residentes em formação. REFERÊNCIAS 1. Projeto Diretrizes SBACV. Aneurismas da aorta abdominal: diagnóstico e tratamento. SBACV; 2015. 2. Lederle FA, Johnson GR, Wilson SE, et al. Prevalence and associations of abdominal aortic aneurysm detected through screening. Aneurysm Detection and Management (ADAM) Veterans Affairs Cooperative Study Group. Ann Intern Med. 1997;126:441–9. 3. Pleumeekers HJ, Hoes AW, van der Does E, et al. Aneurysms of the abdominal aorta in older adults. The Rotterdam study. Am J Epidemiol. 1995;142:1291–9. 4. Lederle FA, Johnson GR, Wilson SE, et al. The aneurysm detection and management study screening program: validation cohort and final results. Aneurysm Detection and Management Veterans Affairs Cooperative Study Investigators. Arch Intern Med. 2000;160:1425–30. 5. Singh K, Bønaa KH, Jacobsen BK, et al. Prevalence of and risk factors for abdominal aortic aneurysms in a population-based study: the Tromsø study. Am J Epidemiol. 2001:154:236–44. 6. Johansen K, Koepsell T. Familial tendency for abdominal aortic aneurysms. JAMA. 1986;256:1934–6. 7. Rahimi SA, Rowe VL, Annambhotla S, et at. Abdominal aortic aneurysm. [cited 2018 April 18]. Available from: http://emedicine.medscape.com/artcle/1979501-overview. 8. Paravastu SCV, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database of Systematic Reviews. 2014;(1):CD004178. 9. Chaikof EL, Fillinger MF, Matsumura JS, et al. Identifying and grading factors that modify the outcome of endovascular aortic aneurysm repair. J Vasc Surg. 2002:35:1061–6. 10. Zheng YX, Yu DF, Zhao JG, et al. 3D printout models vs. 3D-rendered images: which is better for preoperative planning? J Surg Educ. 2016;73:518–23. 11. Hoang D, Perrault D, Stevanovic M, et al. Surgical applications of three-dimensional printing: a review of the current literature & how to get started. Ann Tansl Med. 2016;4:456. 12. Mehra P, Miner J, D’Innocenzo R, et al. Use of 3-d stereolithographic models in oral and maxillofacial surgery. J Maxillofac Oral Surg. 2011;10:6–13. 13. Hakansson A, Rantatalo M, Hansen T, et al. Patient specific biomodel of the whole aorta – the importance of calcified plaque removal. Vasa. 2011;40:453–9. 14. Cliever Tecnologia. Impressoras. [cited 2018 July 4]. Available from: https://www.cliever.com/produtos?categoria=impressoras. 15. Custompart.net. Additive fabrication. [cited 2019 June 21]. Available from: http://www.custompartnet.com/wu/additive-fabrication. 16. Guirguis-Blake JM, Beil TL, Sun X, et al. Primary care screening for abdominal aortic aneurysm: a systematic evidence review for the U.S. Preventive Services Task Force [Internet]. Rockville, MD: Agency for Healthcare Research and Quality (US); 2014 Jan. 17. Chaikof EL, Blankensteijn JD, Harris PL, et al. Reporting standards for endovascular aortic aneurysm repair. J Vasc Surg. 2002;35:1048–60. Universidade Federal de Santa Maria (UFSM), Santa Maria, RS, Brasil a. https://orcid.org/0000-0001-8685-1209 b. https://orcid.org/0000-0003-1883-3046 c. https://orcid.org/0000-0002-6513-2552 Correspondência: Dra. Giovanna Ricarte Granja Gomes Universidade Federal de Santa Maria Avenida Roraima, 1000, prédio 26, sala 1430, Camobi Santa Maria, RS, Brasil, 97105-900 E-mail: gi.ricartes@hotmail.com Recebido para publicação em 14/10/2019 Aceito, após revisão, em 29/1/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554