Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 54 nº 1 - Jan. / Fev. of 2021
Vol. 54 nº 1 - Jan. / Fev. of 2021
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Gustavo Lopes Gomes de Siqueira1,a; Robson Pequeno de Sousa2,b; Ricardo Alves de Olinda2,c; Carlos Alberto Engelhorn3,d; André Luiz Siqueira da Silva1,e; Juliana Gonçalves Almeida1,f |
|
|
Descritores: Diagnóstico por computador; Rim/diagnóstico por imagem; Ultrassonografia/métodos; Ultrassonografia de intervenção/métodos; Processamento de imagem assistida por computador/métodos. |
|
|
Resumo: INTRODUÇÃO
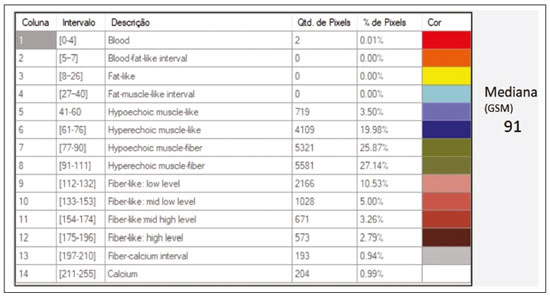
A avaliação do parênquima renal continua sendo subjetiva à comparação da sua ecotextura em relação ao fígado, sem parâmetros específicos com relação à, por exemplo, porcentagem de pixels(1). A acuidade visual humana só consegue perceber de 16 a 32 tons de cinza. O número de tons de cinza comum numa ultrassonografia (US) é de 256, portanto, 16 vezes maior(2). A análise computadorizada de tons de cinza pode vir a ajudar em sutis mudanças que determinada estrutura apresenta ao longo do tempo, visíveis ao processamento de tons de cinza, mas imperceptíveis precocemente pelo sistema visual humano(3), transformando a imagem em um arquivo tridimensional, sendo o brilho representado como terceira dimensão(4). A técnica está baseada em dois parâmetros: a) quantificação das porcentagens específicas de tons de cinza em intervalos preestabelecidos (intervalos de brilhos específicos – Figura 1); b) colorização artificial da imagem, melhorando a percepção do sistema visual humano à imagem(5) (Figura 2). Parte importante dessa avaliação é a mediana de escala de cinza (gray-scale median – GSM), que divide o número de pixels da área selecionada pela metade: 50% dos pixels com amplitude maior e 50% dos pixels com amplitude menor. É o valor que divide uma amostra ao meio, sendo diferente em relação à média e não sofre influência com relação aos valores mais à direita ou à esquerda. Por não sofrer tanta influência, a mediana em alguns estudos estatísticos é mais importante que a média. 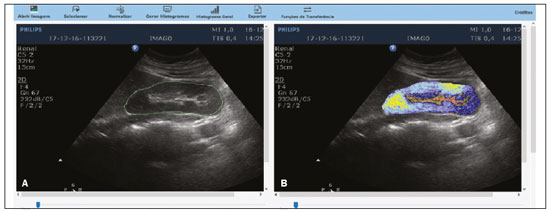 Figura 2. Protótipo de software (CAD). Imagem demonstrando segmentação manual do contorno renal (A) e sua pseudocolorização (B). Esse tipo de avaliação computadorizada dos tons de cinza já foi muito utilizada em placa aterosclerótica carotídea(6,7), no qual um valor de GSM menor que 25 indica risco maior de acidente vascular cerebral. Os intervalos de tons de cinza foram redimensionados para melhorar a uniformidade entre as imagens e torná-los menos dependentes da atenuação dos tecidos(4,5,7) (Figura 1). A porcentagem de tons de cinza na área renal delimitada foi estudada em 14 intervalos e GSM. O benefício dessa avaliação seria, por exemplo, no acompanhamento ultrassonográfico de pacientes com transplante renal, em que se utilizam parâmetros espectrais, mas antes destes modificarem, muito provavelmente, num caso de rejeição do enxerto, o parênquima e sua ecotextura mudaram antes, e talvez nossa acuidade visual, com capacidade menor que a máquina, possa não ter percebido. Já foram descritos os intervalos de tons de cinza e da GSM em pacientes normais(4), utilizando os parâmetros já citados por artigos de análise de tons de cinza de placa aterosclerótica carotídea(2,7–9), em que a imagem é “padronizada” com relação a dois pontos: a adventícia passa a ser o valor de pixel 200 e dentro do vaso passa a ser 0 (zero), alterando linearmente todos os outros valores, numa tentativa de padronizar imagens obtidas por diferentes examinadores e diferentes aparelhos. Em análise renal prévia, foi utilizada a fáscia muscular posterior como o valor 200 e o nível mais preto da imagem como 0 (zero)(4,5,10). É descrito um caso de transplante renal em que a GSM e os intervalos de tons de cinza foram modificando à medida que um paciente entrava em rejeição aguda do enxerto(10). O principal problema é que a utilização de diferentes aparelhos por diferentes examinadores pode gerar tons de cinza totalmente diversos. Para compensar esse fato, os autores utilizaram o já citado método de “padronização”(2,4,5,7–9), mas deve-se levar em conta que a avaliação renal é muito diferente da avaliação carotídea, em que essa apresenta-se superficial e de fácil visualização. Restamos com o questionamento se podemos avaliar tons de cinza de imagens renais realizadas por diferentes aparelhos e diferentes examinadores. MATERIAIS E MÉTODOS Este é um estudo transversal, observacional, descritivo com componente analítico, autorizado pelo Comitê de Ética da Universidade Estadual da Paraíba (CAEE nº 86802617.5.0000.5187, parecer nº 2.954.650). Foram incluídos no estudo 24 voluntários, que assinaram termo de consentimento livre e esclarecido. Foi desenvolvido um protótipo de software com a equipe de engenharia da computação, em Windows Form na IDE Visual Studio Community 2015 (versão 14.0) utilizando a linguagem C++. Existe a possibilidade de “padronização” da imagem de maneira adaptada, descrita em outros trabalhos(4,5,10), estabilizando os pixels em relação a apenas um ponto (demais trabalhos usavam dois pontos), que será a fáscia muscular posterior. Após o comando de zoom e segmentação manual da fáscia, o operador clica no comando normatização (padronização) e automaticamente a mediana da área segmentada passa para 200. A alteração matemática ocorre não somente na área segmentada da fáscia muscular, mas em toda a imagem, alterando todos os pixels da imagem, de acordo com a alteração da fáscia segmentada. A alteração matemática em torno da variação dos pixels vai ocorrer em função de um fator de normatização. O fator de normatização Fn é definido pela equação 1: 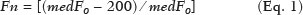 em que medF0 é a medida da GSM da fáscia selecionada. Após o cálculo desse fator, foi utilizada a função de transferência definida pela equação 2, para normalizar a imagem de acordo com a GSM da fáscia da região selecionada. Para aplicar a equação 2, os seguintes critérios devem ser observados: 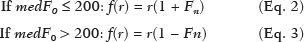 em que r é o nível de intensidade do pixel da imagem. Exemplificado o uso da normalização da imagem: se medF0 = 220, o fator de normalização será calculado de acordo com a equação 1: 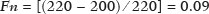 Para normalizar a imagem original utiliza-se a equação 3. Supondo-se que um nível de intensidade de pixel qualquer da imagem original seja 50, de acordo com a equação 3 o pixel normalizado assumirá o seguinte valor: f(50) = 50(1 – 0,09) = 46. Além da possibilidade de normatização da imagem, o software segue o padrão ouro atual de segmentação renal em imagem ultrassonográfica, que continua sendo o manual(11,12). O protótipo de diagnóstico auxiliado por computador (computer aided diagnosis – CAD) faz uma leitura da quantidade em porcentagem de pixels contida na imagem segmentada, e utilizando 14 intervalos (Figura 1) pseudocoloriza a imagem (Figura 2). Os 24 participantes foram submetidos a US de rim direito e esquerdo, realizada por cinco ultrassonografistas com título de especialista denominados médicos 1 a 5. Os médicos 1, 2 e 3 utilizaram a mesma máquina (Philips HD11 XE; Philips Healthcare, Eindhoven, Holanda) com transdutor convexo em banda com frequência de 3–7 MHz. O médico 4 utilizou aparelho GE Logiq S7 (GE Healthcare, Illinois, EUA) com três anos de uso, com transdutor convexo em banda de 6–9 MHz. O médico 5 utilizou outra máquina GE Logiq S7 (GE Healthcare) com dois anos de uso, com transdutor convexo em banda de 6–9 MHz. O exame renal foi realizado em posição de decúbito lateral, por dois métodos: um chamado de aleatório, usando preset habitual da máquina para exame renal, em que o médico manipulava o ganho, o time gain control (TGC) e todos os outros fatores, e esta imagem foi chamada de amostra. O outro método, chamado de padronizado, utiliza uma imagem “controle”, na qual foi criado um preset em que era fixado o dynamic range em torno de 70–80 e o ganho em 100, não podendo modificar os parâmetros descritos, estabilizando o TGC vertical na área renal, gerando a melhor imagem possível, chamada de controle(4,6–10). Após salvamento no aparelho – total de 480 imagens, sendo 240 de cada (amostra e controle) –, essas imagens foram transferidas do aparelho de ultrassom para o computador, em extensão .bmp, resolução de 800 × 600 pixels. Cada imagem amostra ou controle, do rim direito ou esquerdo, foi submetida a análise no software criado, produzindo o que chamamos de imagem aleatória e imagem padronizada, conforme procedimento a seguir: – segmentação manual do contorno renal; – análise com obtenção da GSM e dos tons de cinza; – obtenção dos 14 intervalos descritos na Figura 1; – pseudocolorização da imagem selecionada (Figura 2). Procedimento posterior para criação da imagem “padronizada/normatizada” foi realizado nas imagens aleatória e padronizada, conforme segue: – pré-processamento com padronização/normatização das imagens após escolha de um ponto fixo que sirva como referência para o número 200 na escala de cinza, tendo sido utilizada a fáscia(4,5,10); – segmentação manual do contorno renal; – análise com obtenção da GSM e dos tons de cinza na imagem selecionada; – obtenção dos 14 intervalos descritos (Figura 1); – pseudocolorização da imagem selecionada (Figura 2). Dessa forma, originaram-se imagens chamadas agora de aleatória normatizada e padronizada normatizada, no total de 240 cada uma. Foram excluídas imagens com dificuldade de visualização da fáscia e qualquer alteração renal. Com base nesses critérios, foram excluídas 41 imagens, sendo 20 de uma paciente que apresentava cálculo renal coraliforme (extenso) no rim esquerdo, e 21 imagens, de três pacientes, que não apresentavam definição perfeita para submetê-las ao procedimento de padronização. Após exclusão das imagens citadas, resultaram 919 imagens para a realização do estudo: 231 aleatórias, 229 padronizadas, 230 aleatórias normatizadas e 229 padronizadas normatizadas. Análise estatística Os dados foram armazenados em planilha eletrônica de dados Microsoft Excel versão 2016. Após serem organizados, foram apresentadas as principais estatísticas descritivas. A GSM foi calculada e analisada especificamente. Porcentagens dos dados foram interpretadas como uma variável contínua. Média, desvio-padrão, mínimo e valores máximos foram calculados com base em estatísticas descritivas analisadas pelo software estatístico R (The R Foundation, Viena, Áustria). Para avaliar a adequação da modelagem estatística proposta para descrever as observações, foram verificadas a normalidade e independência das variáveis pelo teste de normalidade de Anderson-Darling. Com este teste, buscaram-se condições teóricas para realização das análises estatísticas via técnica univariada. Para verificar possíveis diferenças entre os fatores médicos e imagens, foi usado o teste não paramétrico de Kruskal-Wallis, análogo ao teste F da análise de variância (ANOVA). Na sequência, para verificar diferenças entre as medianas, foi utilizado o teste de Wilcoxon-Mann-Whitney para amostras independentes. Em todos os testes foi adotado nível de significância de 5% (p < 0,05), analisados com o auxílio do software R. Foram elaborado dois cenários: cenário 1 – análise entre os cinco médicos e os tipos de máquinas, avaliando a possibilidade de comparar as imagens produzidas por diferentes aparelhos e médicos; cenário 2 – comparação entre os três médicos que utilizaram a mesma máquina (médicos 1, 2 e 3) e os quatro tipos de imagens. RESULTADOS Cenário 1 – Foram comparados os cinco tipos de médicos, em relação à variável GSM, por meio do teste de Kruskall-Wallis (ANOVA), em que se observou haver diferenças significativas (p < 2.2e-16). Para determinar quem difere entre si, foi aplicado o teste das medianas de Wilcoxon-Mann-Whitney para amostras independentes (Figura 3). 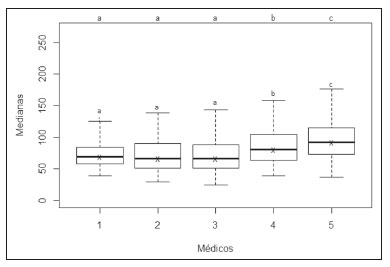 Figura 3. Análise univariada entre os cinco médicos utilizando a GSM como variável (p < 2.2e-16). Cenário 2 – Foi realizada comparação entre os médicos que utilizaram a mesma máquina (médicos 1, 2 e 3) e os quatro diferentes tipos de imagens (aleatórias, padronizadas, aleatórias normatizadas e padronizadas normatizadas). Foram utilizadas como variáveis para comparação as GSMs e os 14 intervalos de brilho. Imagem aleatória Foi realizada análise pelo teste de Kruskall-Wallis (ANOVA), para verificar possíveis diferenças entre os níveis do fator médico (médicos 1, 2 e 3), dentro da imagem aleatória, utilizando como variável a GSM. Obteve-se diferença estatisticamente significante (p = 0,006098) na comparação entre os médicos. Para verificar qual deles diferiu, foi utilizado o teste Wilcoxon-Mann-Whitney, comparando os médicos 1, 2 e 3 com as variáveis GSMs e os 14 intervalos da imagem aleatória, obtendo diferença estatística em 11 intervalos e da GSM entre os médicos 1 e 2, assim como em 5 intervalos e na GSM entre os médicos 1 e 3. Curiosamente, não houve diferença estatística entre os médicos 2 e 3. Imagem aleatória normatizada Este tipo de imagem é a imagem aleatória que passou pelo processo de normatização. Foi feita análise pelo teste de Kruskall-Wallis (ANOVA) para verificar possíveis diferenças entre os níveis do fator médico (médicos 1, 2 e 3), dentro da imagem aleatória normatizada, utilizando como variável a GSM. Encontrou-se que as GSMs não diferiram na comparação entre os médicos (p = 0,08115). Para verificar existência de alguma diferença das GSMs e dos 14 intervalos das imagens aleatórias normatizadas utilizadas pelos médicos 1, 2 e 3, empregou-se o teste Wilcoxon-Mann-Whitney, obtendo diferença estatística em quatro intervalos (excluindo a GSM) entre os médicos 1 e 2, assim como em dois intervalos entre os médicos 1 e 3. Não houve diferença entre os médicos 2 e 3. Imagem padronizada Este é o tipo de aquisição de imagem mais utilizado nos artigos(4,5,7–10). A comparação dos 14 intervalos e da GSM é muito importante na descrição da equivalência das imagens. Foi realizada análise pelo teste de Kruskall- Wallis (ANOVA) para verificar possíveis diferenças entre os níveis do fator médico (médicos 1, 2 e 3), dentro da imagem padronizada, utilizando como variável a GSM. Obteve-se que as GSMs não diferiram na comparação entre os médicos (p = 0,9472). Para verificar se existia alguma diferença das GSMs e dos 14 intervalos das imagens padronizadas, utilizou-se o teste Wilcoxon-Mann- Whitney, obtendo diferença estatística somente em um intervalo entre os médicos 1 e 3. Imagem padronizada normatizada Esta é a imagem padronizada após passar pelo procedimento de normatização, transformando-se em imagem padronizada normatizada. Foi realizada análise pelo teste de Kruskall-Wallis (ANOVA) para verificar possíveis diferenças entre os níveis do fator médico (médicos 1, 2 e 3), dentro da imagem padronizada normatizada, utilizando como variável a GSM. Obteve-se que as GSMs não diferiram na comparação entre os médicos (p = 0,7319). Para verificar se existia alguma diferença das GSMs e dos 14 intervalos das imagens padronizadas normatizadas, geradas pelos médicos 1, 2 e 3, utilizou-se o teste Wilcoxon-Mann-Whitney. Não houve diferença estatística entre os intervalos obtidos. DISCUSSÃO Vários autores já concluíram que o processamento e análise da imagem ultrassonográfica se tornou totalmente dependente do examinador(1). Numa tentativa de analisar tons de cinza em placas ateroscleróticas, foi demonstrado que os resultados eram dissonantes para indicar risco de acidente vascular isquêmico(13). Com o procedimento de normatização, foi exposto um método que eliminava em parte a variabilidade da imagem ultrassonográfica em relação a profissionais diferentes obtendo imagens diferentes(2,7–9). Mas isso foi para placa aterosclerótica em imagens carotídeas, que são obtidas com relativa facilidade por sua superficialidade. Análise de tons de cinza em imagens ultrassonográficas renais já havia sido publicada, utilizando o mesmo princípio de normatização, adaptado para imagens renais(4,5,10). Porém, a principal pergunta sobre a avaliação de imagens renais é se elas podem ser comparadas entre profissionais diferentes e máquinas ultrassonográficas diferentes. No presente trabalho foram utilizados quatro tipos de imagens, a depender se padronizada ou normatizada. Como resultado, foi encontrado que a variável GSM foi diferente entre o conjunto de médicos que utilizaram a mesma máquina (médicos 1, 2 e 3) em relação aos que utilizaram outro tipo de máquina (médicos 4 e 5). Isto leva a sugerir que não se pode comparar imagens de máquinas de US diferentes, pois a variabilidade é estatisticamente significante. Apesar desse resultado, não se pode certificar que essa análise não possa ser realizada, pois só foi comparado um aspecto (variável), e não temos resposta para o resultado de diferença nos valores dos médicos 4 e 5 que utilizaram o mesmo modelo de máquina, mas diferentes números de série (diferença de uso em um ano). Nenhum artigo comparou imagens normatizadas de diferentes máquinas. Com os resultados, sugere-se utilizar a mesma máquina para uma melhor comparação e análise de tons de cinza. Resta o questionamento se há a possibilidade de comparar imagens renais ultrassonográficas de profissionais diferentes numa mesma máquina. Com a imagem aleatória e sua variante após normatização – imagem aleatória normatizada, em que não foi padronizado nenhum aspecto físico da imagem –, os resultados demonstraram a total variabilidade entre as obtidas por diferentes profissionais, impossibilitando a utilização desses tipos de imagens para comparação. Na imagem padronizada, com a variável mais importante (GSM) não houve alteração significativa. Mas um intervalo marginal entre os médicos 1 e 3 demonstrou diferença estatística. A imagem padronizada normatizada não mostrou nenhuma diferença estatística entre as imagens obtidas pelos três profissionais diferentes, demonstrando a hipótese de equivalência das imagens e homogeneização após o procedimento de normatização. Este tipo de imagem foi utilizado na maioria dos mais importantes trabalhos descritos na análise de tons de cinza(2,4–6,8–10). Propõe-se assim um CAD para análise de imagens renais, utilizando a imagem padronizada e normatizada. A maioria dos artigos para CAD em imagem renal ultrassonográfica é em segmentação de imagens. Um dos poucos utilizados em avaliação renal é para identificação de cálculos renais(14). Revisão do panorama atual no desenvolvimento de novas técnicas no sentido de avaliação computacional de imagens ultrassonográficas renais indica que a literatura é pobre nesse aspecto(15). A imagem renal ultrassonográfica continua, mesmo após todos os avanços tecnológicos, totalmente dependente do examinador. É unânime a opinião de que o desenvolvimento de CADs para imagens renais é diminuto e necessita de avanços. A elastografia renal pode ser um futuro nessa avaliação(16,17). No período desde sua invenção (1960) até começo do século 21, apesar de todo avanço, os CADs permaneceram seguindo como “segunda opinião”, numa ajuda quanto a uma decisão mais rápida por parte do profissional de saúde. Pesquisas recentes sugerem uma mudança radical nas principais funções dos CADs, passando de meros ajudantes para sistemas mais complexos, com capacidade de conhecimento e aprendizagem, utilizando não somente imagens, mas também dados informativos sobre o quadro do paciente em questão e recomendando uma tomada de decisão mais precisa(18). CONCLUSÃO A utilização de uma mesma máquina para produzir as imagens sugere maior credibilidade nos resultados. Como não houve randomização em relação aos vários tipos de máquinas e médicos, não se pode afirmar a impossibilidade de comparação entre imagens produzidas por diferentes máquinas. No procedimento de aquisição de imagens renais, sugere-se a padronização de aspectos físicos modificáveis da imagem (TGC, ganho total e dynamic range, entre outros), e após a aquisição, a submissão de tais imagens a um procedimento de normatização. Como a literatura é escassa em análise computadorizada de imagem ultrassonográfica renal, seria interessante um CAD que utilizasse como escopo a variação de tons de cinza. Agradecimento Ao laboratório do Núcleo de Tecnologia em Saúde da Universidade Estadual da Paraíba (Nutes-UEPB), pelo apoio na realização deste trabalho. REFERÊNCIAS 1. Faubel S, Patel NU, Lockhart ME, et al. Renal relevant radiology: use of ultrasonography in patients with AKI. Clin J Am Soc Nephrol. 2014;9:382–94. 2. Lal BK, Hobson RW 2nd, Pappas PJ, et al. Pixel distribution analysis of B-mode ultrasound scan images predicts histologic features of atherosclerotic carotid plaques. J Vasc Surg. 2002;35:1210–7. 3. Beach KW, Jong JM, Paun M, et al. Principles and instruments of diagnostic ultrasound and Doppler ultrasound. In: AbuRahma AF, Bergan JJ, editors. Noninvasive vascular diagnosis. London: Springer; 2000. p. 25–48. 4. Valiente Engelhorn ALD, Engelhorn CA, Salles-Cunha SX, et al. Ultrasound tissue characterization of the normal kidney. Ultrasound Q. 2012;28:275–80. 5. Valiente Engelhorn ALD, Engelhorn CA, Salles-Cunha SX, et al. Ultrasonographic tissue characterization of kidneys in patients with unilateral renal artery stenosis. J Vasc Ultrasound. 2016;40:70–5. 6. Deftereos S, Giannopoulos G, Kossyvakis C, et al. Virtual histology. Hellenic J Cardiol. 2010;51:235–44. 7. Lal BK, Hobson RW 2nd, Hameed M, et al. Noninvasive identification of the unstable carotid plaque. Ann Vasc Surg. 2006;20:167–74. 8. Griffin M, Nicolaides A, Kyriacou E. Normalisation of ultrasonic images of atherosclerotic plaques and reproducibility of grey scale median using dedicated software. Int Angiol. 2007;26:372–7. 9. Elatrozy T, Nicolaides A, Tegos T, et al. The effect of B-mode ultrasonic image standardisation on the echodensity of symptomatic and asymptomatic carotid bifurcation plaques. Int Angiol. 1998;17: 179–86. 10. Valiente Engelhorn ALD, Engelhorn CA, Salles-Cunha S. Initial evaluation of virtual histology ultrasonographic techniques applied to a case of renal transplant. J Vasc Ultrasound. 2015;39:142–4. 11. Cerrolaza JJ, Safdar N, Biggs E, et al. Renal segmentation from 3D ultrasound via fuzzy appearance models and patient-specific alpha shapes. IEEE Trans Med Imaging. 2016;35:2393–402. 12. Yang X, Schuster D, Master V, et al. Automatic 3D segmentation of ultrasound images using atlas registration and statistical texture prior. Proc SPIE Int Soc Opt Eng. 2011;7964:796432. 13. el-Barghouty N, Nicolaides A, Bahal V, et al. The identification of the high risk carotid plaque. Eur J Vasc Endovasc Surg. 1996;11:470–8. 14. Tamilselvi PR, Thangaraj P. Computer aided diagnosis system for stone detection and early detection of kidney stones. Journal of Computer Science. 2011;7:250–4. 15. Subramanya MB, Kumar V, Mukherjee S, et al. Classification of normal and medical renal disease using B-mode ultrasound images. In: 2015 2nd International Conference on Computing for Sustainable Global Development (INDIACom). New Delhi, India; 2015. p. 1914–8. 16. Grenier N, Gennisson JL, Cornelis F, et al. Renal ultrasound elastography. Diagn Interv Imaging. 2013;94:545–50. 17. Grenier N, Poulain S, Lepreux S, et al. Quantitative elastography of renal transplants using supersonic shear imaging: a pilot study. Eur Radiol. 2012;22:2138–46. 18. Takahashi R, Kajikawa Y. Computer-aided diagnosis: a survey with bibliometric analysis. Int J Med Inform. 2017;101:58–67. 1. Faculdade de Ciências Médicas de Campina Grande (Unifacisa), Campina Grande, PB, Brasil 2. Universidade Estadual da Paraíba (UEPB), Campina Grande, PB, Brasil 3. Pontifícia Universidade Católica do Paraná (PUCPR), Curitiba, PR, Brasil a. https://orcid.org/0000-0002-3832-0187 b. https://orcid.org/0000-0001-8447-0699 c. https://orcid.org/0000-0002-0509-8428 d. https://orcid.org/0000-0002-8760-2279 e. https://orcid.org/0000-0002-3166-9554 f. https://orcid.org/0000-0001-9735-6115 Correspondência: Dr. Gustavo Lopes Gomes de Siqueira Rua Desembargador Trindade, 327, ap. 2501, Centro Campina Grande, PB, Brasil, 58400-260 E-mail: gustavomed@yahoo.com Recebido para publicação em 14/12/2019 Aceito, após revisão, em 17/1/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554