Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 6 - Nov. / Dez. of 2020
Vol. 53 nº 6 - Nov. / Dez. of 2020
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Antonio Cordeiro da Silva Filhoa; Tamara Oliveira Rochab; Jorge Elias Jrc; Marcus Vinicius de Castro Barrosd; Alfredo Ribeiro Silvae; Rodolfo Borges dos Reisf; Valdair Francisco Mugliag |
|
|
Descritores: Neoplasia da próstata; Difusão; Ressonância magnética; Estadiamento de neoplasias. |
|
|
Resumo: INTRODUÇÃO
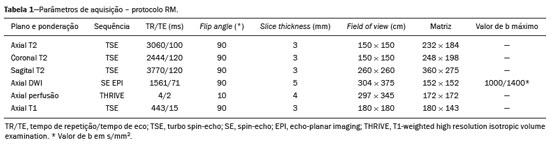
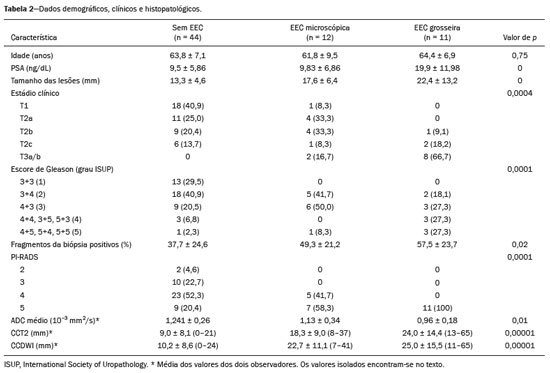
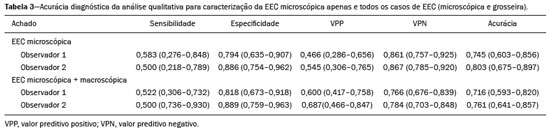
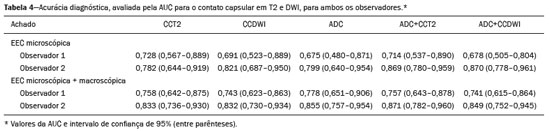
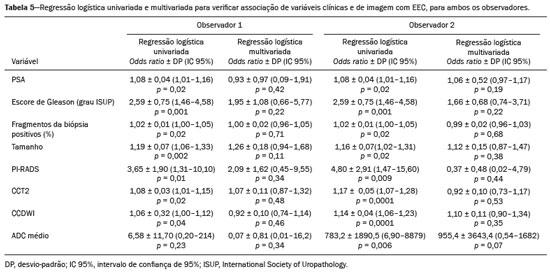
O adenocarcinoma de próstata é o segundo tumor em incidência e mortalidade entre as neoplasias malignas masculinas, superado apenas pelo câncer de pele não melanoma em incidência e pelo câncer de pulmão em número de óbitos(1). Para o tratamento do câncer de próstata, a prostatectomia radical é a modalidade de escolha, com excelente sobrevida específica para os cânceres localizados(2). Este procedimento é realizado com objetivos curativos, porém, também visando à preservação do feixe neurovascular para se evitar a disfunção erétil e a incontinência urinária, o que é conhecido como trifeta (continência, potência e controle oncológico), uma vez que estas complicações pós-operatórias prejudicam a qualidade de vida do paciente(3). A extensão extracapsular (EEC) das neoplasias de próstata, além de importante fator prognóstico, por estar associada a aumento do risco de recorrência bioquímica no pós-operatório, quando presente(4) também tem importantes implicações terapêuticas, uma vez que uma ressecção cirúrgica mais ampla está indicada para se reduzir a chance de margem cirúrgica positiva, porém, com aumento do risco de lesão do feixe neurovascular(4,5) quando a EEC se dá no entorno desta estrutura. Por este motivo, a avaliação pré-operatória do risco de EEC é muito importante, pois permite um melhor planejamento terapêutico, aprimorando a tomada de decisões em relação ao controle do câncer e à manutenção da função erétil e miccional. A ressonância magnética multiparamétrica (mpRM) de próstata tem se tornado uma ferramenta muito importante não só na detecção, mas também no estadiamento do câncer de próstata(6). Habitualmente, o estadiamento por imagem é realizado pela avaliação morfológica das imagens ponderadas em T2, nas quais é possível observar extensões grosseiras, além da cápsula, porém, também são considerados achados suspeitos para extensão microscópica, como os casos que apresentam amplo contato da neoplasia com a cápsula prostática(7). Com o advento dos novos recursos tecnológicos da RM, como a incorporação de métodos funcionais – imagens ponderadas em difusão (diffusion weighted imaging – DWI), estudo dinâmico com contraste e espectroscopia –, alguns estudos avaliaram o impacto desses métodos funcionais para predizer EEC microscópica(8–12). Recentemente, estudos avaliando a EEC passaram a incluir a avaliação das DWIs, um importante componente do estudo por mpRM(13). Rosenkrantz et al. registraram que o valor de corte para o contato capsular para predição de qualquer EEC, utilizando o mapa de coeficiente de difusão aparente (apparent diffusion coefficient – ADC), foi 7 mm, e para a ponderação T2 foi 6,0 mm. Já para a EEC não focal, seria de 7,0 mm para o mapa de ADC e 10,0 mm para imagens em T2. Esses valores teriam gerado bons resultados para a predição da EEC microscópica, com discreta perda de especificidade (14). Porém, os últimos valores de corte citados são divergentes da maioria dos trabalhos que abordaram o tema, que consideram valores de corte entre 12 mm e 18 mm para a ponderação T2(8,9,13). Como o ADC e seus parâmetros derivados, obtidos das DWIs, têm sido considerados potenciais biomarcadores da agressividade do câncer de próstata, apresentando correlação inversamente proporcional com o escore de Gleason, alguns trabalhos avaliaram a possibilidade de o ADC ser um fator independente na predição da EEC(15,16), ou ter valor adicional ao contato capsular. Ainda recentemente, o valor médio do ADC foi considerado útil para predizer EEC apenas quando a análise prévia pela ponderação T2 era duvidosa(17). Nas recomendações do sistema de estratificação de risco do American College of Radiology – Prostate Imaging Reporting and Data System (PI-RADS) versão 1 – havia uma estratificação de risco para predição da EEC para as lesões que apresentam PI-RADS final > 3(18), mas esta sugestão de estratificação foi abandonada já na versão 2.0(19). A análise da literatura mostra que há divergência em relação ao valor de corte para o contato capsular para predição da ECE microscópica, qual seria a melhor ponderação para ser obtido e se há um papel para a DWI na avaliação do contato capsular(9–13,15,17). O presente estudo foi desenvolvido com o objetivo de avaliar se as DWIs, mediante mensuração dos valores do ADC médio, podem melhorar a especificidade e sensibilidade da detecção da EEC microscópica do câncer de próstata, com base na medida do contato capsular, e qual a melhor sequência para obtenção do contato capsular – T2 ou DWI (mapa de ADC) – utilizando como padrão de referência o estudo histopatológico obtido após prostatectomias radicais. Secundariamente, foi avaliada a reprodutibilidade da definição da EEC, pelos parâmetros acima, entre observadores com distintos tempos de experiência na área. MATERIAIS E MÉTODOS O estudo foi aprovado pelo comitê de ética da instituição, sendo dispensado o termo de consentimento livre e esclarecido, em razão do seu caráter retrospectivo. Realizou-se busca no sistema de dados hospitalares de nossa instituição para identificação dos pacientes que realizaram mpRM de próstata e foram submetidos a prostatectomia radical, no período de janeiro de 2012 a dezembro de 2016. Foram incluídos os pacientes com câncer de próstata, consecutivos, sem tratamento prévio, submetidos a prostatectomia radical, que tiveram avaliação pré-operatória com RM de próstata, com intervalo máximo de até três meses até o procedimento cirúrgico. Os critérios de exclusão foram: protocolo mpRM de próstata incompleto; avaliação histopatológica incompleta; pacientes submetidos a tratamentos prévios. Dos 383 pacientes inicialmente selecionados, foram excluídos 98 por terem realizado somente a mpRM e não terem sido submetidos a tratamento cirúrgico, 26 por terem sido submetidos a tratamento prévio (cirurgia, radioterapia e/ou hormonioterapia) e 68 por RM com protocolo diferente do preconizado (30 pacientes) e/ou com imagens inadequadas por artefatos de suscetibilidade magnética (38 pacientes). Outros 112 pacientes foram excluídos por intervalo maior que três meses entre o exame de RM e a cirurgia e mais 12 por qualidade insatisfatória da peça cirúrgica. Portanto, foram incluídos para a análise 67 pacientes. A análise dos dados clínicos foi realizada por um médico radiologista da instituição, distinto dos que analisaram as imagens de RM, e os parâmetros analisados foram: idade, valor do antígeno prostático específico (PSA) sérico, estádio clínico, data da biópsia, data da realização da mpRM, data da cirurgia, intervalo entre a mpRM e a cirurgia e escore de Gleason/ISUP da prostatectomia. Os exames de RM da próstata foram realizados em aparelho Achieva 1,5 T de 16 canais (Philips Medical Systems, Best, Holanda). O protocolo adotado acha-se detalhado na Tabela 1. O visualizador utilizado foi o programa Osirix Versão 2.6 (Pixmeo Sàrl, Genebra, Suíça). Análise das imagens A análise das imagens foi realizada por dois médicos radiologistas (ACSF – observador 1; VFM – observador 2), independentemente, o primeiro com quatro anos de radiologia e dois anos de experiência em RM de próstata e o segundo com 14 anos de experiência em imagem prostática. Na avaliação qualitativa, os seguintes parâmetros foram avaliados: localização da lesão, descrita segundo o modelo preconizado pela classificação PI-RADS v2.1(20); medida do maior eixo da lesão; classificação PI-RADS para cada lesão (DWI, T2 e global). Em relação à avaliação da EEC, realizou-se, inicialmente, a avaliação qualitativa na ponderação T2, assim definida: 1 – sem contato com a cápsula; 2 – contato com a cápsula sem abaulamento; 3 – contato com a cápsula com abaulamento; 4 – EEC grosseira (visível, > 1,0 mm). Para efeitos de cálculo da acurácia diagnóstica da EEC pela análise qualitativa, os achados 1 e 2 foram considerados negativos, e os achados 3 e 4, positivos para EEC (micro e grosseira). Para a análise quantitativa, obteve-se a mensuração do contato capsular na ponderação T2 (CCT2), em mm (Figura 1A), mensuração do contato capsular no ADC, em mm (Figura 1B) e cálculo do ADC médio (10–3 mm2/s), feito com base nas medidas obtidas nos cortes que aparecem na lesão, utilizando regiões de interesse desenhadas manualmente pelos observadores, independentemente. 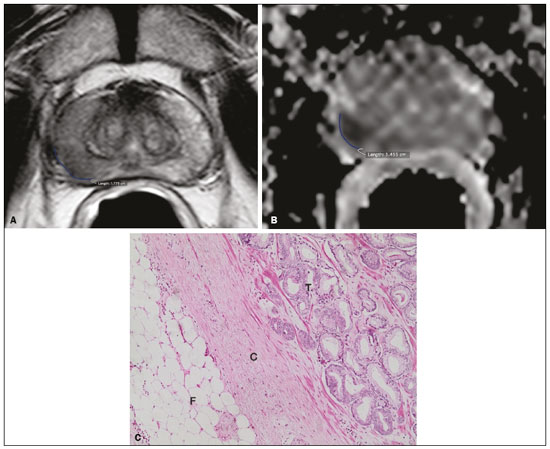 Figura 1. Homem, 63 anos, PSA = 7,51 ng/dL. Câncer de próstata Gleason 7 (4+3) em 6 de 12 fragmentos e estádio clínico 2a. A: Imagem axial em T2 demonstrando ausência de EEC macroscópica e contato capsular de 21,0 mm para o observador 1 e 17,8 mm para o observador 2 (linha azul). B: Mapa de ADC do paciente mostrando medida do contato capsular de 17,9 mm para o observador 1 e 14,5 mm para o observador 2 (linha azul). C: Corte histológico, coloração hematoxilina-eosina, mostrando tumor (T), cápsula preservada (C) e gordura periprostática (F). Análise histopatológica A análise histopatológica foi realizada por dois médicos patologistas da instituição, com 20 e 8 anos de experiência em análise de peças urológicas. O laboratório de patologia da instituição usa, como padrão de análise de peças após prostatectomia radical, o corte da peça cirúrgica, em seu plano transversal, a cada 5,0 mm; as análises histológicas foram orientadas a partir deste sequenciamento de corte. Para este estudo, definiram-se três resultados possíveis para todos os focos tumorais em contato com a cápsula prostática: a) ausência de EEC; b) EEC microscópica, definida como presença de tecido tumoral além da cápsula, porém não mais que um campo de visão amplo (< 0,5 mm); c) EEC grosseira (visível nas imagens de RM), quando maior do que limite definido acima, de acordo com recomendações existentes na literatura(21). Posteriormente, um terceiro observador, radiologista, fez a correlação entre os sítios definidos pela análise da imagem pelos observadores 1 e 2 e o resultado do anatomopatológico, usando o mapa preconizado pela classificação PI-RADS v2.1(20). Análise estatística A análise estatística foi realizada com o software Stata, versão 15.0. As variáveis quantitativas foram apresentadas com valores de média e desvio-padrão. A acuidade diagnóstica para EEC foi obtida pela área sobre a curva ROC (area under the curve – AUC). Os melhores pontos de corte do ADC médio, contato capsular T2 e DWI para a classificação da EEC foi obtido utilizando-se o método proposto por DeLong et al.(22). Para analisar a concordância entre observadores em relação à avaliação qualitativa T2, PI-RADS DWI, PI-RADS T2 e PI-RADS global, foi utilizado o coeficiente kappa, introduzido por Cohen(23). A verificação sobre as variáveis PSA, Gleason, estádio clínico, porcentagem de fragmentos positivos na biópsia e avaliação qualitativa T2 serem preditoras de EEC foi conduzida por regressão logística e cálculo de odds ratio. Para todas as comparações, adotou-se nível de significância de 5% (p < 0,05). RESULTADOS A média de idade dos 67 pacientes selecionados foi de 63,3 anos (variação de 46 a 76 anos). A média do PSA foi de 10,9 ng/dL (variação de 3,4 a 41,4 ng/dL) e a mediana foi de 7,9 ng/dL. O intervalo entre a RM e a cirurgia foi de 42,2 dias, variando de 1 a 90 dias. A análise das imagens mostrou tamanho médio de 1,7 cm (0,8–6,1 cm) para as neoplasias prostáticas para o observador 1 e de 1,6 cm (0,7–5,9) para o observador 2. O escore Gleason predominante na avaliação histopatológica foi o Gleason 7, visto em 64,2% dos pacientes, sendo 38,8% Gleason 3+4 (ISUP 2) e 25,4% Gleason 4+3 (ISUP 3), observando-se que 16,5% dos pacientes foram de alto grau histológico – Gleason 8 e 9 (ISUP 4 e 5). A distribuição dos dados clínicos, demográficos e da avaliação histopatológica encontra-se na Tabela 2. Quando avaliado na ponderação T2, o contato capsular médio entre a neoplasia e a cápsula foi 14,6 mm (0–55,0 mm) para o observador 1 e 13,1 mm (0–65,0 mm) para o observador 2. Utilizando-se a ponderação em difusão, pelo mapa de ADC, o contato capsular médio foi 16,9 mm (0–57,0 mm) para o observador 1 e 14,9 mm (0–63,0 mm) para o observador 2. O ADC médio, obtido com base na média dos valores de ambos os radiologistas, foi 1,241 ± 0,26 × 10–3 mm/s2 para o grupo sem EEC, 1,13 ± 0,34 × 10–3 mm/s2 para o grupo com EEC microscópica e 0,96 ± 0,18 × 10–3 mm/s2 para o grupo com EEC grosseira (Tabela 2), uma diferença estatisticamente significante (p = 0,01). A avaliação histológica das margens das peças cirúrgicas (Tabela 2) demonstrou que na maioria dos pacientes (n = 44; 65,7%) não havia EEC e em apenas 12 pacientes (17,9%) havia EEC microscópica. Onze pacientes tiveram ECE grosseira (16,4%). A avaliação qualitativa para EEC, pelos dois observadores, utilizando a ponderação T2 da mpRM, demonstrou que houve predomínio da condição 2 (lesão apenas toca a cápsula), caracterizada em 46,3% dos pacientes do observador 1 e em 44,8% dos pacientes do observador 2. Na análise da concordância interobservador para a avaliação qualitativa da cápsula usando a ponderação T2, obteve-se um coeficiente kappa de 0,77 (0,66–0,87), indicando concordância substancial. A acurácia diagnóstica para predição da EEC microscópica foi 0,745 para o observador 1 e 0,804 para o observador 2, uma diferença não significativa (p = 0,92). Para a detecção de ambas as EECs, grosseira e microscópica, os valores da acurácia diagnóstica foram 0,716 para o observador 1 e 0,761 para o observador 2, diferença também não significativa (p = 0,97) (Tabela 3). Quanto à classificação PI-RADS final, observou-se concordância substancial entre os observadores, com coeficiente kappa de 0,61 (intervalo de confiança de 95%: 0,47–0,73). Para a predição da EEC microscópica, não houve diferença entre a AUC de CCT2, CCDWI e ADC médio, com valores, respectivamente, de 0,728, 0,691 e 0,675 para o observador 1 e 0,782, 0,821 e 0,799 para o observador 2 (Figura 2). Quando os valores de ADC médio foram combinados ao contato capsular, a acurácia para o observador 1 foi 0,714 para CCT2+ADC e 0,678 para CCDWI+ADC, e para o observador 2 foi 0,869 para CCT2+ADC e 0,870 para CCDWI+ADC (Tabela 4). Nesses casos, não houve diferença significativa entre os maiores valores da associação ADC + contato capsular com nenhum dos parâmetros isolados, para os dois observadores. Os melhores valores de corte, que maximizavam a AUC, foram 18,0 mm para CCT2 para ambos os observadores, e para CCDWI foram 14 mm para o observador 1 e 15,0 mm para o observador 2. 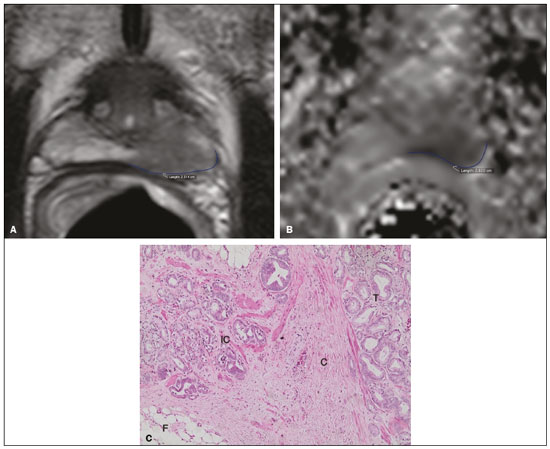 Figura 2. Homem, 60 anos, PSA = 25,6 ng/dL. Câncer de próstata Gleason 7 (3+4) em 7 de 12 fragmentos e estádio clínico 2b. A: Imagem axial em T2 mostrando discreto abaulamento da cápsula, mas sem sinais inequívocos de EEC macroscópica além da cápsula. Medida do contato capsular de 22,1 mm para o observador 1 e 23,1 mm para o observador 2 (linha azul). B: Mapa de ADC do paciente mostrando contato capsular de 23,1 mm para o observador 1 e 28,2 mm para o observador 2 (linha azul). C: Corte histológico, coloração hematoxilina-eosina, mostrando tumor (T) estendendo-se através da cápsula (C), com componente intracapsular (IC) e junto à gordura periprostática (F). Para a detecção combinada da EEC – microscópica e grosseira –, a AUC de CCT2, CCDWI e ADC médio foi, respectivamente, de 0,758, 0,743 e 0,778 para o observador 1, e 0,833, 0,832 e 0,855 para o observador 2. Quando os valores de ADC médio foram combinados ao contato capsular para detecção da EEC microscópica e grosseira, a acurácia para o observador 1 foi 0,757 para CCT2+ADC e 0,743 para CCDWI+ADC, e para o observador 2 foi 0,871 para CCT2+ADC e 0,849 para CCDWI+ADC (Tabela 4). Novamente, em ambas as situações, não houve diferença significativa entre os maiores valores da associação ADC + contato capsular, com nenhum dos parâmetros isolados, para ambos os observadores. Quando se utilizou a regressão logística para verificar quais variáveis eram preditores independentes da EEC microscópica, observou-se que PSA, tamanho da lesão, escore de Gleason/ISUP, porcentagem de fragmentos positivos na biópsia, CCT2, CCDWI e ADC médio foram preditores apenas na análise univariada (Tabela 5). Porém, na análise multivariada, para nenhuma variável o ADC médio se correlacionou significativamente com a ocorrência de EEC microscópica. DISCUSSÃO A mpRM, cada vez mais utilizada para a abordagem da neoplasia de próstata, além de sua utilização no diagnóstico, vem sendo incorporada em algumas outras indicações, entre elas o estadiamento. Neste estudo, a incorporação da medida do ADC médio da lesão não melhorou o diagnóstico da EEC, quando comparada à análise morfológica. Porém, a medida do contato tumor-cápsula na DWI, mapa de ADC, se mostrou um melhor parâmetro preditor de extensão microscópica que a mesma medida nas imagens ponderadas em T2. O uso da mpRM para o estadiamento da neoplasia de próstata tem crescido nos últimos anos, à medida que as técnicas cirúrgicas, mais refinadas, exigem informações pré-operatórias mais precisas para melhor planejamento terapêutico. As margens cirúrgicas comprometidas têm sido associadas a recidiva bioquímica(24) e menor tempo livre de doença (recorrência), com necessidade de terapias de resgaste(25). Sabe-se que os resultados oncológicos são altamente dependentes da habilidade e experiência do urologista, entretanto, bom planejamento cirúrgico também parece ser relevante(26,27). Na década de 90, Smith et al. alertaram para a limitação do exame digital retal e da ultrassonografia transretal para detecção da EEC(28). Surgiram então ferramentas para predição de EEC, com base em dados clínicos e laboratoriais, os chamados nomogramas. Partin et al.(29) descreveram um nomograma para predição da EEC, levando em conta fatores como PSA, estadiamento clínico e escore de Gleason na biópsia. Porém, nesse nomograma não havia a especificação do lado da EEC, o que reduzia sua importância como ferramenta de planejamento cirúrgico. Steuber et al.(30) e Sayyid et al.(31) desenvolveram outro nomograma, também baseado em dados clínicos e laboratoriais, com a vantagem de predizer o lado da extensão (lado-específico). Recentemente, outras ferramentas de predição incorporaram os achados de mpRM aos dados clínicos, com intuito de melhorar a detecção da EEC lado-específico. O nomograma de Giganti et al.(32) demonstrou associação de achados de imagem com parâmetros clinicolaboratoriais, mostrando resultados superiores aos nomogramas com os últimos dados, isoladamente. Além disso, sabe-se que as ferramentas baseadas apenas em dados de imagem não tinham desempenho inferior àquelas em que uma combinação de dados clinicolaboratoriais e de imagem era usada(33). Em nosso estudo, apesar de não existir uma comparação direta entre os dados de imagem, isolados, e nomogramas com dados clínicos e laboratoriais, é possível observar que os valores obtidos pelo estadiamento por imagem se assemelham aos do nomograma de Giganti. A conhecida limitação de resolução espacial da RM de identificar extensões microscópicas é, em grande parte, sobreposta pela incorporação do contato cápsula-tumor, um parâmetro de imagem já usado para este fim desde a década de 90, pela avaliação da ultrassonografia transretal, por Shinohara et al.(34). O contato tumor-cápsula tem sido extremamente utilizado como parâmetro indireto de identificação das extensões extracapsulares microscópicas, em vários estudos na literatura(8–13,35,36). O melhor valor de corte para assegurar boa sensibilidade, sem prejuízo da especificidade, tem estado próximo ao valor sugerido por Shinorara et al., de 18,0 mm(34). Em nosso estudo, as imagens por difusão foram superiores às imagens ponderadas em T2 para detecção da EEC microscópica. Em nosso estudo, obtivemos valores de corte de 15,0 mm para as imagens em T2 e de 14,0 para as DWIs (mapa de ADC), este último com resultados superiores às imagens em T2, para ambos os observadores. Nossos resultados estão em concordância com vários estudos na literatura, como os de Shinohara et al.(34) e de Soylu et al.(36), e em desacordo com os valores mais recentes encontrados por Rosenkrantz et al.(14), que utilizaram o mapa de ADC e ponderação em T2 e obtiveram valores de cortes de 7,0 mm e 6,0 mm, respectivamente. Os valores discrepantes encontrados entre o nosso estudo e o de Rosenkrantz et al.(14) também podem estar relacionados, além da técnica do exame de RM, aos critérios utilizados para definição de EEC microscópica, uma vez que, para alguns patologistas, esta é definida pela simples transgressão da cápsula, mas para outros, este diagnóstico estaria dependente da infiltração da gordura periprostática pelo tumor(37). Em recente estudo, Kim et al.(13) demonstraram que a medida do mapa de ADC seria uma variável independente significativa para a predição da EEC microscópica em tumores de baixo grau. Tal resultado indicaria a possibilidade de a sequência DWI ser utilizada também como uma importante ferramenta no estadiamento do câncer de próstata. Nosso estudo confirma que a medida do valor médio do ADC seria um preditor independente da EEC microscópica. E, além disso, que a medida do contato capsular no mapa de ADC demonstrou ser técnica importante para este diagnóstico, superior à medida nas imagens ponderadas em T2. É importante destacar que os resultados foram similares, apesar de técnicas diferentes; nosso trabalho foi realizado em aparelho de RM de 1,5 T e com o uso de bobina endorretal, com o valor do ADC representando a média de três medidas com o mesmo tamanho de região de interesse, ao passo que no estudo de Kim et al. utilizou-se RM de 3,0 T, sem o uso de bolina endorretal, e a média de duas medidas com a mesma região de interesse. Diante disso, é razoável supor que nossos resultados sejam válidos para exames obtidos sem bobina endorretal, não só em aparelhos de 3,0 T, mas também para exames realizados em modernos equipamentos de 1,5 T. Obtivemos excelente concordância entre os observadores, na avaliação qualitativa. Além disso, todos os casos que já mostravam comprometimento capsular grosseiro pela neoplasia ou extensão além da cápsula, de 1,0 mm ou mais, foram identificados por ambos os observadores, o que é de extrema importância, pois interferem na proposta terapêutica e no prognóstico. Nosso estudo tem algumas limitações que, potencialmente, podem ter interferido nos resultados. Primeiro, utilizamos um desenho de estudo retrospectivo, o que o torna mais suscetível a vieses, principalmente o de seleção. O baixo número de casos de EEC microscópica e macroscópica, apenas 23, também limita a força dos resultados, sendo necessários estudos complementares para validação dos resultados aqui encontrados. Outra limitação é que a escala para avaliação qualitativa da cápsula na ponderação T2 foi escolhida arbitrariamente, tendo em vista que as versões da classificação PI-RADS acima da versão 2 não trazem estratificação de risco para esse parâmetro. Em resumo, nossos resultados apontam que as DWIs são preditores independentes da EEC no câncer de próstata. As medidas do contato capsular, nas imagens do mapa de ADC, demonstraram boa acuidade para predizer a EEC, para ambos os observadores. Porém, a incorporação dos valores do ADC ao contato capsular não melhorou significativamente a acuidade diagnóstica para detecção da EEC microscópica do câncer de próstata. REFERÊNCIAS 1. National Cancer Institute. Cancer Stats Facts: prostate cancer. [cited 2019 Aug 28]. Available from: https://seer.cancer.gov/statfacts/html/prost.html. 2. Baunacke M, Schmidt ML, Thomas C, et al. Long-term functional outcomes after robotic vs. retropubic radical prostatectomy in routine care: a 6-year follow-up of a large German health services research study. World J Urol. 2020;38:1701–9. 3. Jereczek-Fossa BA, Zerini D, Fodor C, et al. Reporting combined outcomes with Trifecta and survival, continence, and potency (SCP) classification in 337 patients with prostate cancer treated with image-guided hypofractionated radiotherapy. BJU Int. 2014;114:E3–E10. 4. Godoy G, Tareen BU, Lepor H. Site of positive surgical margins influences biochemical recurrence after radical prostatectomy. BJU Int. 2009;104:1610–4. 5. Aoun F, Albisinni S, Henriet B, et al. Predictive factors associated with biochemical recurrence following radical prostatectomy for pathological T2 prostate cancer with negative surgical margins. Scand J Urol. 2017;51:20–6. 6. Woo S, Ghafoor S, Vargas HA. Contribution of radiology to staging of prostate cancer. Semin Nucl Med. 2019;49:294–301. 7. Zhang J, Hricak H, Shukla-Dave A, et al. Clinical stage T1c prostate cancer: evaluation with endorectal MR imaging and MR spectroscopic imaging. Radiology. 2009;253:425–34. 8. Bloch BN, Furman-Haran E, Helbich TH, et al. Prostate cancer: accurate determination of extracapsular extension with high-spatial-resolution dynamic contrast-enhanced and T2-weighted MR imaging—initial results. Radiology. 2007;245:176–85. 9. Yu KK, Scheidler J, Hricak H, et al. Prostate cancer: prediction of extracapsular extension with endorectal MR imaging and three-dimensional proton MR spectroscopic imaging. Radiology. 1999;213: 481–8. 10. Fütterer JJ, Engelbrecht MR, Huisman HJ, et al. Staging prostate cancer with dynamic contrast enhanced endorectal MR imaging prior to radical prostatectomy: experienced versus less experienced readers. Radiology. 2005;237:541–9. 11. McClure TD, Margolis DJA, Reiter RE, et al. Use of MR imaging to determine preservation of the neurovascular bundles at robotic-assisted laparoscopic prostatectomy. Radiology. 2012;262:874–83. 12. Rosenkrantz AB, Chandarana H, Gilet A, et al. Prostate cancer: utility of diffusion-weighted imaging as a marker of side-specific risk of extracapsular extension. J Magn Reson Imaging. 2013;38:312–9. 13. Kim CK, Park SY, Park JJ, et al. Diffusion weighted MRI as a predictor of extracapsular extension in prostate cancer. AJR Am J Roentgenol. 2014;202:W270–6. 14. Rosenkrantz AB, Shanbhogue AK, Wang A, et al. Length of capsular contact for diagnosing extraprostatic extension on prostate MRI: assessment at an optimal threshold. J Magn Reson Imaging. 2016;43:990–7. 15. Lawrence EM, Gallagher FA, Barrett T, et al. Preoperative 3-T diffusion-weighted MRI for the qualitative and quantitative assessment of extracapsular extension in patients with intermediate- or high-risk prostate cancer. AJR Am J Roentgenol. 2014;203:W280–6. 16. Bittencourt LK, Hausmann D, Sabaneeff N, et al. Multiparametric magnetic resonance imaging of the prostate: current concepts. Radiol Bras. 2014;47:292–300. 17. Woo S, Cho JY, Kim SY, et al. ExtracapsuIar extension in prostate cancer: added value of diffusion-weighted MRI in patients with equivocal findings on T2-weighted imaging. AJR Am J Roentgenol. 2015;204:W168–75. 18. Barentsz JO, Richenberg J, Clements R, et al. ESUR prostate MR guidelines 2012. Eur Radiol. 2012;22:746–57. 19. Weinreb JC, Barentsz JO, Choyke PL, et al. PI-RADS prostate imaging-reporting and data system: 2015, version 2. Eur Urol. 2016; 69:16–40. 20. Turkbey B, Rosenkrantz AB, Haider MA, et al. Prostate Imaging Reporting and Data System version 2.1: 2019 update of Prostate Imaging Reporting and Data System version 2. Eur Urol. 2019;76: 340–51. 21. Farchoukh L, LaFramboise W, Nelson J, et al. Prognostic significance of subclassification of extracapsular extension in prostate cancer: study of 673 patients at a large academic institution. Am J Clin Pathol. 2015;144:A386. 22. DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach. Biometrics. 1988;44:837–45. 23. Cohen J. A coefficient of agreement for nominal scales. Educational and Psychological Measurement. 1960;20:37–46. 24. Sooriakumaran P, Dev HS, Skarecky D, et al. The importance of surgical margins in prostate cancer. J Surg Oncol. 2016;113:310–5. 25. Ploussard G, Agamy MA, Alenda O, et al. Impact of positive surgical margins on prostate-specific antigen failure after radical prostatectomy in adjuvant treatment-naïve patients. BJU Int. 2011;107: 1748–54. 26. Neumaier MF, Segall Júnior CH, Hisano M, et al. Factors affecting urinary continence and sexual potency recovery after robotic-assisted radical prostatectomy. Int Braz J Urol. 2019;45:703–12. 27. Marenco J, Orczyk C, Collins T, et al. Role of MRI in planning radical prostatectomy: what is the added value? World J Urol. 2019; 37:1289–92. 28. Smith JA Jr, Scardino PT, Resnick MI, et al. Transrectal ultrasound versus digital rectal examination for the staging of carcinoma of the prostate: results of a prospective, multi-institutional trial. J Urol. 1997;157:902–6. 29. Partin AW, Kattan MW, Subong EN, et al. Combination of prostate specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA. 1997;277:1445–51. 30. Steuber T, Graefen M, Haese A, et al. Validation of a nomogram for prediction of side specific extracapsular extension at radical prostatectomy. J Urol. 2006;175(3 Pt 1):939–44. 31. Sayyid R, Perlis N, Ahmad A, et al. Development and external validation of a biopsy-derived nomogram to predict risk of ipsilateral extraprostatic extension. BJU Int. 2017;120:76–82. 32. Giganti F, Coppola A, Ambrosi A, et al. Apparent diffusion coefficient in the evaluation of side-specific extracapsular extension in prostate cancer: development and external validation of a nomogram of clinical use. Urol Oncol. 2016;34:291.e9-291.e17. 33. Gupta RT, Faridi KF, Singh AA, et al. Comparing 3-T multiparametric MRI and the Partin tables to predict organ-confined prostate cancer after radical prostatectomy. Urol Oncol. 2014;32:1292–9. 34. Shinohara K, Wheeler TM, Scardino PT. The appearance of prostate cancer on transrectal ultrasonography: correlation of imaging and pathological examinations. J Urol. 1989;142:76–82. 35. Renard-Penna R, Rouprêt M, Comperat E, et al. Accuracy of high resolution (1.5 tesla) pelvic phased array magnetic resonance imaging (MRI) in staging prostate cancer in candidates for radical prostatectomy: results from a prospective study. Urol Oncol. 2013;31:448–54. 36. Soylu FN, Eggener S, Oto A. Local staging of prostate cancer with MRI. Diagn Interv Radiol. 2012;18:365–73. 37. Retèl VP, Bouchardy C, Usel M, et al. Determinants and effects of positive surgical margins after prostatectomy on prostate cancer mortality: a population-based study. BMC Urol. 2014;14:86. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Ribeirão Preto, SP, Brasil a. https://orcid.org/0000-0001-8898-9578 b. https://orcid.org/0000-0001-7380-8877 c. https://orcid.org/0000-0002-1158-1045 d. https://orcid.org/0000-0001-7953-7692 e. https://orcid.org/0000-0002-3579-5048 f. https://orcid.org/0000-0003-0328-1840 g. https://orcid.org/0000-0002-4700-0599 Correspondência: Dr. Valdair Francisco Muglia FMRP-USP Avenida Bandeirantes, 3900, Vila Monte Alegre Ribeirão Preto, SP, Brasil, 14049-900 E-mail: fmuglia@fmrp.usp.br Recebido para publicação em 15/10/2019 Aceito, após revisão, em 27/1/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554