Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 6 - Nov. / Dez. of 2020
Vol. 53 nº 6 - Nov. / Dez. of 2020
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Vinicius Adami Vayego Fornazari1,a; Rômulo Florêncio Tristão Santos2,b; Thiago Franchi Nunes2,c; Rodrigo Perrella3,d; Tiago Magalhães Freire3,e; Fabio Carvalho Vicentini3,f; Joaquim Francisco de Almeida Claro3,g; Denis Szejnfeld1,h |
|
|
Descritores: Nefrolitotomia percutânea; Falso aneurisma; Fístula arteriovenosa; Embolização terapêutica; Radiologia intervencionista; Angiografia por tomografia computadorizada. |
|
|
Resumo: INTRODUÇÃO
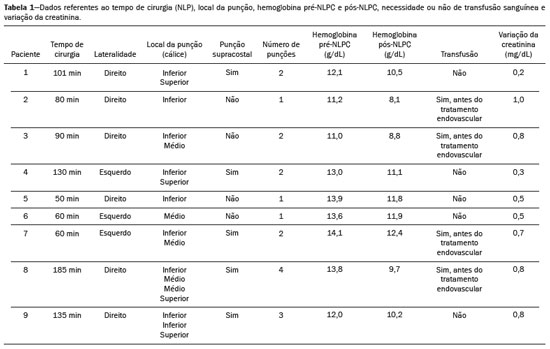
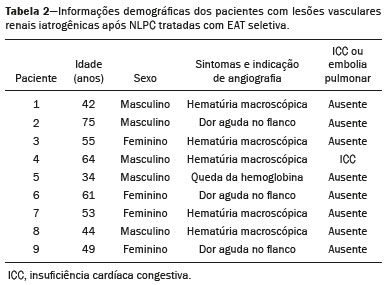
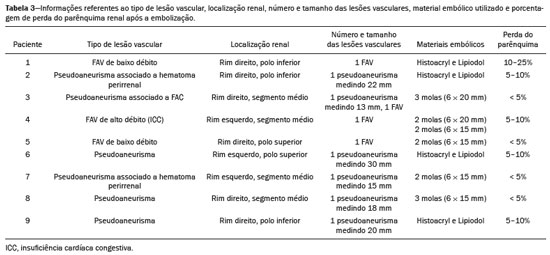
A nefrolitotripsia percutânea (NLPC) é o procedimento de escolha para o tratamento de cálculos renais maiores que 2 cm(1). Embora a cirurgia renal percutânea seja menos invasiva que a cirurgia convencional, as complicações podem ocorrer, sendo a hemorragia renal a complicação mais preocupante, com necessidade de transfusão de sangue em 1% a 11% dos casos(2,3). Lesões vasculares renais iatrogênicas, com formação de pseudoaneurismas, fístulas arteriovenosas (FAVs) e fístulas arteriocalicinais (FACs), são condições raras, mas que ameaçam a vida do paciente. O principal sintoma, geralmente, inclui hematúria macroscópica, embora possam apresentar uma variedade de outros sinais e/ou sintomas, como, por exemplo, dor no flanco, náuseas, vômitos, tontura e febre. A gravidade do sangramento varia e alguns pacientes podem progredir rapidamente para instabilidade hemodinâmica e insuficiência cardíaca(4,5). Acredita-se que essas lesões originem-se da transecção de uma artéria durante os procedimentos percutâneos(5). A angiografia por cateter com subtração digital pode ser considerada como conduta de eleição, por apresentar eficácia diagnóstica em sangramentos e consecutiva embolização arterial transcateter (EAT)(4). Na maioria dos casos, o tratamento conservador é bem sucedido para a estabilização desses pacientes, entretanto, quando o sangramento é persistente ou hemodinamicamente significativo, a intervenção na forma de EAT é necessária em 0,8% a 1,4% dos casos(2,4). No passado, as angiografias exigiam altas doses de meios de contraste iodado de maior osmolaridade e, consequentemente, aumentavam o risco de nefropatia induzida. Atualmente, com a introdução de meios de contraste hiposmolares e isosmolares, e o aperfeiçoamento de dispositivos e técnicas superseletivas de EAT, esse risco é insignificante(5). Com a concomitante evolução dos métodos de diagnóstico por imagem e o advento da especialidade radiologista intervencionista, sangramentos agudos podem ser diagnosticados com precisão e efetivamente tratados(6), tornando a angiografia por cateter com subtração digital seguida de EAT a conduta de eleição para diagnóstico e tratamento de complicações hemorrágicas agudas(1,2,4–6) Assim, o conhecimento das complicações vasculares iatrogênicas após NLPC pode ajudar os radiologistas intervencionistas no planejamento e execução da EAT. No presente estudo descrevemos uma serie de complicações vasculares renais iatrogênicas após NLPC e os resultados após a EAT seletiva. MATERIAIS E MÉTODOS Este trabalho foi aprovado pelo comitê de ética em pesquisa e gerência de ensino e pesquisa da instituição. Por se tratar de um estudo retrospectivo, com análise de banco de dados, o termo de consentimento livre e esclarecido foi dispensado. Seleção dos pacientes Dados referentes a lesões vasculares renais iatrogênicas após NLPC, tratadas por EAT seletiva pela equipe de radiologia intervencionista em nossa instituição, entre 1º de fevereiro de 2013 e 30 de junho de 2019, foram avaliados retrospectivamente. Os dados clínicos e cirúrgicos foram extraídos do banco de dados prospectivo do setor de endourologia e cálculo renal da instituição. Pacientes submetidos a EAT por outras causas foram excluídos do estudo. Os dados dos pacientes foram convertidos em numerais, garantindo o sigilo das informações e privacidade dos sujeitos. Coleta e análise de dados Os dados coletados foram analisados de forma retrospectiva. Informações referentes a idade, sexo, sinais e/ou sintomas na readmissão no pronto-socorro, presença ou ausência de insuficiência cardíaca congestiva e de embolia pulmonar foram avaliadas. Angiografia por tomografia computadorizada (angio-TC) prévia (Figura 1) foi realizada nos pacientes hemodinamicamente estáveis, detectando a complicação vascular iatrogênica, e angiografia armada confirmando e discriminando o diagnóstico do tipo de lesões vasculares (pseudoaneurisma, FAV de alto ou baixo débito e FAC) foram analisadas. Tentamos determinar se essas lesões foram isoladas ou associadas a outras lesões. Outras variáveis foram número e tamanho de pseudoaneurismas, número de FAVs, número de FACs, localização da lesão, hematoma perirrenal, líquido livre na cavidade abdominal, tipo de material embólico utilizado e tempo de internação hospitalar. 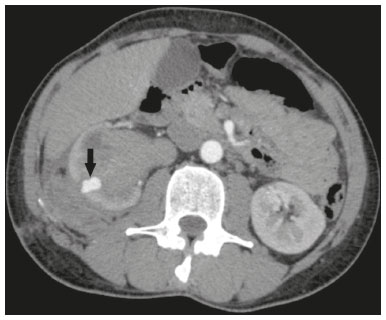 Figura 1. Exame de TC, corte axial, fase corticomedular, mostrando pseudoaneurisma no segmento médio renal e hematoma perirrenal à direita. Perda parenquimatosa foi avaliada comparando as imagens angiográficas obtidas antes e após a embolização. As imagens de angio-TC foram avaliadas independentemente e os achados finais foram alcançados em consenso por três radiologistas intervencionistas. A perda parenquimatosa após EAT foi categorizada em quatro grupos: < 5%, 5–10%, 10–25% e 25–50%. Essa perda foi calculada com base na área que não captou contraste em relação à área renal total durante o procedimento, por exame angiográfico. Complicações precoces e tardias foram determinadas e a angio-TC foi realizada para o acompanhamento. Procedimento de embolização Os procedimentos de EAT seletiva foram realizados por dois radiologistas intervencionistas com 10 e 15 anos de experiência. A arteriografia foi realizada sob anestesia local por meio de acesso arterial femoral. Após a obtenção de um acesso vascular com bainha de 5 Fr, foram realizados cateterismos seletivos (Cobra 5 Fr; Cordis, a Cardinal Health Company, Dublin, OH, EUA) e angiografias das artérias renais. As artérias interlobares que causaram o sangramento foram detectadas e o cateterismo seletivo foi realizado utilizando microcateteres de 2,7 Fr (Progeat; Terumo Corporation, Tóquio, Japão). Os pseudoaneurismas, as FAVs e as FACs foram embolizados seletivamente utilizando micromolas ou Histoacryl (B. Braun, Melsungen, Alemanha) com Lipiodol (Guerbet, Villepinte, França), com a finalidade de ocluir o fluxo da lesão arterial com perda parenquimatosa renal mínima (Figuras 2, 3 e 4). A embolização foi concluída quando o fluxo sanguíneo para a lesão não foi mais identificado no estudo angiográfico. A concentração do meio de contraste utilizado foi de 300 mgI/mL, respeitado o volume máximo de 2 mL/kg. 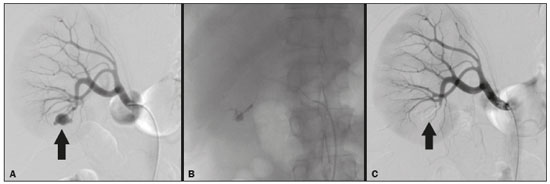 Figura 2. A: Arteriografia pré-embolização identificando pseudoaneurisma no terço inferior do rim direito. B: Cateterização e embolização seletiva do segmento acometido. C: Arteriografia pós-embolização demonstrando ausência do pseudoaneurisma e sem sinais de complicações imediatas. 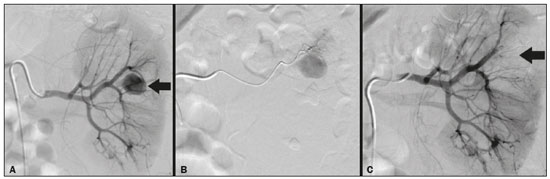 Figura 3. A: Arteriografia pré-embolização identificando pseudoaneurisma no segmento médio do rim esquerdo. B: Cateterização e embolização seletiva do segmento acometido. C: Arteriografia pós-embolização demonstrando ausência do pseudoaneurisma e sem sinais de complicações imediatas. 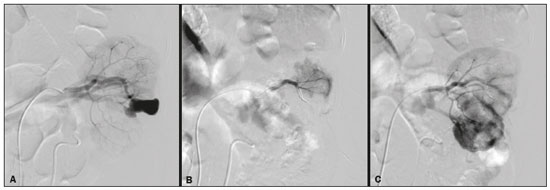 Figura 4. A: Arteriografia pré-embolização identificando FAC no segmento médio do rim esquerdo. B: Cateterização e embolização seletiva do segmento acometido. C: Arteriografia pós-embolização demonstrando ausência da FAC e sem sinais de complicações imediatas. Não há uma descrição clara de contraindicações em embolização de sangramentos de urgência, visto que o procedimento é de cunho terapêutico, inclusive na vigência de discrasias sanguíneas, em que o sangramento no sítio de acesso pode ser evitado com selantes vasculares. Sucesso técnico e clínico O sucesso técnico do procedimento foi definido como embolizações completas dos pseudoaneurismas, FAVs e FACs verificadas por meio de angiografia após o procedimento e no exame de angio-TC realizado entre quatro e seis semanas após a EAT. O sucesso clínico foi baseado na estabilidade hemodinâmica, melhora da hematúria e preservação da função renal, acompanhadas via internação e ambulatorial por um período de 60 dias. Análise estatística Os dados foram digitados em planilha do programa Excel e exportados para o programa estatístico Statistical Package for the Social Sciences versão 20.0 (IBM Corp.; Armonk, NY, EUA) para análise estatística. RESULTADOS De um total de 1133 NLPCs realizadas, 9 pacientes com lesões vasculares renais após NLPC (0,79%), submetidos a EAT, foram incluídos no estudo. Havia cinco homens e quatro mulheres, com média de idade de 53 anos (variação de 34 a 75 anos). Dados referentes ao tempo de cirurgia (NLPC), local da punção, hemoglobina pré-NLPC e pós-NLPC, necessidade ou não de transfusão sanguínea e variação da creatinina estão descritos na Tabela 1. As informações referentes a idade, sexo, sinais e/ou sintomas na readmissão no pronto-socorro, presença ou ausência de insuficiência cardíaca congestiva e de embolia pulmonar, estão descritas na Tabela 2. O sintoma mais comum foi hematúria macroscópica, presente em cinco pacientes no momento da readmissão no pronto-socorro. Três pacientes tiveram dor aguda no flanco e um paciente apresentou queda dos níveis de hemoglobina no pós-operatório imediato. Nos pacientes do estudo, identificamos três pseudoaneurismas isolados, dois casos de combinação de pseudoaneurisma e sangramento ativo (hematoma perirrenal) e um caso de associação de pseudoaneurisma e FAC. Não observamos associações de pseudoaneurisma e FAV. A FAV foi diagnosticada em três pacientes, não sendo observada em associação com outras lesões vasculares. Não identificamos FAC isolada, somente associada a pseudoaneurisma. Nenhum dos pacientes apresentou todos os três tipos de lesões vasculares em conjunto. Dos nove pacientes, seis tinham lesões iatrogênicas no rim direito e três, no rim esquerdo. A localização das lesões foram duas no polo superior, quatro no segmento médio e três lesões no polo inferior. O número de pseudoaneurisma por paciente neste estudo foi um, com tamanho médio de 19,6 mm (faixa de 13 a 30 mm). O número de FAV e FAC por paciente foi um. Cinco pacientes foram submetidos a embolização por micromolas 6 × 15 mm e 6 × 20 mm, com utilização de duas a três molas em cada paciente. Quatro pacientes foram submetidos a embolização por Histoacryl e Lipiodol, na concentração de 1:3, até o preenchimento do pseudoaneurisma ou oclusão do ramo arterial, nunca excedendo 10 mL. A taxa de perda do parênquima foi < 5% em quatro pacientes, 5–10% em quatro pacientes, e 10–25% em um paciente. Não observamos perdas parenquimatosas maiores que 25%. Quatro pacientes necessitaram de transfusão sanguínea antes do procedimento endovascular, e nenhum paciente foi transfundido após a EAT. O volume médio de meio de contraste utilizado para o estudo angiográfico e embolização foi de 70 mL (variação de 40 a 80 mL). O tempo de internação hospitalar após a EAT seletiva variou de 2 a 11 dias. Não observamos complicações precoces ou tardias identificadas na angio-TC. Nenhum paciente necessitou de novo procedimento de embolização por ressangramento durante o período de acompanhamento por 60 dias. Informações referentes ao tipo de lesão vascular, localização renal, número e tamanho das lesões vasculares, material embólico utilizado e porcentagem de perda do parênquima renal após a embolização estão resumidas na Tabela 3. DISCUSSÃO Desde a realização da primeira NLPC em 1976, este procedimento se tornou a intervenção padrão e vem substituindo a cirurgia convencional para o tratamento de litíase renal(1,4). Embora a NLPC seja menos invasiva, as complicações podem ocorrer durante a passagem da agulha, dilatação do trato urinário, nefroscopia ou até mesmo no pós-operatório(2,4). A hemorragia é uma complicação comum, com incidência relatada em até 6% dos casos(1). O sangramento ocorre mais comumente por lesão das artérias segmentares anteriores ou posteriores, podendo ser evitado por uma punção renal posterolateral (zona de Brödel)(7,8). Pode manifestar-se clinicamente como hematúria macroscópica, com gravidade do sangramento variável, e alguns pacientes podem progredir rapidamente para instabilidade hemodinâmica e insuficiência cardíaca nos casos de FAV de alto débito(2,4,5). O período entre a intervenção renal e o surgimento de lesões vasculares renais iatrogênicas pode ser variado, e as complicações geralmente ocorrem nas três semanas subsequentes à NLPC. Em caso de lesão arterial renal, mecanismos hemostáticos, como diminuição do fluxo sanguíneo, formação de coágulos e pressão dos tecidos circunjacentes, atuam no sentido de controlar o sangramento. Quando esses mecanismos falham e o fluxo sanguíneo para a artéria lesionada aumenta, o vazamento de sangue pode formar um pseudoaneurisma, que é uma coleção sanguínea confinada ao lado do vaso pelo tecido circundante. O pseudoaneurisma foi a lesão vascular renal iatrogênica mais frequente no nosso estudo, observado em seis dos nove pacientes. Um verdadeiro aneurisma é distinguido de um pseudoaneurisma pelo envolvimento de todas as três camadas da parede arterial (íntima, média e adventícia). Quando o pseudoaneurisma se torna maior e ocorre vazamento de sangue no sistema coletor, pode ocorrer hematúria macroscópica. Na literatura, hematúria macroscópica e/ou dor no flanco foram relatadas em quase todos os casos com pseudoaneurisma(4,9). FAV é uma comunicação anormal entre os sistemas arterial e venoso em estreita proximidade, levando a uma conexão fistulosa, sem um leito capilar intermediário(4,5). A FAV pode ser assintomática, mas pode causar hematúria macroscópica, hipertensão ou insuficiência cardíaca (FAV de alto débito)(4). A frequência de pseudoaneurisma e FAV simultâneos ainda é desconhecida. Pseudoaneurisma e FAV não foram observados concomitantes no nosso estudo. A fístula para o sistema coletor também pode ocorrer, e uma FAC é uma comunicação anormal entre os sistemas arterial e calicinal, com sangramento clínico potencialmente grave. Em nosso estudo, nenhum paciente apresentou FAC isolada, enquanto um paciente tinha FAC associada a pseudoaneurisma. O sangramento pós-operatório pode ocorrer separadamente desses processos, levando habitualmente à formação de hematoma perirrenal, que é tipicamente venoso e não envolve fistulização para o sistema coletor, geralmente se resolvendo espontaneamente, embora possa causar uma diminuição do hematócrito no pós-operatório. O sintoma de apresentação dominante para todos os pacientes de nossa série foi hematúria macroscópica. A maioria dos pacientes nos estudos publicados também apresentaram hematúria macroscópica, embora tenham sido publicados vários relatos de pacientes que apresentavam dor no flanco, náuseas, vômitos, tontura, febre e/ou diminuição apenas do hematócrito(4,5). Quatro pacientes em nossa série necessitaram de transfusão, provavelmente pela abordagem precoce e efetiva da EAT. A angiografia é usada como um dos primeiros exames radiológicos sugeridos para o diagnóstico. Em condições de emergência, a angio-TC é vantajosa em relação às outras modalidades de imagem. As fases arteriais e nefrográficas da angio-TC devem ser preferencialmente realizadas para detectar lesões vasculares iatrogênicas renais(1). A angio-TC foi o método diagnóstico inicial, de acordo com o protocolo de abdome agudo da nossa instituição. Todos os profissionais devem estar cientes das potenciais complicações após NLPC. Diante de um paciente pós- operatório de NLPC com sinais e sintomas característicos, principalmente hematúria macroscópica, a angio-TC contribui para o diagnóstico de complicações hemorrágicas, planejamento do procedimento angiográfico, permitindo estudo direcionado, com redução do tempo de procedimento, redução da dose de contraste e redução da dose de radiação, além de auxiliar na escolha de dispositivos endovasculares mais factíveis para cada caso. Em serviços que possuam angiógrafos com aplicação tomográfica, reconstrução tridimensional e ampla disponibilidade de materiais endovasculares, a avaliação prévia por angio-TC pode ser excluída. Antes da EAT, manejo clínico e cirurgia convencional eram as únicas opções de tratamento de sangramentos agudos. Atualmente, a EAT é uma das primeiras opções de tratamento para essas lesões(2,4,5,9). A embolização da artéria renal, bem sucedida, é definida como fechamento total e permanente do ramo da artéria renal lesionado. Richstone et al.(2) relataram que 57 de 4695 pacientes (1,2%) necessitaram de EAT seletiva após NLPC. Srivastava et al.(3) relataram EAT após NLPC em 24 de 1854 pacientes e encontraram pseudoaneurisma isolado em 13 casos e combinação de pseudoaneurisma e FAV em 4 casos. As áreas do parênquima onde se formam as lesões vasculares renais iatrogênicas teoricamente já apresentam uma porcentagem significativa de infarto renal pré-embolização, com prejuízo da função renal. A seletividade da embolização possibilita a minimização do infarto renal e, assim, a preservação máxima do parênquima. Em nossa série, a função renal foi bem preservada após a embolização. Shapiro et al.(9) relataram função “estável” em seis pacientes após EAT para pseudoaneurisma. Nenhuma diferença significativa foi encontrada entre os valores de creatinina sérica pré-embolização e pós-embolização no estudo de Martin et al.(10). Dificuldades dos procedimentos de embolização incluem insuficiência renal, vasos tortuosos e estenose da artéria renal(4,11). Na estenose da artéria renal, a embolização pode ser realizada após angioplastia da artéria renal. As complicações da EAT, como dissecção da artéria renal, síndrome pós-embolização e perda da função renal, são extremamente raras(4,12–15) e não ocorreram em nosso estudo. A EAT é realizada de forma seletiva ou superseletiva e a escolha do agente embolizante (coágulo autólogo, balões destacáveis, molas, partículas e N-butil-2-cianoacrilato) é definida de acordo com interpretação do radiologista intervencionista: calibre e padrão de dicotomização do vaso, alto/baixo débito, deságue, contribuição venosa ou linfática. No presente estudo, os agentes de escolha foram mola destaque controlado e N-butil-2-cianoacrilato. Tipicamente, apenas uma sessão de EAT é necessária e raramente são necessários vários procedimentos(4). No nosso estudo, os cinco pacientes com hematúria grave foram submetidos a angiografia e EAT. Nenhum paciente necessitou de uma segunda EAT por recidiva do sangramento. Em caso de persistência do sangramento ou ressangramento, uma nova angiografia com embolização transcateter pode ser realizada, respeitando a clínica e os exames laboratoriais do paciente. A taxa de sucesso desse procedimento na primeira tentativa foi de 100%, semelhante à relatada em outras séries(6), porém, devendo-se levar em consideração o número limitado de pacientes incluídos no nosso trabalho. Este estudo tem algumas limitações. É um estudo retrospectivo e com número relativamente baixo de casos. Entretanto, todos os casos foram extraídos de um banco de dados prospectivo de um serviço de alto volume, tendo avaliação tomográfica antes e depois do procedimento, com avaliações clínica e radiológica bem documentadas. O objetivo deste estudo foi avaliar as lesões vasculares renais iatrogênicas após NLPC, seu manejo por EAT seletiva e os resultados deste procedimento. Os resultados iniciais foram positivos, mostrando alta taxa de sucesso. No período de acompanhamento, a EAT não originou nenhuma deterioração da função renal e o ressangramento não ocorreu em nenhum paciente. CONCLUSÃO Complicações hemorrágicas renais devem ser consideradas em pacientes com hematúria macroscópica após intervenções renais percutâneas, sendo o achado mais comum desta amostra o pseudoaneurima e a FAV. A angio-TC apresenta alta acurácia diagnóstica e guarnece o radiologista intervencionista de dados para um planejamento terapêutico individualizado. EAT é um procedimento seguro e eficaz e pode ser utilizado como primeira linha para o tratamento de complicações hemorrágicas resultantes de procedimentos percutâneos renais. REFERÊNCIAS 1. Türk C, Petrík A, Sarica K, et al. EUA guidelines on interventional treatment for urolithiasis. Eur Urol. 2016;69:475–82. 2. Richstone L, Reggio E, Ost MC, et al. First prize (tie): hemorrhage following percutaneous renal surgery: characterization of angiographic findings. J Endourol. 2008;22:1129–35. 3. Srivastava A, Singh KJ, Suri A, et al. Vascular complications after percutaneous nephrolithotomy: are there any predictive factors? Urology. 2005;66:38–40. 4. Güneyli S, Gök M, Bozkaya H, et al. Endovascular management of iatrogenic renal arterial lesions and clinical outcomes. Diagn Interv Radiol. 2015;21:229–34. 5. Hyams ES, Pierorazio P, Proteek O, et al. Iatrogenic vascular lesions after minimally invasive partial nephrectomy: a multi-institutional study of clinical and renal functional outcomes. Urology. 2011; 78:820–6. 6. Inci K, Cil B, Yazici S, et al. Renal artery pseudoaneurysm: complication of minimally invasive kidney surgery. J Endourol. 2010; 24:149–54. 7. Nunes TF, Tibana TK, Santos RFT, et al. Percutaneous insertion of bilateral double J stent. Radiol Bras. 2019;52:104–5. 8. Tibana TK, Grubert RM, Santos RFT, et al. Percutaneous nephrostomy versus antegrade double-J stent placement in the treatment of malignant obstructive uropathy: a cost-effectiveness analysis from the perspective of the Brazil public health care system. Radiol Bras. 2019;52:305–11. 9. Shapiro EY, Hakimi AA, Hyams ES, et al. Renal artery pseudoaneurysm following laparoscopic partial nephrectomy. Urology. 2009; 74:819–23. 10. Martin X, Murat FJ, Feitosa LC, et al. Severe bleeding after nephrolithotomy: results of hyperselective embolization. Eur Urol. 2000; 37:136–9. 11. Heye S, Maleux G, Van Poppel H, et al. Hemorrhagic complications after nephron-sparing surgery: angiographic diagnosis and management by transcatheter embolization. AJR Am J Roentgenol. 2005;184:1661–4. 12. Schwartz MJ, Smith EB, Trost DW, et al. Renal artery embolization: clinical indications and experience from over 100 cases. BJU Int. 2007;99:881–6. 13. Poulakis V, Ferakis N, Becht E, et al. Treatment of renal-vascular injury by transcatheter embolization: immediate and long-term effects on renal function. J Endourol. 2006;20:405–9. 14. Zelenák K, Sopilko I, Svihra J, et al. Successful embolization of a renal artery pseudoaneurysm with arteriovenous fistula and extravasations using Onyx after partial nephrectomy for renal cell carcinoma. Cardiovasc Interv Radiol. 2009;32:163–5. 15. Nouri YM, Chu HH, Shin JH, et al. Percutaneous obliteration of urinary leakage after partial nephrectomy using N-butyl-cyanoacrylate obliteration of the urinoma with or without coil embolization of the fistula tract. J Vasc Interv Radiol. 2019;30:2002–8. 1. Radiologia Intervencionista e Cirurgia Endovascular, Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 2. Universidade Federal de Mato Grosso do Sul (UFMS), Campo Grande, MS, Brasil 3. Centro de Referência da Saúde do Homem, Hospital de Transplantes Euryclides de Jesus Zerbini, São Paulo, SP, Brasil a. https://orcid.org/0000-0002-5880-1703 b. https://orcid.org/0000-0002-8679-7369 c. https://orcid.org/0000-0003-0006-3725 d. https://orcid.org/0000-0002-9358-2542 e. https://orcid.org/0000-0002-9720-9016 f. https://orcid.org/0000-0003-3745-341X g. https://orcid.org/0000-0002-6307-7342 h. https://orcid.org/0000-0001-8482-5955 Correspondência: Dr. Vinicius Adami Vayego Fornazari Radiologia Intervencionista e Cirurgia Endovascular – EPM-Unifesp Rua Napoleão de Barros, 800, Vila Clementino São Paulo, SP, Brasil, 04024-002 E-mail: drviniciusfornazari@rainter.com.br Recebido para publicação em 4/11/2019 Aceito, após revisão, em 15/1/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554