Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 2 - Mar. / Abr. of 2020
Vol. 53 nº 2 - Mar. / Abr. of 2020
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Larissa Marques Santana1,a; Eduardo de Jesus Agapito Valadares1,b; Marcos Rosa-Júnior1,c |
|
|
Descritores: Lobo temporal; Ressonância magnética; Encefalite límbica; Neurossífilis; Herpes simples; CADASIL. |
|
|
Resumo: INTRODUÇÃO
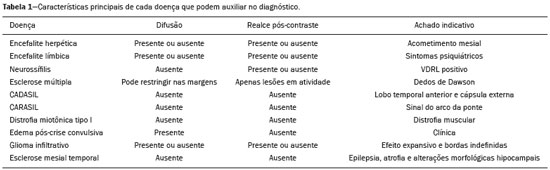
Apesar de muitas doenças se manifestarem com lesões nos lobos temporais, poucas são as restritas ou que apresentam predomínio temporal. O padrão de distribuição das lesões e os achados de imagens associados devem ser conhecidos, pois podem estreitar o espectro de diagnósticos diferenciais e sugerir uma patologia específica. O objetivo deste ensaio iconográfico é demonstrar as alterações na ressonância magnética (RM) das doenças que se manifestam com hipersinal em T2 ou fast fluid-attenuated inversion recovery (FLAIR) no lobo temporal. ENCEFALITE HERPÉTICA A encefalite herpética é causada pelo Herpes simplex e é a causa mais comum de encefalite viral necrosante fulminante. O quadro clínico pode incluir febre, cefaleia, déficits neurológicos focais, convulsões e alteração do nível de consciência(1). Na RM observam-se áreas de edema com hipersinal da substância branca e cinzenta nas sequências ponderadas em T2 e FLAIR. O acometimento temporal pode ser bilateral, e nesses casos geralmente é assimétrico. O realce pelo meio de contraste pode estar ausente na fase inicial e a restrição à difusão não é incomum devido ao edema citotóxico, estando nesses casos mais relacionado a dano neuronal irreversível(1). Na sequência SWI podem-se detectar focos de hemorragia. A principal dica diagnóstica é atentar para o acometimento das porções mesiais dos lobos temporais (Figura 1). 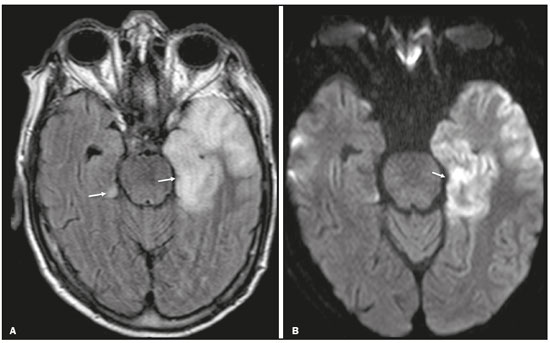 Figura 1. Encefalite herpética. Sequências axiais FLAIR (A) e difusão (B) com hipersinal difuso no lobo temporal esquerdo e mais discreto à direita, com acometimento mesial e restrição à difusão. NEUROSSÍFILIS Tem como agente o Treponema pallidum. Assim como na infecção sistêmica, a apresentação clínica no acometimento cerebral é muito variada e depende do estágio da doença e da área correspondente do sistema nervoso central (SNC) que foi afetada. Na prática clínica, observa-se associação da neurossífilis com pacientes HIV positivos e imunodeprimidos(2). Apesar do grande espectro de manifestação na RM, as lesões por sífilis podem apresentar realce pelo meio de contraste e hipersinal na sequência FLAIR, usualmente sem restrição à difusão. Nos casos de encefalite aguda por sífilis, as características de imagem são indistinguíveis da encefalite herpética, sendo fundamental a correlação laboratorial(2). Há relatos de acometimento meníngeo, meningovascular, ocular, parenquimatoso (Figura 2) ou na calota craniana(2,3). 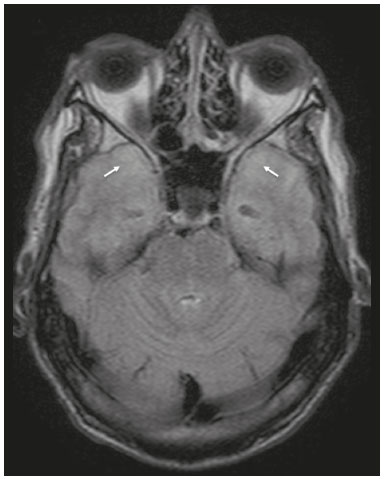 Figura 2. Neurossífilis. Sequência axial FLAIR com hipersinal na substância branca dos lobos temporais. ENCEFALITE LÍMBICA Trata-se de uma inflamação mediada por anticorpos que tipicamente envolve o sistema límbico, mas que também pode afetar a substância branca de outras áreas encefálicas, o tronco encefálico ou os núcleos da base. Pode ser de origem paraneoplásica ou não neoplásica, sendo que as paraneoplásicas apresentam pouca resposta a imunoterapia(4). O quadro clínico varia desde alteração da memória recente até alteração do estado mental, podendo cursar com sintomas psiquiátricos. Nos casos de origem paraneoplásica, a neoplasia mais comumente encontrada é o carcinoma de pequenas células pulmonar(4). Na RM nota-se comprometimento variável dos lobos temporais (Figura 3), raramente apresenta realce pelo meio de contraste e restrição verdadeira à difusão, e focos de sangramento não são comuns, de forma que, quando presentes, outras causas são mais prováveis. Até 25% dos casos podem não apresentar alterações na RM(4). 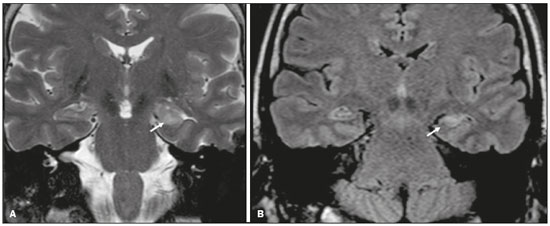 Figura 3. Encefalite límbica. Sequências coronais T2 (A) e FLAIR (B) com hipersinal no hipocampo esquerdo. ESCLEROSE MÚLTIPLA A esclerose múltipla é uma doença desmielinizante do SNC. Cerca de 90% das lesões são supratentoriais e 10% são infratentoriais, podendo envolver a substância branca profunda, justacortical, assim como substância branca e cinzenta ao mesmo tempo. As placas da esclerose múltipla são perpendiculares aos ventrículos laterais, formando os chamados “dedos de Dawson”. As lesões no lobo temporal geralmente são ovoides, focais, com bordas mal definidas, tendendo a confluência. O diagnóstico requer disseminação no tempo e no espaço(5). As lesões crônicas se apresentam com hipossinal na sequência ponderada em T1 e sem realce pelo meio de contraste, enquanto as lesões em atividade apresentam impregnação pelo gadolínio, que pode ser nodular ou anelar e podem apresentar restrição ou não à difusão, que quando presente é decorrente de edema intramielínico(5). No lobo temporal o acometimento das lesões com hipersinal na sequência FLAIR predomina adjacente à superfície dos cornos temporais dos ventrículos laterais(5) (Figura 4). 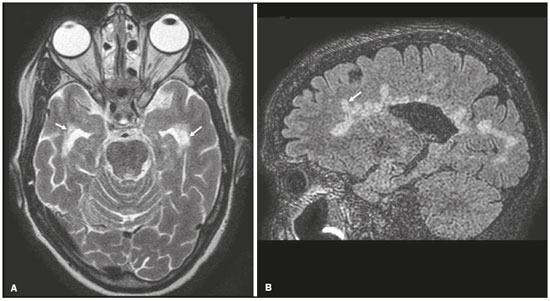 Figura 4. Esclerose múltipla. A: Axial T2 com áreas de hipersinal periventricular e subcortical nos lobos temporais. B: Sagital FLAIR demonstrando os “dedos de Dawson”. CADASIL A arteriopatia autossômica dominante com infartos subcorticais e leucoencefalopatia (CADASIL) é uma microvasculopatia caracterizada por lesões isquêmicas recorrentes de substância branca ocasionando demência vascular em pacientes jovens e de meia-idade(6). A clínica se apresenta com ataques isquêmicos transitórios ou com acidente vascular cerebral estabelecido, podendo se manifestar também com cefaleia intensa de caráter semelhante a enxaqueca(6). A análise histológica demonstra angiopatia de artérias de pequeno e médio calibre, sem arteriosclerose ou depósito de proteína amiloide(6). Na RM observam-se hiperintensidades confluentes na sequência FLAIR da substância branca e a difusão auxilia na identificação das áreas de isquemia aguda e subaguda. Os locais mais comumente afetados no início da doença são o lobo temporal anterior e a cápsula externa. No lobo temporal as lesões são periféricas, predominando próximas à região subcortical. Há relativa preservação da substância branca subcortical occipital, orbitofrontal e córtex(6), como demonstrado na Figura 5. 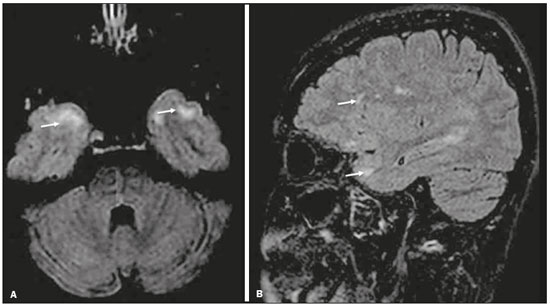 Figura 5. CADASIL. Sequências axial (A) e sagital (B) FLAIR mostrando áreas de hipersinal na porção anterior dos lobos temporais e subcorticais. CARASIL A arteriopatia autossômica recessiva cerebral com infartos subcorticais e leucoencefalopatia (CARASIL) é uma doença sistêmica que afeta pequenos vasos da medula, folículos pilosos e cerebrais. Ocorre tipicamente em adultos jovens e cursa com quadro clínico ainda mais severo do que os casos de CADASIL, observando-se alopecia precoce, demência vascular e espondilose com lombalgia severa. Histologicamente, CARASIL é caracterizada por arteriosclerose intensa de artérias de pequeno calibre(7). Na RM identifica-se leucoencefalopatia difusa com múltiplos infartos lacunares. Nas sequências ponderadas em T2 observam-se lesões com hipersinal na substância branca, mais comumente na substância branca periventricular e profunda, de forma difusa e simétrica, e assim como na CADASIL, a difusão auxilia na identificação das áreas de isquemia aguda/subaguda. Em alguns pacientes observa-se envolvimento anterior dos lobos temporais e da cápsula externa, que é sinal precoce da CADASIL, porém, diferentemente deste, as lesões da CARASIL são confluentes desde o estágio inicial da doença. Um sinal típico dessa doença são as lesões hiperintensas na ponte, o chamado “sinal do arco da ponte”(7) (Figura 6). 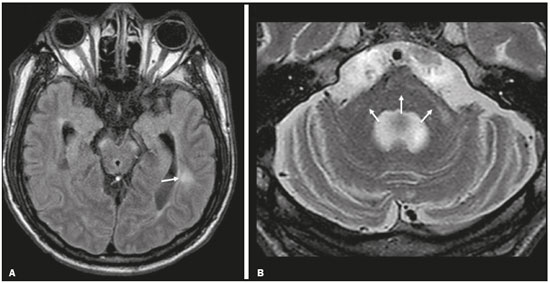 Figura 6. CARASIL. A: Axial FLAIR mostrando hipersinal periventricular no lobo temporal esquerdo. B: Axial T2 demonstrando hipersinal na ponte em forma de arco (“sinal do arco da ponte”). Na sequência T2* havia áreas de depósitos de hemossiderina (não demonstrado). DISTROFIA MIOTÔNICA TIPO I Também conhecida como doença de Steinert, é uma doença autossômica dominante com acometimento sistêmico. As manifestações clínicas podem aparecer já na infância ou na fase adulta e é caracterizada por fraqueza muscular, cardiopatia de condução e catarata(8). As alterações na RM se manifestam como lesões supratentoriais da substância branca e atrofia cortical leve, que não restringem à difusão. O local mais comumente afetado são os lobos frontais, mas também pode ocorrer na região temporoinsular, o que não ocorre na distrofia miotônica tipo II. A RM é fundamental para a avaliação desses pacientes, porém, o diagnóstico definitivo é feito por meio de testes genéticos(8). A Figura 7 mostra um caso de distrofia miotônica tipo I. 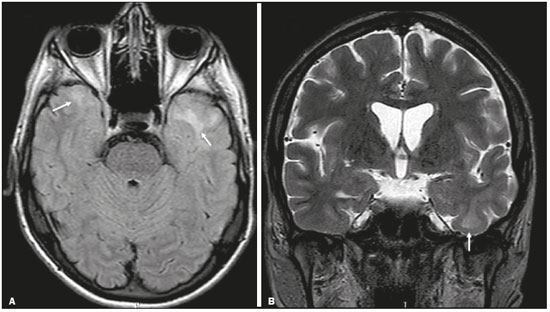 Figura 7. Distrofia miotônica tipo I. A: Axial FLAIR com hipersinal na substância branca dos lobos temporais. B: Coronal T2 mostrando área de hipersinal na substância branca dos lobos temporais. Na difusão não havia restrição. EDEMA PÓS-CRISE CONVULSIVA Nas crises convulsivas prolongadas e/ou crises repetidas em uma frequência que não permite a recuperação completa do paciente entre uma crise e outra, pode-se observar alteração na RM. A alteração mais comum é o hipersinal na substância cinzenta cortical e/ou na substância branca subcortical nas sequências ponderadas em T2, FLAIR e mesmo na difusão, podendo haver restrição, com ou sem realce pelo meio de contraste. Efeito expansivo frequentemente ocorre(9), como demonstrado na Figura 8. 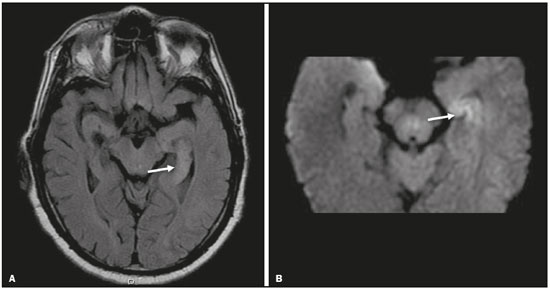 Figura 8. Edema pós-crise convulsiva. A: Axial FLAIR demonstrando hipersinal no hipocampo esquerdo com restrição à difusão (B). Os locais de acometimento variam e incluem o córtex e a substância branca subcortical, os hipocampos e lobos temporais mesiais e o tálamo, semelhante à encefalite herpética, sendo a história clínica fundamental nesses casos. O diagnóstico diferencial deve ser feito com tumores, devido ao efeito expansivo, sendo difícil descartar lesão tumoral associada quando as alterações de sinal se mantêm ao longo do tempo(9). TUMORES Os gliomas são os tumores primários do SNC mais frequentes. Possuem potencial maligno e de infiltração. São tumores que surgem das células da glia, podendo ser subdivididos em astrocitomas, oligodendrogliomas e ependimomas. Esses tumores geralmente são hipo/isointensos em sequências ponderadas em T1 e hiperintensos em sequências ponderadas em T2 e FLAIR, podendo ou não apresentar realce pelo meio de contraste. A restrição à difusão das moléculas de água varia de acordo com a celularidade do tumor(10). A Figura 9 demonstra um glioma sem restrição à difusão. Neoplasias de outras naturezas, como os tumores neurogliais, também podem acometer o lobo temporal mesial e devem entrar no diagnóstico diferencial. 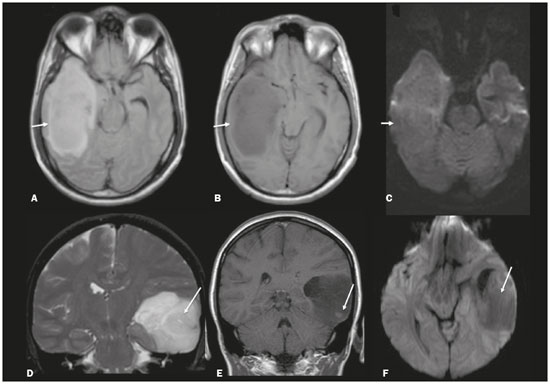 Figura 9. Glioma. A: FLAIR com hipersinal corticossubcortical no lobo temporal direito. B: Axial T1 mostrando hipossinal no lobo temporal direito com efeito expansivo. C: Difusão sem restrição. (A,B,C), paciente com astrocitoma de baixo grau. D: Coronal T2 demonstrando lesão expansiva no lobo temporal com espessamento cortical. E: Coronal T1 pós-contraste com foco de impregnação nodular. F: Difusão sem restrição. (D,E,F), paciente com ganglioglioma). ESCLEROSE MESIAL TEMPORAL É a causa mais comum de epilepsia resistente ao tratamento e tipicamente se manifesta com crises focais sem comprometimento da consciência. Na RM caracteriza-se por atrofia hipocampal, hipersinal em T2 e FLAIR, sem restrição à difusão e alterações morfológicas do hipocampo, podendo ser bilateral em até 10% dos casos(11). A Figura 10 exemplifica essas alterações. 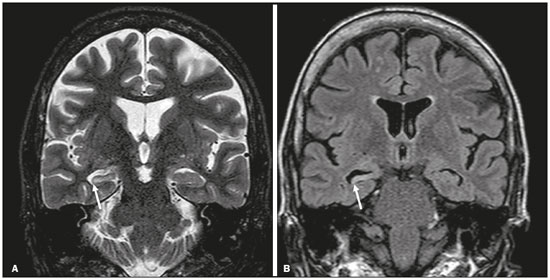 Figura 10. Esclerose mesial temporal. Sequências coronal T2 (A) e coronal FLAIR (B) demonstrando hipersinal, atrofia e perda das digitações do hipocampo direito. CONCLUSÃO É fundamental que os radiologistas saibam identificar as enfermidades que envolvem o lobo temporal, pois suas particularidades, resumidas na Tabela 1, auxiliam na identificação para o diagnóstico preciso. REFERÊNCIAS 1. Bulakbasi N, Kocaoglu M. Central nervous system infections of herpesvirus family. Neuroimaging Clin N Am. 2008;18:53–84. 2. Brightbill TC, Ihmeidan IH, Post MJ, et al. Neurosyphilis in HIVpositive and HIV-negative patients: neuroimaging findings. AJNR Am J Neuroradiol. 1995;16:703–11. 3. Rosa Júnior M, Caçador TA, Biasutti C, et al. Teaching neuroimages: skull and dural lesions in neurosyphilis. Neurology. 2016;87:e129–30. 4. Rocha AJ, Nunes RH, Maia Jr ACM, et al. Recognizing autoimmune- mediated encephalitis in the differential diagnosis of limbic disorders. AJNR Am J Neuroradiol. 2015;36:2196–205. 5. Lövblad KO, Anzalone N, Dörfler A, et al. MR imaging in multiple sclerosis: review and recommendations for current practice. AJNR Am J Neuroradiol. 2010;31:983–9. 6. Liem MK, Lesnik Oberstein SA, Haan J, et al. Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy: progression of MR abnormalities in prospective 7-year follow-up study. Radiology. 2008;249:964–71. 7. Fukutake T. Cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy (CARASIL): from discovery to gene identification. J Stroke Cerebrovasc Dis. 2011;20:85–93. 8. Romeo V, Pegoraro E, Ferrati C, et al. Brain involvement in myotonic dystrophies: neuroimaging and neuropsychological comparative study in DM1 and DM2. J Neurol. 2010;257:1246–55. 9. Kim JA, Chung JI, Yoon PH, et al. Transient MR signal changes in patients with generalized tonicoclonic seizure or status epilepticus: periictal diffusion-weighted imaging. AJNR Am J Neuroradiol. 2001;22:1149–60. 10. Upadhyay N, Waldman AD. Conventional MRI evaluation of gliomas. Br J Radiol. 2011;84 Spec No 2:S107–11. 11. Kasasbeh A, Hwang EC, Steger-May K, et al. Association of magnetic resonance imaging identification of mesial temporal sclerosis with pathological diagnosis and surgical outcomes in children following epilepsy surgery. J Neurosurg Pediatr. 2012;9:552–61. Hospital Universitário Cassiano Antônio de Moraes da Universidade Federal do Espírito Santo (HUCAM/UFES), Vitória, ES, Brasil a. https://orcid.org/0000-0003-4448-1531 b. https://orcid.org/0000-0003-2715-2859 c. https://orcid.org/0000-0001-8668-2804 Correspondência: Dr. Marcos Rosa Júnior Universidade Federal do Espírito Santo, Centro de Ciências da Saúde, Setor de Neurorradiologia Avenida Marechal Campos, 1355, Santa Cecília Vitória, ES, Brasil, 29043-260 E-mail: marcosrosajr@hotmail.com Recebido para publicação em 29/9/2018 Aceito, após revisão, em 22/3/2019 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554