Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 2 - Mar. / Abr. of 2020
Vol. 53 nº 2 - Mar. / Abr. of 2020
|
AVANÇOS EM RADIOLOGIA
|
|
|
|
|
Autho(rs): Renata Motta Gruberta; Tiago Kojun Tibanab; Larissa Araújo Missirianc; Thaline Mairace Hernandez das Nevesd; Thiago Franchi Nunese |
|
|
INTRODUÇÃO
A dor abdominal é um problema debilitante significativo e comum em pacientes oncológicos, afetando dramaticamente a qualidade de vida e a sobrevida(1,2). A dor que se origina das vísceras do abdome superior é transmitida por fibras aferentes viscerais que retransmitem os impulsos através dos nervos esplâncnicos e do plexo celíaco. O termo plexo celíaco refere-se a uma rede de fibras nervosas localizadas no retroperitônio, ao longo da parede anterolateral da aorta (Figura 1A)(2,3). 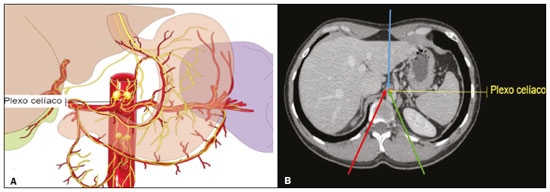 Figura 1. A: Ilustração demonstrando a localização do plexo celíaco. B: TC axial demonstrando algumas vias de acesso: anterior trans-hepática (seta azul), posterior transintervertebral (seta vermelha), posterior transaórtica (seta verde). O manejo da dor abdominal relacionada ao câncer é um tema complexo e desafiador e, muitas vezes, requer o uso crônico de opioides em altas doses, que, por sua vez, geralmente estão associados a vários efeitos adversos(1,2). Terapias instituídas utilizando métodos percutâneos guiados por métodos de imagem reduzem a necessidade de analgésicos potentes e a sua toxicidade associada, entretanto, esses procedimentos são pouco difundidos e subutilizados(1,4–8). A neurólise do plexo celíaco (NPC) é uma técnica que proporciona interrupção permanente da transmissão da dor do plexo por meio de ablação química, podendo potencialmente melhorar o controle da dor e, ao mesmo tempo, reduzir drasticamente o consumo de opioides(9,10). A NPC consiste na infusão de um agente neurolítico, geralmente álcool absoluto estéril, por meio de uma agulha fina inserida no retroperitônio, adjacente a fibras nervosas e gânglios do plexo celíaco. A medicação neurolítica interrompe a rede neural, destruindo as vias de dor(2,11). A orientação por imagem para a NPC é mais comumente realizada por tomografia computadorizada (TC), que vem substituindo o uso de técnicas guiadas por fluoroscopia ou ultrassonografia(2,12). PROCEDIMENTO O primeiro passo na NPC guiada por TC é o planejamento pré-procedimento. Imagens pré-operatórias devem ser revisadas detalhadamente com a finalidade de determinar a posição do paciente, o local da punção, o caminho da agulha e o local da injeção do neurolítico (Figura 1B). O planejamento garante que o agente seja adequadamente distribuído, aumenta o efeito analgésico e reduz a morbidade. O posicionamento adequado do paciente é essencial para um procedimento bem-sucedido, pois, além de determinar um trajeto percutâneo seguro, também garante o conforto do paciente. A NPC pode ser realizada por diferentes técnicas, como via anterior, via posterior, sendo a abordagem paravertebral posterior bilateral a mais frequentemente utilizada (Figura 2A). Procede-se a anestesia local no ponto da punção, sob sedação com benzodiazepínico ou opioide e oxigenoterapia por cateter nasal. 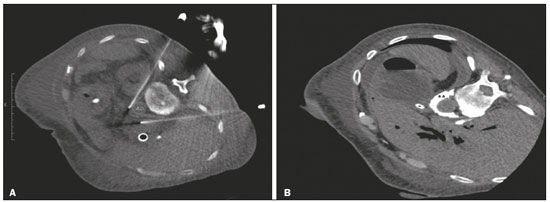 Figura 2. A: TC axial com paciente em decúbito oblíquo mostrando punção posterior paravertebral bilateral, adjacente à aorta (Ao), ao nível do tronco celíaco, utilizando agulha Chiba 22G. B: Correta distribuição da solução de álcool absoluto e contraste iodado (asteriscos). Após a punção guiada por TC e certificação do correto posicionamento da(s) agulha(s) com injeção ou não de 1–2 mL de contraste iodado, realiza-se a infusão com volume total de 40–60 mL de solução neurolítica de álcool absoluto (Figura 2B). Em nosso serviço, adicionalmente utilizamos 2–3 mL de lidocaína a 1% sem vasoconstritor antes e após a injeção do álcool. A NPC é uma ferramenta segura e eficaz para o manejo da dor paliativa, com taxa relativamente baixa de complicações. Deve ser oferecida a pacientes como um componente chave da abordagem multidisciplinar para o controle da dor abdominal crônica intratável. O uso apropriado e o conhecimento dos exames de imagem e da técnica são inestimáveis para garantir bons resultados. REFERÊNCIAS 1. Sindt JE, Brogan SE. Interventional treatments of cancer pain. Anesthesiol Clin. 2016;34:317–39. 2. Kambadakone A, Thabet A, Gervais DA, et al. CT-guided celiac plexus neurolysis: a review of anatomy, indications, technique, and tips for successful treatment. Radiographics. 2011;31:1599–621. 3. Cornman-Homonoff J, Holzwanger DJ, Lee KS, et al. Celiac plexus block and neurolysis in the management of chronic upper abdominal pain. Semin Intervent Radiol. 2017;34:376–86. 4. Nunes TF, Tibana TK, Santos RFT, et al. Percutaneous insertion of bilateral double J stent. Radiol Bras. 2019;52:104–5. 5. Tibana TK, Grubert RM, Santos RFT, et al. Percutaneous nephrostomy versus antegrade double-J stent placement in the treatment of malignant obstructive uropathy: a cost-effectiveness analysis from the perspective of the Brazilian public health care system. Radiol Bras. 2019;52:305–11. 6. Nunes TF, Tibana TK, Pereira MES, et al. Treatment of extrahepatic biliary fistulas using n-butyl cyanoacrylate. Radiol Bras. 2019; 52:174–5. 7. Meira MS, Barbosa PNVP, Bitencourt AGV, et al. Retrospective analysis of computed tomography-guided percutaneous nephrostomies in cancer patients. Radiol Bras. 2019;52:148–54. 8. Falsarella PM, Rocha RD, Rahal Junior A, et al. Minimally invasive treatment of complex collections: safety and efficacy of recombinant tissue plasminogen activator as an adjuvant to percutaneous drainage. Radiol Bras. 2018;51:231–5. 9. Wyse JM, Chen YI, Sahai AV. Celiac plexus neurolysis in the management of unresectable pancreatic cancer: when and how? World J Gastroenterol. 2014;20:2186–92. 10. Sachdev AH, Gress FG. Celiac plexus block and neurolysis: a review. Gastrointest Endosc Clin N Am. 2018;28:579–86. 11. Eisenberg E, Carr DB, Chalmers TC. Neurolytic celiac plexus block for treatment of cancer pain: a meta-analysis. Anesth Analg. 1995; 80:290–5. 12. Wang PJ, Shang MY, Qian Z, et al. CT-guided percutaneous neurolytic celiac plexus block technique. Abdom Imaging. 2006;31:710–8. Hospital Universitário Maria Aparecida Pedrossian da Universidade Federal de Mato Grosso do Sul (HUMAP-UFMS), Campo Grande, MS, Brasil a. https://orcid.org/0000-0001-6713-2575 b. https://orcid.org/0000-0001-5930-1383 c. https://orcid.org/0000-0001-5688-1028 d. https://orcid.org/0000-0002-6172-5465 e. https://orcid.org/0000-0003-0006-3725 Correspondência: Dr. Tiago Kojun Tibana Avenida Senador Filinto Müller, 355, Vila Ipiranga Campo Grande, MS, Brasil, 79080-190 E-mail: tiagotibana@hotmail.com Recebido para publicação em 16/1/2019. Aceito, após revisão, em 22/2/2019. |
|
GN1© Copyright 2024 - All rights reserved to Colégio Brasileiro de Radiologia e Diagnóstico por Imagem
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554