Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 1 - Jan. / Fev. of 2020
Vol. 53 nº 1 - Jan. / Fev. of 2020
|
ARTIGOS DE REVISÃO
|
|
|
|
|
Autho(rs): Bruno Cunha Fialho Cantarelli1,a; Rafael Santiago de Oliveira1,b; Aldo Maurici Araújo Alves1,c; Bruno Jucá Ribeiro1,d; Fernanda Velloni1,2,e; Giuseppe D’Ippolito1,f |
|
|
Descritores: Doença de Crohn; Ressonância Magnética; Tomografia computadorizada; Doenças inflamatórias intestinais; Intestino delgado. |
|
|
Resumo: INTRODUÇÃO
A doença de Crohn é um distúrbio inflamatório granulomatoso crônico de etiologia desconhecida e é caracterizada por inflamação transmural do trato gastrintestinal. O seu diagnóstico resulta da análise de dados clínicos (anamnese, exames físico e proctológico completos), estudos endoscópicos, radiológicos, laboratoriais e histológicos(1), sendo os estudos por imagem seccional, como a tomografia computadorizada (TC) e a ressonância magnética (RM), cada vez mais utilizados(2). Estudos contrastados baritados (por exemplo, o trânsito intestinal e o enema opaco), tradicionalmente utilizados no diagnóstico e manejo dos pacientes com doença de Crohn, perderam espaço para os métodos seccionais, que são capazes de avaliar não somente o comprometimento parietal intestinal transmural, mas também as frequentes complicações e manifestações extraintestinais associadas à doença (é conhecida a relação entre doenças inflamatórias intestinais e colangite esclerosante primária, por exemplo). Além disso, esses métodos têm demonstrado utilidade na avaliação da atividade inflamatória da doença, desde que se utilizem protocolos específicos de aquisição de imagens denominados enterografia por TC (entero-TC) e enterografia por RM (entero-RM). Sabe-se que a doença de Crohn é uma doença marcada por períodos de remissões e recidivas, sendo importante monitorar a intensidade da inflamação para avaliar a eficácia do tratamento, descartar complicações e prevenir a progressão(3). O estudo endoscópico tem sido considerado como método padrão ouro para a avaliação da atividade inflamatória, no entanto, é limitado principalmente por não permitir, rotineiramente, a avaliação de todo o intestino delgado e o diagnóstico de algumas das principais complicações da doença, obstáculos estes superados pelos métodos de imagem seccionais. O objetivo deste artigo é revisar as indicações, técnicas de exame, vantagens, desvantagens e características de imagem da entero-TC e entero-RM na avaliação da atividade inflamatória da doença de Crohn. ENTERO-TC A entero-TC consiste em uma TC do abdome total com protocolo direcionado para avaliação do intestino delgado. Ela difere da TC de abdome convencional em três aspectos: a) deve ser obtida com cortes finos que permitam realizar reconstruções multiplanares com elevada resolução espacial; b) as imagens são obtidas na fase de contrastação entérica, que ocorre entre 45 e 60 segundos após a injeção intravenosa do meio de contraste; c) é necessária a distensão das alças delgadas para uma adequada avaliação das suas paredes. Para isso, são utilizados meios de contrastes orais neutros, tais como água, leite, manitol, sorbitol e metilcelulose ou, preferencialmente, soluções com polietilenoglucol, por serem eficientes e mais bem aceitas pelos pacientes(4,5). A distensão intestinal é considerada satisfatória quando se obtém um calibre do intestino delgado maior que 2 cm(5,6). Enquanto os meios de contrastes neutros permitem identificar com maior precisão a mucosa intestinal(4), os contrastes orais positivos dificultam a avaliação da espessura e do realce da parede intestinal, e por esse motivo não devem ser utilizados. Exceção é feita quando há suspeita de fístulas ou perfurações, uma vez que extravasamentos são mais facilmente identificados com o uso do contraste oral positivo(5,6). O volume de contraste oral varia entre 1500–2000 mL, que deve ser administrado de maneira ritmada e constante durante 45–60 minutos antes do exame. Agentes pró-cinéticos podem ser empregados para garantir um adequado fluxo de contraste nas alças de delgado e obter uma adequada distensão. A utilização do meio de contraste iodado por via intravenosa é crucial para avaliar o estado da mucosa intestinal e a caracterização de complicações inerentes à doença, e deve ser administrado por meio de bomba injetora a um fluxo de 3–4 mL/s e volume de 100 a 150 mL. De modo geral, obtém-se apenas uma fase do exame (a fase de contrastação entérica), dispensando-se as fases sem contraste intravenoso ou as demais fases contrastadas mais tardias. Essa estratégia tem-se demonstrado eficiente e eficaz, permitindo manter a dose de radiação em níveis considerados seguros e aceitáveis, abaixo de 10 mSv(7–9). Como os pacientes com doença de Crohn geralmente são diagnosticados em idades precoces e requerem longo seguimento evolutivo com exames de imagem, a preocupação com a radiação é um fator crucial. Desmond et al. mostraram aumento de 77,2% de radiação em pacientes com doença de Crohn, dos quais 15% tiveram alta dose cumulativa de exposição, considerada maior que 75 mSv(10). Por essa razão, tanto o médico solicitante quanto o radiologista precisam estar familiarizados com estratégias disponíveis para minimizar a radiação o máximo possível. Baixas voltagem e amperagem que reduzem as doses de radiação sem prejudicar o desempenho diagnóstico do exame podem ser obtidas mediante modulação de dose automática, por exemplo(11). Outra estratégia se baseia na utilização de algoritmos de reconstrução que utilizam abordagens iterativas, já disponíveis em muitos modelos de equipamentos de praticamente todos os fabricantes, mantendo a qualidade da imagem e reduzindo a dose em até 35–72%(7,8,11), o que possibilita a realização do exame com exposição menor que 2 mSv. A entero-TC tem algumas vantagens quando comparada à entero-RM, destacando-se: a) é mais disponível; b) o tempo e o custo do exame são menores; c) os radiologistas estão geralmente mais familiarizados com este método; d) não há tanta suscetibilidade a artefatos de movimento (incluindo peristalse); e) demonstra melhor resolução espacial; f) usualmente não há necessidade de sedação; g) é segura para pacientes em uso de marca-passos e dispositivos metálicos. Por outro lado, a utilização de radiação ionizante, menor contraste entre as estruturas e o uso de meio de contraste com maior risco de nefrotoxicidade são suas principais desvantagens (Tabela 1)(12). A decisão de solicitar entero-TC ou entero-RM pode gerar dúvidas entre os médicos assistentes. Em estudo recente, Bruining et al.(13) listaram potenciais fatores que influenciam nessa escolha e incluem os seguintes a favor da entero-TC: a) pacientes com mais de 35 anos; b) na suspeita de sepse ou coleções intra-abdominais que podem necessitar intervenção; c) primeira enterografia em paciente com sintomas agudos; d) exclusão de outras causas de diarreia; e) quando houver contraindicação à RM. Já a entero-RM deve ser considerada quando houver entero- TC anterior, em pacientes jovens (até 35 anos) e gestantes; na avaliação da resposta terapêutica; em fases não agudas da doença; na suspeita de fístula perianal; e pacientes com alergia ao meio de contraste iodado. ENTERO-RM A RM para avaliação do intestino delgado tem sido, até recentemente, relegada a um papel secundário, principalmente pelos longos tempos de aquisição de imagens e frequentes artefatos de movimento, tanto respiratórios quanto peristálticos. No entanto, avanços tecnológicos tornaram o seu uso mais robusto, principalmente após o desenvolvimento de bobinas mais eficientes e sequências de pulso com curtos tempos de aquisição e elevada resolução espacial e temporal(2). A necessidade de distensão das alças intestinais para avaliação adequada das doenças do delgado é a mesma inerente à entero-TC, sendo realizada a administração de agentes de contraste tanto por via oral ou por via sonda nasojejunal, esta última chamada enteróclise. Embora a distensão na enteróclise seja superior quando comparada à administração oral, esta última é preferível pela maior disponibilidade, menores complexidade e custo e melhor aceitação pelos pacientes, além do fato de diversos estudos mostrarem não haver diferença significativa na detecção de doença inflamatória ativa entre as duas técnicas(9,14). Os contrastes usados na entero-RM são classificados de acordo com as propriedades de sinal nas sequências ponderadas em T1 e T2. Os negativos (agentes superparamagnéticos) têm baixo sinal nas duas ponderações, os positivos (por exemplo, óleo vegetal) têm alto sinal também nas duas ponderações, e os bifásicos variam de acordo com a ponderação. Os mais utilizados são os bifásicos que produzem baixo sinal em T1, otimizando a avaliação do realce da mucosa intestinal após a injeção intravenosa do meio de contraste, e alto sinal em T2, permitindo melhor avaliação anatômica e da progressão do contraste entérico. Entre eles estão os açúcares (sorbitol, manitol), água e polietilenoglucol, este último sendo o mais difundido e frequentemente utilizado (Figura 1). 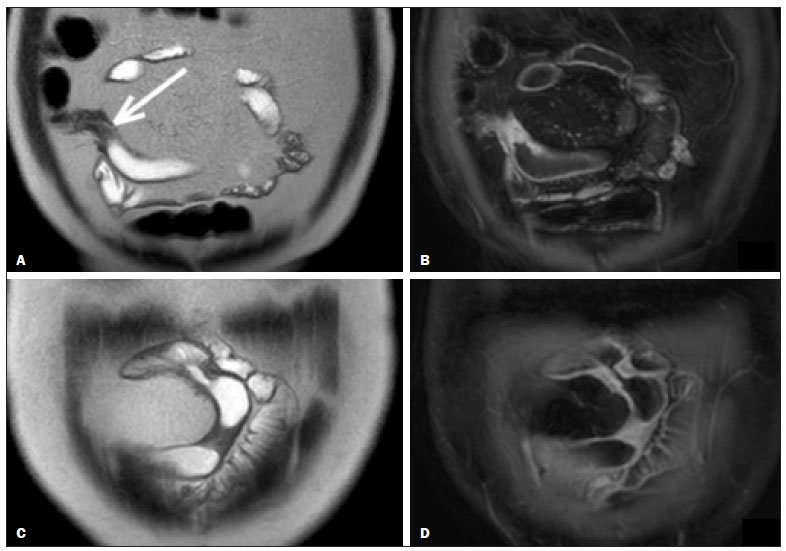 Figura 1. Imagens coronais de entero-RM ponderadas em T2 (A,B) e T1 após a administração de contraste paramagnético com saturação de gordura (C,D) mostrando sinais de fibrose e subestenose no íleo distal (seta) (A,C) e atividade inflamatória no íleo médio (B,D). Observar também a utilização do contraste oral bifásico (polietilenoglucol) distendendo o lúmen intestinal, com alto sinal em T2 e baixo sinal em T1. O meio de contraste paramagnético por via intravenosa é utilizado de rotina para a detecção de áreas de hiper-realce mucoso indicativo de atividade inflamatória da doença de Crohn. Uma sugestão de protocolo é a injeção de 0,2 mmol/kg de contraste paramagnético, em torno de 3 mL/s, iniciando as aquisições de imagem após 45 segundos da infusão do meio de contraste. O contraste oral é administrado de forma similar à descrita para a entero- TC. Por não utilizar radiação ionizante, é possível obter múltiplas aquisições pós-contraste sem a preocupação inerente aos efeitos deletérios da radiação, permitindo a avaliação dinâmica do realce, da distensibilidade e motilidade das alças intestinais(15). A preocupação deve existir, por outro lado, em relação à exposição contínua e cumulativa desses pacientes ao meio de contraste paramagnético, especialmente em pacientes pediátricos que realizarão múltiplas entero-RMs no seguimento da doença. Embora as consequências da retenção e acúmulo do gadolínio em diferentes tecidos do corpo não estejam bem estabelecidas(16), protocolos sem o uso do meio de contraste paramagnético são cada vez mais frequentes. Estudo recente avaliou o impacto do meio de contraste paramagnético na avaliação da doença de Crohn em pacientes pediátricos pela entero-RM, mostrando que ele não é necessário para a avaliação da atividade inflamatória do intestino delgado, embora seja importante na avaliação da doença penetrante perianal(17). Ao contrário da entero-TC, agentes antiespasmódicos são mais úteis na redução da peristalse e consequente redução dos artefatos de movimento, sendo os mais utilizados o glucagon e a butilescopolamina(2). No nosso meio, utiliza-se mais comumente a butilescopolamina por via intravenosa no início do exame. O exame requer a realização de sequências rápidas, ponderadas em T1 e T2, preferentemente durante uma única apneia. As sequências de difusão são também executadas, pois os achados observados com esta técnica de aquisição podem se correlacionar com a atividade inflamatória da doença – aspecto a ser abordado adiante –, usando-se os valores de “b” 50 e 900 s/mm2 em nosso serviço. A avaliação da motilidade das alças intestinais fornece maiores informações quando comparada à RM estática convencional, podendo ser obtida por aquisições dinâmicas denominadas popularmente de cine-RM, que utilizam sequências eco-gradiente ponderadas em T2(18). A entero-RM apresenta múltiplas vantagens em relação à entero-TC, conforme resumido na Tabela 1(15,19): a) não utiliza radiação ionizante, beneficiando pacientes que necessitem de um longo seguimento por imagem, além de poder ser realizado em gestantes (preferencialmente sem o uso intravenoso do meio de contraste); b) apresenta maior contraste entre as estruturas abdominais; c) tem a capacidade de realizar imagens funcionais e em tempo real, permitindo a diferenciação entre contração fisiológica ou estenose estabelecida; d) utiliza meio de contraste paramagnético em pacientes com alergia ao iodo. Outra vantagem da entero-RM é a sua superioridade na avaliação da doença inflamatória anorretal quando comparada com a entero-TC, por permitir uma melhor caracterização da extensão da doença ao canal anal(20). Na suspeita de doença perianal, estudos de RM dirigidos para a região fornecem informações precisas sobre a relação de fístulas com o complexo esfincteriano, as estruturas do assoalho pélvico e o músculo elevador do ânus. São realizadas sequências multiplanares com alta resolução orientadas de acordo com o eixo do canal anal, permitindo correta classificação do tipo de fístula e consequente melhor avaliação pré-operatória(21). As limitações da entero-RM são também conhecidas: menor disponibilidade; alto custo; maior tempo de exame; baixa resolução espacial e temporal; maior suscetibilidade a artefatos relacionados ao movimento; menor número de radiologistas com experiência para a sua interpretação(15,19) – este último item é relevante, considerando que estudos já mostraram que a experiência dos examinadores não tem impacto substancial na reprodutibilidade da avaliação dos pacientes com doença de Crohn pela entero-TC(22). CRITÉRIOS RADIOLÓGICOS INDICATIVOS DE ATIVIDADE INFLAMATÓRIA lgumas classificações foram desenvolvidas com o intuito de diferenciar fenótipos com comportamentos clínicos distintos da doença de Crohn. Dentre elas está a classificação de Montreal, que diferencia os fenótipos levando em consideração ausência ou presença de doença estenosante e penetrante, que frequentemente coexistem, e se há associação com fístula perianal(23). Embora tenham suas particularidades, os achados de imagem da atividade inflamatória da doença de Crohn observados na entero-RM e entero-TC são semelhantes. Vários aspectos devem ser avaliados em pacientes com diagnóstico ou suspeita de doença de Crohn: a) espessura da parede intestinal; b) atenuação/sinal da parede; c) intensidade e padrão do realce parietal; d) extensão de acometimento; e) presença de estenoses e dilatação pré- estenótica (Figuras 2 e 3); f) presença de lesões salteadas, características da doença de Crohn; g) presença de fístulas (Figuras 3 e 4) e abscessos, que configuram as principais complicações da doença; h) aumento da vascularização da vasa recta (denominado “sinal do pente”) (Figura 5); i) proliferação gordurosa, indicando cronicidade do processo inflamatório (Figura 6); j) identificação de adenopatia mesentérica; k) trombose venosa mesentérica; l) envolvimento extraintestinal da doença(13,24). 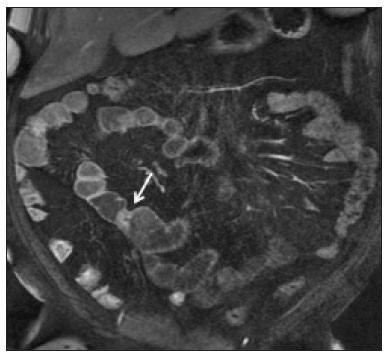 Figura 2. Imagem coronal de entero-RM, sequência ponderada em T1 com saturação de gordura, após a injeção de contraste paramagnético (gadolínio), mostrando espessamento parietal com estenose focal (seta) e dilatação do segmento pré-estenótico. 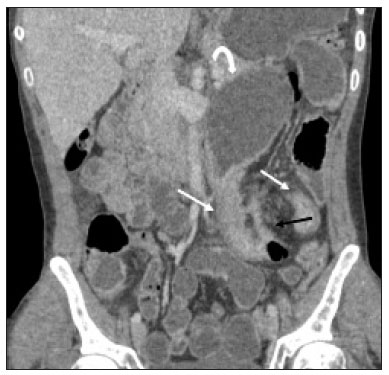 Figura 3. Imagem coronal de entero-TC pós-contraste mostrando espessamentos parietais estenosantes e salteados (setas brancas retas) com dilatação pré-estenótica (seta branca curva). Observa-se, ainda, trajeto fistuloso jejuno-jejunal parcialmente caracterizado na imagem, indicando doença penetrante (seta preta). 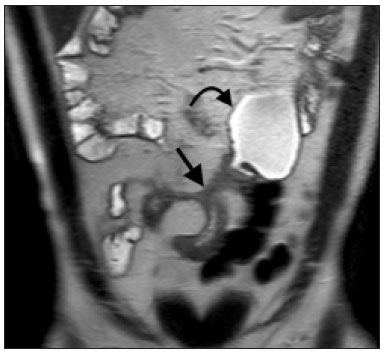 Figura 4. Imagem coronal de entero-RM ponderada em T2 mostrando estenose e fístula enteroentérica no íleo distal, assumindo aspecto “em trevo” (seta reta). Observar também a dilatação a montante do segmento pré-estenótico (seta curva). 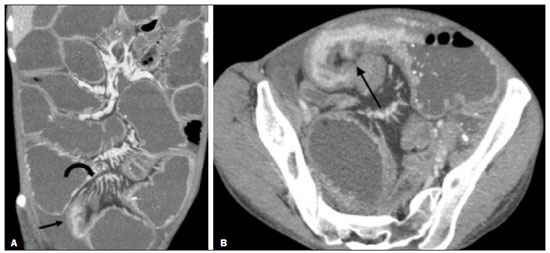 Figura 5. A: Imagem de entero-TC com reconstrução coronal, após injeção de contrastes oral e intravenoso, mostrando espessamento parietal estenosante com hiper-realce mucoso (seta reta) no íleo distal determinando obstrução com consequente dilatação difusa de alças a montante. Há ainda ingurgitamento dos vasos mesentéricos, conhecido como “sinal do pente” (seta curva). B: Imagem axial do mesmo paciente mostrando longo espessamento estenosante do íleo distal (seta). 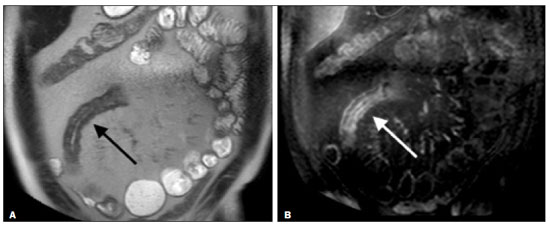 Figura 6. Imagens coronais de entero-RM ponderadas em T2 (A) e T1 após administração de contraste paramagnético com saturação de gordura (B) mostrando acometimento de longo segmento do íleo distal com estratificação das camadas (setas). Observar também proliferação gordurosa adjacente a este segmento, afastando-o das demais alças ileais. Quando há atividade inflamatória, o espessamento parietal do intestino delgado e/ou cólon é segmentar, assimétrico e descontínuo, associado à estratificação parietal causada pelo hiper-realce da mucosa e pelo edema submucoso. A espessura normal da parede do intestino delgado geralmente tem entre 2–3 mm quando seu lúmen está distendido, sendo considerada anormal sempre que exceder 4–5 mm. Quando espessada, pode ter sinal/atenuação homogêneo ou estratificado, este último caracterizado por alternância de sinal/atenuação entre as camadas parietais. O lúmen é considerado distendido quando exceder 2,5 cm de diâmetro, o que pode ocorrer pela própria técnica do exame, uma vez que se oferece grande volume líquido em curto espaço de tempo. Mudanças abruptas de calibre permitem identificar as áreas de estenose, que são caracterizadas por espessamento parietal que determina redução da luz intestinal, notando-se ainda a presença de dilatação a montante (estimada em mais que 3 cm)(13). O diagnóstico da estenose é crucial, já que na sua presença deve-se evitar a cápsula endoscópica pelo maior risco de retenção, estimado em até 13% dos pacientes com doença de Crohn(25). Alguns sinais indicam doença penetrante e inflamação mesentérica: a) fístulas, sejam elas simples ou complexas, estas últimas podendo caracterizar o “sinal do trevo” (Figura 4); b) fístulas perianais, quando se estendem do reto/ânus para a pele na região perineal ou vagina; c) abscessos e massas inflamatórias, estas últimas mal delimitadas e heterogêneas com sinal/atenuação de gordura e/ou partes moles; d) “sinal do pente”, representando o aumento da vascularização da vasa recta para as alças inflamadas (Figura 5); e) proliferação gordurosa (ou lipodistrofia reacional), usualmente observada ao redor das alças acometidas, caracterizada por hipertrofia da gordura que aumenta os espaços entre as alças; f) trombose venosa mesentérica, que pode ser aguda (trombo intraluminal) ou crônica, quando há afilamento das veias mesentéricas centrais com circulação colateral/varizes; g) adenopatia, quando são caracterizados linfonodos maiores que 1,5 cm no menor eixo axial; quando menores que 1,5 cm, são considerados reacionais e normais na doença de Crohn(13). Muitos desses achados não são específicos da doença de Crohn, podendo ser vistos em outras doenças, como enterite infecciosa, isquemia, vasculites, angioedema, mucosites, doença enxerto versus hospedeiro, entre outras. A especificidade aumenta quando esses sinais ocorrem na ausência de outros processos inflamatórios intra-abdominais (por exemplo, tuberculose, apendicite, diverticulite) e quando coexistem assimetria das alterações parietais e complicações penetrantes típicas da doença de Crohn(13). Estudo avaliando a atividade inflamatória da doença de Cronh e da fibroestenose mostrou boa correlação entre os achados da entero-TC e a análise histopatológica (r de Spearman = 0,7 e 0,6, respectivamente; p < 0,0001)(26). Nesse estudo, as variáveis que tiveram significância estatística foram hiper-realce mucoso (p = 0,04), espessamento parietal (p = 0,04), “sinal do pente” (p < 0,0001) e linfonodos aumentados (p = 0,016)(26). Estudos também demonstraram boa acurácia da entero-TC e entero-RM na avaliação das complicações da doença de Crohn, como estenoses, fístulas e abscessos. A sensibilidade e a especificidade da entero-TC e da entero- RM na avaliação da atividade inflamatória da doença de Crohn, em um estudo com 44 casos, foram semelhantes (85% e 92%, e 100% e 90%, respectivamente)(27). Graduando a atividade inflamatória da doença de Crohn Os métodos seccionais de imagem mostram boa eficácia no diagnóstico dos pacientes com doença de Crohn, mas a opção de tratamento e o seguimento desses pacientes dependem da gravidade da atividade inflamatória da doença. Muitos estudos vêm procurando validar um índice (ou escore) que seja capaz de representar o grau de inflamação da doença, para guiar adequadamente as decisões terapêuticas(28,29). Até o momento, não parece haver um índice universalmente aceito. A ileocolonoscopia tem sido considerada o padrão ouro para estabelecer a gravidade da doença e adota um índice bem estabelecido – Crohn’s disease endoscopic index of severity –, que considera presença ou ausência de quatro parâmetros endoscópicos (úlceras superficiais, úlceras profundas, estenoses ulceradas e estenoses não ulceradas), extensão e número de segmentos acometidos pela doença(30). Apresenta, no entanto, limitações, principalmente relacionadas ao fato de ser método invasivo, limitado à avaliação até o íleo distal e incapaz de avaliar a extensão extraluminal da doença. Estudo recente de metanálise avaliou a acurácia dos diferentes métodos de imagem (ultrassonografia, cintilografia, entero-RM e entero-TC) na avaliação do grau de gravidade da doença de Crohn. Os resultados mostraram superioridade da entero-TC (86%) e da entero-RM (84%) quando comparadas com a ultrassonografia (44%) e a cintilografia (40%)(28). Segundo os autores, não há sistema de escore amplamente aceito para graduar a atividade inflamatória da doença. Por outro lado, já foram validados escores como o de Clermont(31) e o índice de atividade por RM(32), que mostraram boa acurácia na detecção de ulcerações e na resposta terapêutica da doença de Crohn(33). Outro estudo recente propôs um índice que apresentou boa correlação com os resultados histopatológicos(29). Os autores avaliaram 16 pacientes que realizaram entero- RM e em seguida tiveram o intestino delgado ressecado, tendo sido avaliados os seguintes parâmetros: espessura da parede; intensidade de sinal da parede em T2 comparado ao intestino normal; sinal perimural em T2; “sinal do pente”; e dimensões/realce dos linfonodos (Tabela 2). Espessura da parede (p < 0,001), intensidade de sinal da parede em T2 (p < 0,001), realce da parede (p = 0,005), sinal perimural em T2 (p = 0,02) e “sinal do pente” (p = 0,06) foram estatisticamente significantes, enquanto padrão de realce, dimensões/realce linfonodais não tiveram significância estatística. Um estudo ainda mais recente avaliou o uso da difusão na predição da atividade inflamatória da doença no íleo distal, mostrando que ela apresenta boa acurácia na detecção de processo inflamatório em relação à identificação da inflamação na colonoscopia, com sensibilidade e especificidade de 88,8% e 95,0%, respectivamente, considerando um ponto de corte de 2,1 × 10–3 mm2/s para o ADC(34). Outros estudos também mostraram que a difusão tem potencial de aumentar substancialmente a reprodutibilidade interobservadores na avaliação desses pacientes(35), constituindo uma ferramenta útil no monitoramento terapêutico da doença de Crohn(36,37), além de ser um bom preditor do risco de retenção de cápsula endoscópica(38). CONCLUSÃO O manejo e o tratamento dos pacientes com doença de Crohn requerem uma adequada avaliação da extensão e gravidade das manifestações da doença, bem como da presença de sinais de atividade inflamatória aguda e possíveis complicações. Na avaliação e interpretação da doença de Crohn nos relatórios médicos pelo radiologista, bem como na escolha entre a utilização de entero-RM e entero-TC, alguns aspectos devem ser destacados com forte evidência(13): a) a doença de Crohn é provável quando houver hiper-realce e espessamento parietais e/ou quando a inflamação for assimétrica e coexistir com doença penetrante; b) devem ser reportados o número de segmentos acometidos, a localização aproximada, a extensão e o grau da dilatação pré-estenótica; c) a presença de sinais de inflamação parietal deve ser relatada quando houver doença penetrante (fístulas e abscessos); d) os métodos seccionais de imagem devem ser utilizados no diagnóstico da doença de Crohn para avaliar presença de doença penetrante e os segmentos não alcançados pelos métodos endoscópicos – nestes casos, esses métodos devem ser usados também no acompanhamento desses pacientes; e) a entero-RM e a entero-TC sempre devem incluir a região perianal na avaliação, porém, quando existentes, protocolos dirigidos para a avaliação de doença perianal devem ser realizados; f) pela associação com a gravidade dos achados endoscópicos, devem ser relatados hipersinal parietal em T2, restrição à difusão, densificação peri-intestinal, espessamento parietal e úlceras murais; g) presença de trombose venosa mesentérica e varizes do intestino delgado devem ser sempre avaliadas. Os métodos seccionais de imagem vêm ganhando cada vez mais espaço, tornando-se fundamentais no diagnóstico e seguimento dos pacientes com doença de Crohn, embora sejam limitados em estágios iniciais da doença, quando as lesões são ainda sutis e restritas à mucosa. Atualmente, a entero-TC é o método seccional de escolha na avaliação desses pacientes na maioria dos serviços de saúde, sendo o método preconizado pelo American College of Radiology na maioria das situações clínicas no âmbito da doença de Crohn(39), mas a entero-RM também tem mostrado acurácia bastante elevada. Estudos recentes demonstraram que a entero-RM tornou-se o padrão de referência na avaliação da atividade inflamatória da doença, principalmente nas manifestações perianais(40). Muitos estudos compararam a efetividade da entero- RM e entero-TC na detecção de doença de Crohn ativa, sugerindo que não há superioridade de nenhum desses métodos. A maioria dos autores observou qualidade de imagem e efetividade semelhantes(41–43), sendo importante considerar as vantagens e limitações de cada método, principalmente relacionadas à radiação da entero-TC e à maior suscetibilidade a artefatos da entero-RM. Sendo assim, no seguimento de longo prazo desses pacientes, a entero-RM é preferível por não utilizar radiação ionizante. Conhecer as principais indicações e contraindicações, vantagens e desvantagens e saber os principais parâmetros de imagem a serem avaliados não deve ser restrito ao médico radiologista. A entero-RM e a entero-TC são presente e futuro na avaliação da complexa doença de Crohn, têm papel crescente e devem ser cada vez mais familiares aos clínicos e cirurgiões. REFERÊNCIAS 1. Fiocchi C. Inflammatory bowel disease: etiology and pathogenesis. Gastroenterology. 1998;115:182–205. 2. Kim SH. Computed tomography enterography and magnetic resonance enterography in the diagnosis of Crohn’s disease. Intest Res. 2015;13:27–38. 3. D’Incà R, Caccaro R. Measuring disease activity in Crohn’s disease: what is currently available to the clinician. Clin Exp Gastroenterol. 2014;20;7:151–61. 4. Fletcher JG. CT enterography technique: theme and variations. Abdom Imaging. 2009;34:283–8. 5. D’Ippolito G, Braga FA, Resende MC, et al. Computed tomography enterography: a comparison of different neutral oral contrast agents. Radiol Bras. 2012;45:139–43. 6. Macari M, Megibow AJ, Balthazar EJ. A pattern approach to the abnormal small bowel: observations at MDCT and CT enterography. AJR Am J Roentgenol. 2007;188:1344–55. 7. Kambadakone AR, Prakash P, Hahn PF, et al. Low-dose CT examinations in Crohn’s disease: impact on image quality, diagnostic performance, and radiation dose. AJR Am J Roentgenol. 2010;195:78–88. 8. Lee SJ, Park SH, Kim AY, et al. A prospective comparison of standard-dose CT enterography and 50% reduced-dose CT enterography with and without noise reduction for evaluating Crohn disease. AJR Am J Roentgenol. 2011;197:50–7. 9. Negaard A, Paulsen V, Sandvik L, et al. A prospective randomized comparison between two MRI studies of the small bowel in Crohn’s disease, the oral contrast method and MR enteroclysis. Eur Radiol. 2007;17:2294–301. 10. Desmond AN, O’Regan K, Curran C, et al. Crohn’s disease: factors associated with exposure to high levels of diagnostic radiation. Gut. 2008;57:1524–9. 11. Huang MP, Liang CH, Zhao ZJ, et al. Evaluation of image quality and radiation dose at prospective ECG-triggered axial 256-slice multi-detector CT in infants with congenital heart disease. Pediatr Radiol. 2011;41:858–66. 12. Hammer MR, Podberesky DJ, Dillman JR. Multidetector computed tomographic and magnetic resonance enterography in children: state of the art. Radiol Clin North Am. 2013;51:615–36. 13. Bruining DH, Zimmermann EM, Loftus EV Jr, et al. Consensus recommendations for evaluation, interpretation, and utilization of computed tomography and magnetic resonance enterography in patients with small bowel Crohn’s disease. Radiology. 2018;286:776–99. 14. Schreyer AG, Geissler A, Albrich H, et al. Abdominal MRI after enteroclysis or with oral contrast in patients with suspected or proven Crohn’s disease. Clin Gastroenterol Hepatol. 2004;2:491–7. 15. Fidler JL, Guimaraes L, Einstein DM. MR imaging of the small bowel. Radiographics. 2009;29:1811–25. 16. McDonald RJ, McDonald JS, Kallmes DF, et al. Intracranial gadolinium deposition after contrast-enhanced MR imaging. Radiology. 2015;275:772–82. 17. Lanier MH, Shetty AS, Salter A, et al. Evaluation of noncontrast MR enterography for pediatric inflammatory bowel disease assessment. J Magn Reson Imaging. 2018;48:341–8. 18. Froehlich JM, Waldherr C, Stoupis C, et al. MR motility imaging in Crohn’s disease improves lesion detection compared with standard MR imaging. Eur Radiol. 2010;20:1945–51. 19. Fidler J. MR imaging of the small bowel. Radiol Clin North Am. 2007; 45:317–31. 20. Sahni VA, Ahmad R, Burling D. Which method is best for imaging of perianal fistula? Abdom Imaging. 2008;33:26–30. 21. Miguel Criado J, Salto LC, Rivas PF, et al. MR imaging evaluation of perianal fistulas: spectrum of imaging features. Radiographics. 2012;32:175–94. 22. Burlin S, Favaro LR, Bretas EAS, et al. Using computed tomography enterography to evaluate patients with Crohn’s disease: what impact does examiner experience have on the reproducibility of the method? Radiol Bras. 2017;50:13–8. 23. Silverberg MS, Satsangi J, Ahmad T, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol. 2005;19 Suppl A:5A–36A. 24. Gore RM, Balthazar EJ, Ghahremani GG, et al. CT features of ulcerative colitis and Crohn’s disease. AJR Am J Roentgenol. 1996;167: 3–15. 25. Fletcher JG, Fidler JL, Bruining DH, et al. New concepts in intestinal imaging for inflammatory bowel diseases. Gastroenterology. 2011; 140:1795–806. 26. Chiorean MV, Sandrasegaran K, Saxena R, et al. Correlation of CT enteroclysis with surgical pathology in Crohn’s disease. Am J Gastroenterol. 2007;102:2541–50. 27. Fiorino G, Bonifacio C, Peyrin-Biroulet L, et al. Prospective comparison of computed tomography enterography and magnetic resonance enterography for assessment of disease activity and complications in ileocolonic Crohn’s disease. Inflamm Bowel Dis. 2011;17:1073–80. 28. Puylaert CAJ, Tielbeek JAW, Bipat S, et al. Grading of Crohn’s disease activity using CT, MRI, US and scintigraphy: a meta-analysis. Eur Radiol. 2015;25:3295–313. 29. Steward MJ, Punwani S, Proctor I, et al. Non-perforating small bowel Crohn’s disease assessed by MRI enterography: derivation and histopathological validation of an MR-based activity index. Eur J Radiol. 2012;81:2080–8. 30. Mary JY, Modigliani R. Development and validation of an endoscopic index of the severity for Crohn’s disease: a prospective multicentre study. Groupe d’Etudes Thérapeutiques des Affections Inflammatoires du Tube Digestif (GETAID). Gut. 1989;30:983–9. 31. Buisson A, Joubert A, Montoriol PF, et al. Diffusion-weighted magnetic resonance imaging for detecting and assessing ileal inflammation in Crohn’s disease. Aliment Pharmacol Ther. 2013;37:537–45. 32. Rimola J, Ordás I, Rodriguez S, et al. Magnetic resonance imaging for evaluation of Crohn’s disease: validation of parameters of severity and quantitative index of activity. Inflamm Bowel Dis. 2011;17:1759–68. 33. Buisson A, Pereira B, Goutte M, et al. Magnetic resonance index of activity (MaRIA) and Clermont score are highly and equally effective MRI indices in detecting mucosal healing in Crohn’s disease. Dig Liver Dis. 2017;49:1211–7. 34. Durayski E, Watte G, Pacini GS, et al. Diffusion-weighted imaging and apparent diffusion coefficient values for evaluating terminal ileitis in patients with Crohn’s disease. Radiol Bras. 2019;52:361–7. 35. Kim JS, Jang HY, Park SH, et al. MR Enterography assessment of bowel inflammation severity in Crohn disease using the MR index of activity score: modifying roles of DWI and effects of contrast phases. AJR Am J Roentgenol. 2017;208:1022–9. 36. Huh J, Kim KJ, Park SH, et al. Diffusion-weighted MR enterography to monitor bowel inflammation after medical therapy in Crohn’s disease: a prospective longitudinal study. Korean J Radiol. 2017;18:162–72. 37. Klang E, Kopylov U, Eliakim R et al. Diffusion-weighted imaging in quiescent Crohn’s disease: correlation with inflammatory biomarkers and video capsule endoscopy. Clin Radiol. 2017;72:798.e7–798.e13. 38. Klang E, Kopylov U, Ben-Horin S, et al. Assessment of patency capsule retention using MR diffusion-weighted imaging. Eur Radiol. 2017;27:4979–85. 39. Kim DH, Carucci LR, Baker ME, et al. ACR appropriateness criteria Crohn disease. J Am Coll Radiol. 2015;12:1048–57. 40. Vermeire S, Ferrante M, Rutgeerts P. Recent advances: personalised use of current Crohn’s disease therapeutic options. Gut. 2013;62:1511–5. 41. Lee SS, Kim AY, Yang SK, et al. Crohn disease of the small bowel: comparison of CT enterography, MR enterography, and small-bowel follow-through as diagnostic techniques. Radiology. 2009;251:751–61. 42. Siddiki HA, FidlerJL, Fletcher JG, et al. Prospective comparison of state-of-the-art MR enterography and CT enterography in small-bowel Crohn’s disease. AJR Am J Roentgenol. 2009;193:113–21. 43. Jensen MD, Ormstrup T, Vagn-Hansen C, et al. Interobserver and intermodality agreement for detection of small bowel Crohn’s disease with MR enterography and CT enterography. Inflamm Bowel Dis. 2011;17:1081–8. 1. Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 2. Diagnósticos da América S/A, Barueri, SP, Brasil a. https://orcid.org/0000-0001-7042-6515 b. https://orcid.org/0000-0003-0838-3731 c. https://orcid.org/0000-0001-7310-5709 d. https://orcid.org/0000-0002-6947-1375 e. https://orcid.org/0000-0002-2019-7918 f. https://orcid.org/0000-0002-2701-1928 Correspondência: Dr. Bruno Cunha Fialho Cantarelli EPM-Unifesp – Departamento de Diagnóstico por Imagem Rua Napoleão de Barros, 800, Vila Clementino São Paulo, SP, Brasil, 04024-002 E-mail: brcantarelli@hotmail.com Recebido para publicação em 17/8/2018 Aceito, após revisão, em 20/2/2019 Data de Publicação: 25/11/2019 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554