Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 52 nº 4 - Jul. / Ago. of 2019
Vol. 52 nº 4 - Jul. / Ago. of 2019
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Pedro Henrique de Marqui Moraes1; Rosa Sigrist2; Marcelo Straus Takahashi3; Marcelo Schelini4; Maria Cristina Chammas5 |
|
|
Descritores: Glândula tireoide; Técnicas de imagem por elasticidade/métodos; Ultrassonografia/métodos; Nódulo da glândula tireoide/diagnóstico por imagem; Elastografia shear wave. |
|
|
Resumo: INTRODUÇÃO
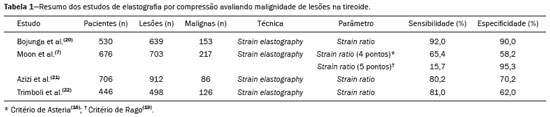
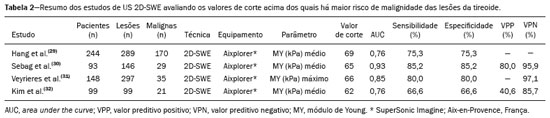
As técnicas de elastografia por ultrassom aproveitam a elasticidade dos tecidos em várias doenças para produzir informações qualitativas e quantitativas que podem ser usadas para fins de diagnóstico. As medições são adquiridas em modos de imagem especializados que podem detectar a rigidez do tecido em resposta a uma força mecânica aplicada (compressão ou onda de cisalhamento). Em geral, podem ser classificados em métodos de imagem por compressão, que utilizam estímulos de deformação internos ou externos, e imagens por onda de cisalhamento, que utilizam estímulos de onda de cisalhamento gerados por ultrassom(1). A elastografia foi criada em 1990 e vem sofrendo modificações e avanços tecnológicos que a tornam cada vez mais eficiente e reprodutível. A elastografia por ultrassonografia (US) hepática já é realidade na prática clínica diagnóstica na avaliação não invasiva da fibrose hepática. Concomitantemente, avanços na aplicação da elastografia na imagem de mama, próstata, linfonodos e tireoide estão surgindo(2). PRINCÍPIOS E TÉCNICAS DE ELASTOGRAFIA POR ULTRASSOM Existem dois módulos elásticos úteis à elastografia, que são definidos pelo método de deformação: o módulo de Young, que é definido quando um estresse externo produz uma tensão normal perpendicular à superfície, e o módulo de cisalhamento, quando um estresse de cisalhamento (dinâmico) produz tensão de geração de ondas de cisalhamento, tangencial à superfície. As ondas de cisalhamento têm movimento de partículas perpendicular à direção da propagação da onda, o que permite maiores diferenças entre os tecidos, dando contraste de tecido adequado para medição da elastografia (Figura 1). 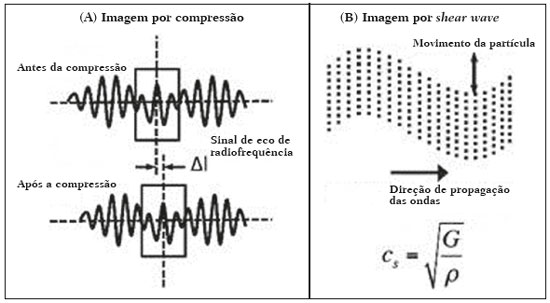 Figura 1. Física da elastografia por US, métodos de medição. Na imagem de tensão (A), o deslocamento do tecido é medido por correlação de sinais de eco de radiofrequência entre janelas de busca (caixas) nos estados antes e depois da compressão. Na imagem de onda de cisalhamento (B), o movimento de partículas é perpendicular à direção de propagação de ondas, com velocidade de onda de cisalhamento cs relacionada ao módulo de cisalhamento G. Nas primeiras técnicas de elastografia, conhecidas como strain ou elastografia por compressão, era necessário que o operador pressionasse a sonda ultrassônica sobre determinada região do corpo, provocando deformações nas diferentes estruturas internas dos tecidos (inversamente proporcionais à sua rigidez). Utilizando-se o módulo de Young, a imagem elastográfica era então formada pela razão entre a deformação causada nos diferentes meios acústicos dos tecidos e a força aplicada sobre os tecidos. Este método fornece medidas qualitativas sobre a rigidez do nódulo(3). A elastografia por compressão é imprecisa e com muitos vieses, tais como: compressão manual operador-dependente, com curva de aprendizado longa; limitações para avaliação de nódulos profundos e de nódulos próximos à artéria carótida, que poderiam sofrer variações de aferição pela sua pulsação; nódulos com diâmetro superior a 3 cm ou nódulos localizados no istmo poderiam não ter sua compressão adequada; nódulos com grandes áreas císticas ou calcificações grosseiras e em casca de ovo limitam a avaliação(3,4). Com o advento da técnica acoustic radiation force impulse (ARFI), as propriedades mecânicas dos tecidos passaram a ser avaliadas por meio de uma força de radiação acústica (dinâmica) gerada no aparelho ultrassonográfico (associada à propagação acústica das ondas nos diferentes meios) e não mais pela força gerada pelo operador no transdutor. Conforme a frequência acústica aumenta, há um deslocamento do tecido analisado, e este deslocamento gera uma onda de cisalhamento em paralelo e perpendicular ao eixo de aplicação da força. Medindo-se o quão rápido a onda chega a posições laterais diferentes, infere-se quantitativamente a rigidez do tecido estudado(5)(Figura 1). Os sistemas que utilizam a técnica ARFI são: a) 1D transient elastography – o já conhecido FibroScan (Echosens; Paris, França)(6), muito utilizado para avaliação de fibrose hepática; b) point-shear wave elastography (pSWE) – técnica em que a ARFI é utilizada para induzir o deslocamento do tecido na direção perpendicular em uma localização focal (único ponto), produzindo ondas de cisalhamento pela absorção de energia acústica. As velocidades das ondas de cisalhamento perpendiculares ao plano de excitação são medidas e diretamente relatadas (m/s) ou convertidas no módulo de Young E (kPa) e relatadas para fornecer uma estimativa quantitativa da elasticidade do tecido(5); c) elastografia por ondas de cisalhamento bidimensional (2D-SWE) – utilizando-se a força de radiação (ARFI) em várias zonas focais, cria-se uma onda de cisalhamento quase cilíndrica, permitindo o seu monitoramento em tempo real em 2D para mensuração da velocidade de onda de cisalhamento (m/s) ou módulo de Young E (kPa) e geração de elastogramas quantitativos. As vantagens desta técnica incluem a visualização em tempo real de um elastograma quantitativo de cores sobreposta a uma imagem em modo B(7), permitindo que o operador seja guiado por informações de rigidez anatômica e tecidual. Esta técnica com múltiplas zonas focais ARFI é conhecida hoje como método 2D-shear wave elastography (2D-SWE), ou apenas SWE (Figura 2)(8,9). 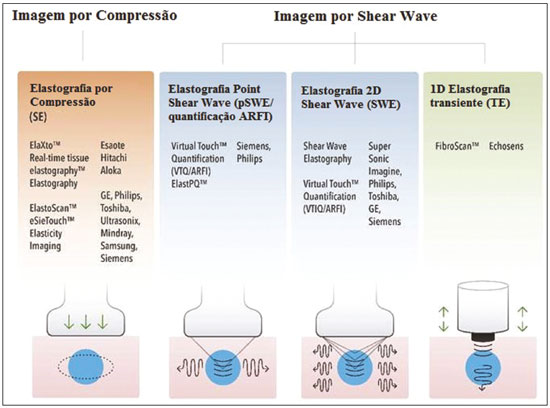 Figura 2. Técnicas de elastografia por US. As técnicas atualmente disponíveis podem ser categorizadas pela quantidade física medida: imagem por compressão (A) e imagem de onda de cisalhamento (B). Os métodos de excitação incluem deslocamento induzido mecanicamente quasi-estático via compressão externa ativa ou movimento fisiológico induzido passivamente (laranja), compressão induzida mecanicamente dinâmica por meio de um transdutor "batendo" na superfície do tecido para produzir ondas de cisalhamento (verde) e ultrassom dinâmico – deslocamento do tecido induzido e ondas de cisalhamento pela excitação do impulso da força da radiação acústica – ARFI (azul). APLICAÇÃO DA ELASTOGRAFIA NOS NÓDULOS TIREOIDIANOS Com o advento da US e o seu progressivo aprimoramento, a porcentagem de nódulos tireoidianos diagnosticados na população geral vem crescendo consideravelmente, chegando a uma prevalência de até 67% em estudos prospectivos de pacientes selecionados aleatoriamente(10,11). O padrão ouro para avaliação pré-operatória dos nódulos tireoidianos é a punção aspirativa por agulha fina (PAAF) com subsequente análise citológica. O objetivo da PAAF é identificar nódulos com maior risco de malignidade e que devem ser encaminhados para cirurgia, dos nódulos tireoidianos que devem ser seguidos clinicamente. Apesar da alta prevalência de nódulos tireoidianos, somente 4–8% dos nódulos amostrados por PAAF são malignos(12,13). A PAAF de todos os nódulos identificados ao ultrassom seria inviável a qualquer sistema de saúde. Por isso, critérios de malignidade foram estabelecidas pela US convencional (modo B) e US Doppler. Alguns critérios de risco para malignidade foram estabelecidos na US Doppler, tais como: hipoecogenicidade do nódulo (nódulos marcadamente hipoecogênicos têm ainda maior associação com malignidade), ausência de halo periférico hipoecogênico, presença de microcalcificações, diâmetro anteroposterior maior que o diâmetro laterolateral, contornos irregulares e margens mal definidas. No Doppler, a vascularização central maior que a periférica, ou apenas central, aumentam o risco para malignidade, bem como índices de resistividade elevados nas artérias que nutrem o nódulo(14). Há casos em que a PAAF não é capaz de classificar um nódulo tireoidiano como benigno ou maligno. Esse dilema clínico ocorre, por exemplo, nos casos de adenoma folicular da tireoide e de carcinoma folicular da tireoide(15). Até 15–30% das PAAFs são consideradas não diagnósticas ou indeterminadas(12). A repetição de PAAF fornece resultados conclusivos na maioria desses nódulos, mas os resultados não conclusivos são novamente obtidos em até 50% de nódulos com citologia inicial não diagnóstica e em 38,5–43% de nódulos com citologia indeterminada inicial(12). Embora alguns resultados inconclusivos da PAAF sejam atribuíveis a fatores técnicos, como a amostragem insuficiente, um subconjunto desses resultados deve-se ao dilema menos facilmente corrigido das neoplasias foliculares, que podem conter 6,7% dos resultados totais das PAAFs ou 22% dos resultados inconclusivos(13). As neoplasias foliculares são malignas em 15–30% dos casos, requerendo tireoidectomia total, mas a malignidade é difícil de ser definida pela PAAF ou mesmo na análise histológica por congelação(13,16). Nódulos tireoidianos têm sido avaliados com elastografia ao longo das últimas décadas, no intuito de realizar a distinção entre nódulos benignos e malignos antes da análise histológica, esperando-se, assim, reduzir o número de pacientes que necessitariam intervenção cirúrgica, com todas as comorbidades e custos associados(15,17). Estão descritas algumas limitações do método nos guidelines para aplicação da sonoelastografia na tireoide, tais como a presença de calcificações intralesionais, que são comuns e podem enviesar a rigidez do nódulo, e calcificações periféricas, que podem limitar a passagem do pulso de força de radiação acústica nas regiões mais profundas do nódulo. Além disso, os nódulos com áreas císticas extensas devem ser analisados com cautela pela elastografia por compressão, já que essas áreas podem gerar artefatos(8). Elastografia da tireoide pelo método de compressão Os estudos de imagem por elastografia por compressão na tireoide podem ser classificados pelos tipos de estímulos e pelo sistema de classificação. O estímulo mais comum é a compressão externa aplicada pelo operador por meio do transdutor de ultrassom. Alternativamente, o estímulo fisiológico que utiliza pulsações da artéria carótida para induzir o movimento da tireoide foi estudado com resultados encorajadores (Figura 3)(18). 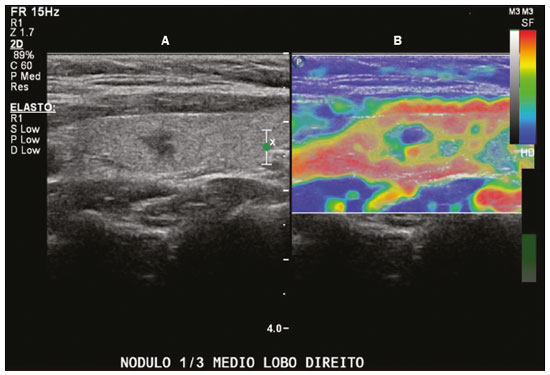 Figura 3. Imagem em modo B (A) e elastograma codificado por cores (B) de um nódulo tireoidiano no lobo direito, fotografado com elastografia por compressão. O nódulo aparece hipoecoico com contornos mal definidos na imagem anatômica em modo B. O elastograma mostra tecido tireoidiano normal codificado com a cor vermelha (tecido mole) e o nódulo com coloração azul (tecido rígido), sugerindo um nódulo maligno. Isto foi confirmado pela histologia, que mostrou carcinoma papilífero da tireoide. Existem dois escores de elasticidade qualitativa estabelecidos: o critério de Asteria, que utiliza uma escala de 1 a 4(16), e o critério de Rago, um escore de 5 pontos(19). O critério de Asteria baseia-se em quatro classes de rigidez tecidual: pontuação 1 para nódulos pouco rígidos; pontuações 2 e 3 para nódulos com grau intermediário de rigidez; pontuação 4 para lesões rígidas(16). O critério de Rago varia de pontuação 1 (mesma elasticidade em todo o nódulo) a 5 (sem elasticidade no nódulo e na área que mostra a sombra posterior)(19). Ambos os trabalhos comparam o padrão da elastografia com resultados citológicos após a PAAF e posterior confirmação dos casos malignos ou suspeitos para malignidade com resultado histológico após ressecção cirúrgica. Estudos usando elastografia por compressão para avaliar os nódulos tireoidianos mostraram resultados contraditórios. Uma metanálise, incluindo 639 nódulos tireoidianos, revelou que a elastografia por compressão era útil para avaliação de malignidade, com sensibilidade média de 92% e especificidade média de 90%(20). Esses achados foram desafiados pelos resultados de um estudo retrospectivo recente com 703 nódulos, que revelaram que a sensibilidade das medidas de imagem de deformação (15,7% para o critério de Rago de 5 pontos e 65,4% para o critério de Asteria de 4 pontos) era menor do que a do modo B (91,7%)(7). Mais recentemente, um estudo prospectivo com 912 nódulos descobriu que a elastografia por compressão era superior às características do ultrassom modo B na predição de malignidade, com sensibilidade de 80,2% e especificidade de 70,3%(21). Uma vez que o ultrassom modo B e a elastografia por compressão fornecem medidas independentes, a combinação dos métodos, hipoteticamente, seria superior na predição de malignidade. Essa hipótese foi testada por Trimboli et al., em estudo em que a combinação das duas modalidades mostrou sensibilidade de 97% e valor preditivo negativo de 97%, maiores que os com uso da elastografia isoladamente (sensibilidade de 81% e valor preditivo negativo de 91%) ou modo B apenas (sensibilidade de 85% e valor preditivo negativo de 91%)(22). Contradizendo o estudo de Trimboli et al., Moon et al. descobriram que a combinação de medições da elastografia por compressão e as características do ultrassom modo B eram inferiores ao uso do modo B isoladamente, para avaliação de malignidade(7) (Tabela 1). Esses resultados contraditórios podem ter ocorrido devido às diferentes técnicas utilizadas, equipamentos com calibrações diferentes, divergências em relação ao padrão ouro para análise estatística comparativa (citologia ou histologia) e critérios de exclusão utilizados nos vários estudos. Especificamente, a porcentagem de nódulos malignos da tireoide difere entre os estudos, variando de 9,4% registrada por Azizi et al.(21) a 31% encontrada por Moon et al.(7). Estudos prospectivos adicionais com maior tamanho de coorte são necessários para avaliar o valor clínico da elastografia por compressão na caracterização de nódulos tireoidianos. As seguintes limitações específicas para a elastografia por compressão foram destacadas na literatura: a compressão externa manual induz variabilidade do operador; a não linearidade da rigidez do tecido resulta em maiores medidas de rigidez em graus elevados de compressão; a fibrose dentro dos nódulos benignos e malignos pode aumentar a rigidez; estudos realizados com pequeno tamanho de amostra, com viés de seleção dos pacientes e falta de técnica padronizada (escala de cores de elastograma, valores de corte)(23,24). Elastografia da tireoide pelo método SWE Ao contrário da elastografia por compressão, a SWE de nódulos tireoidianos fornece medidas quantitativas da elasticidade do nódulo (Figura 4). 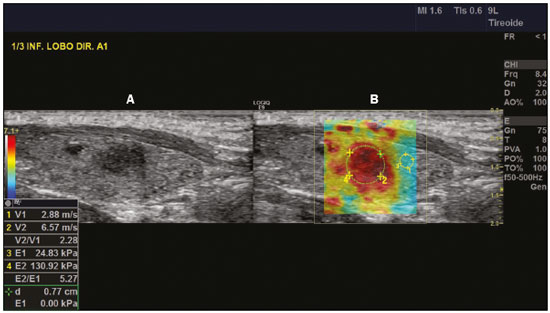 Figura 4. Imagem em modo B (A) mostra nódulo tireoidiano hipoecoico com margens mal definidas no lobo direito, sugerindo etiologia maligna. O elastograma colorido correspondente (B) mostra aumento da rigidez no nódulo (ROI: 130,92 kPa), comparado ao parênquima normal circundante (ROI: 24,83 kPa), sugerindo que o nódulo é maligno. Biópsia subsequente confirmou carcinoma papilífero. pSWE Uma série de metanálises recentes mostrou resultados promissores(25–28), com semelhanças entre os estudos. Zhan et al. incluíram estudos de pSWE e foram a maior metanálise (2436 nódulos tireoidianos); eles descreveram que o pSWE foi útil para distinguir nódulos benignos de malignos (sensibilidade média de 80%, especificidade média de 85%)(25). A metanálise de Dong et al. também incluiu estudos de pSWE e encontrou resultados igualmente bons (1617 nódulos tireoidianos; sensibilidade combinada de 86,3%, especificidade agrupada de 89,5%)(28). 2D-SWE Estudos mais recentes utilizando o método de 2D- SWE têm-se mostrado promissores na distinção entre nódulos tireoidianos benignos e malignos, com menos vieses e maior reprodutibilidade. Hang et al.(29), Sebag et al.(30), Veyrieres et al.(31) e Kim et al.(32) encontraram resultados muito semelhantes para valores de corte de índices de elasticidade dos nódulos, acima dos quais o risco para o diagnóstico de carcinoma é aumentado, variando entre 62 e 69 kPa. Esses resultados foram comparados com a citologia pós- PAAF e histologia para os casos malignos ou suspeitos para malignidade, mostrando sensibilidade que variou entre 66,6% e 85,2%, com especificidades entre 71,1% e 93,9% (Tabela 2). Um estudo prospectivo recente abordou se a 2D-SWE poderia distinguir entre neoplasias foliculares benignas e malignas(12). Nesse trabalho, 35 pacientes com nódulos de tireoide que tiveram diagnóstico de neoplasias foliculares pela PAAF foram avaliados com ultrassom modo B e 2D-SWE antes da cirurgia. Embora as características no modo B não sejam preditivas de malignidade folicular, estimativas mais elevadas do módulo de Young foram associadas a malignidade em nódulos com padrão folicular (AUC = 0,81; valor de corte = 22,3 kPa; sensibilidade = 82%; especificidade = 88%; valor preditivo positivo = 75%; valor preditivo negativo = 91%)(12). Ao contrário da elastografia por compressão, a técnica por ondas de cisalhamento está sujeita a uma menor variabilidade do operador, sendo mais reprodutível. No entanto, a falta de padronização da técnica e a calibração diferente oferecida pelos diversos fabricantes ainda é um empecilho para a difusão da modalidade. Um estudo recente avaliou 84 nódulos tireoidianos com as três principais técnicas de elastografia: elastografia por compressão, pSWE e 2D-SWE(33), comparando a análise com o resultado citológico e/ou histológico. O estudo concluiu que as técnicas que utilizam o ARFI apresentam resultados superiores na predição de risco para malignidade, com sensibilidade, especificidade e valor preditivo negativo de 90%, 79% e 98%, respectivamente. Essas técnicas mostraram uma diferença estatisticamente significante das AUCs, comparativamente à elastografia por compressão (p = 0,008). O estudo atribui esta superioridade à maior dependência do operador nas técnicas de elastografia por compressão. Na literatura existem vários valores de corte diferentes propostos para a distinção entre nódulos tireoidianos benignos e malignos com os três métodos de elastografia. Essas discrepâncias são explicadas pelo fato de que existem vários critérios para a seleção dos mais apropriados valores de corte em um teste de diagnóstico. O cálculo de um valor de corte depende da prevalência dos nódulos tireoidianos malignos, da população do estudo e do tamanho da amostra de nódulos. Nenhum consenso foi estabelecido na literatura até a presente data. Reprodutibilidade Os primeiros trabalhos que avaliaram a concordância interobservador da elastografia na avaliação do câncer da tireoide, utilizando a técnica de elastografia por compressão, demonstraram resultados inferiores em relação à US convencional(34). Desde então, vários outros estudos relatam a reprodutibilidade da elastografia nas técnicas de compressão e SW. A maioria deles mostrou concordância substancial ou quase perfeita. A notável melhoria na concordância interobservador pode ser explicada pelo aprimoramento dos aparelhos de sonoelastografia por compressão, com o advento do monitor da força de compressão em tempo real, reduzindo a sobrecompressão ou subcompressão, o que anteriormente influenciava na pontuação elastográfica. Em segundo lugar, a SW eliminou o viés da compressão manual, resultando em maior reprodutibilidade(34). CONCLUSÃO A elastografia tem-se mostrado uma ferramenta adicional na estratificação de risco para nódulos tireoidianos. A evolução da técnica permitiu maior reprodutibilidade e novos trabalhos utilizando 2D-SW têm-se mostrado promissores na determinação de nódulos malignos, quer seja antes da realização da PAAF ou após um resultado citológico indeterminado. No Brasil, a técnica de compressão é a mais difundida para estruturas superficiais, incluindo a tireoide. Alguns centros realizam a técnica SW como método complementar na análise do risco dos nódulos tireoidianos. As perspectivas para uso na prática clínica indicam a necessidade de padronização da técnica, a fim de permitir a comparação de valores entre estudos e o desenvolvimento de novas soluções para as limitações técnicas atuais. REFERÊNCIAS 1. Sigrist RMS, Liau J, Kaffas AE, et al. Ultrasound elastography: review of techniques and clinical applications. Theranostics. 2017;7: 1303–29. 2. Kamaya A, Machtaler S, Safari Sanjani S, et al. New technologies in clinical ultrasound. Semin Roentgenol. 2013;48:214–23. 3. Ophir J, Céspedes I, Ponnekanti H, et al. Elastography: a quantitative method for imaging the elasticity of biological tissues. Ultrason Imaging. 1991;13:111–34. 4. Palmeri ML, Nightingale KR. What challenges must be overcome before ultrasound elasticity imaging is ready for the clinic? Imaging Med. 2011;3:433–44. 5. Nightingale K. Acoustic radiation force impulse (ARFI) imaging: a review. Curr Med Imaging Rev. 2012;7:328–39. 6. Ferraioli G, Tinelli C, Dal Bello B, et al. Accuracy of real-time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: a pilot study. Hepatology. 2012;56:2125–33. 7. Moon HJ, Sung JM, Kim EK, et al. Diagnostic performance of gray-scale US and elastography in solid thyroid nodules. Radiology. 2012;262:1002–13. 8. Cosgrove D, Piscaglia F, Bamber J, et al. EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 2: clinical applications. Ultraschall Med. 2013;34:238–53. 9. Ferraioli G, Tinelli C, Malfitano A, et al. Performance of real-time strain elastography, transient elastography, and aspartate-to-platelet ratio index in the assessment of fibrosis in chronic hepatitis C. AJR Am J Roentgenol. 2012;199:19–25. 10. Tan GH, Gharib H. Thyroid incidentalomas: management approaches to nonpalpable nodules discovered incidentally on thyroid imaging. Ann Intern Med. 1997;126:226–31. 11. Topliss D. Thyroid incidentaloma: the ignorant in pursuit of the impalpable. Clin Endocrinol (Oxf). 2004;60:18–20. 12. Samir AE, Dhyani M, Anvari A, et al. Shear-wave elastography for the preoperative risk stratification of follicular-patterned lesions of the thyroid: diagnostic accuracy and optimal measurement plane. Radiology. 2015;277:565–73. 13. Faquin WC, Wong LQ, Afrogheh AH, et al. Impact of reclassifying noninvasive follicular variant of papillary thyroid carcinoma on the risk of malignancy in the Bethesda System for Reporting Thyroid Cytopathology. Cancer Cytopathol. 2016;124:181–7. 14. Chammas MC, Gerhard R, de Oliveira IRS, et al. Thyroid nodules: evaluation with power Doppler and duplex Doppler ultrasound. Otolaryngol Head Neck Surg. 2005;132:874–82. 15. Cibas ES, Ali SZ. The 2017 Bethesda System for Reporting Thyroid Cytopathology. J Am Soc Cytopathol. 2017;6:217–22. 16. Asteria C, Giovanardi A, Pizzocaro A, et al. US-elastography in the differential diagnosis of benign and malignant thyroid nodules. Thyroid. 2008;18:523–31. 17. El-Hariri MA, Taha Ali TF, Tawab MA, et al. The clinical value of ultrasound elastography in predicting malignant thyroid nodules. Egypt J Radiol Nucl Med. 2014;45:353–9. 18. Bae U, Dighe M, Shamdasani V, et al. Thyroid elastography using carotid artery pulsation: a feasibility study. Proc IEEE Ultrason Symp. 2006;1:614–7. 19. Rago T, Vitti P, Chiovato L, et al. Role of conventional ultrasonography and color flow-doppler sonography in predicting malignancy in ''cold'' thyroid nodules. Eur J Endocrinol. 1998;138:41–6. 20. Bojunga J, Herrmann E, Meyer G, et al. Real-time elastography for the differentiation of benign and malignant thyroid nodules: a meta-analysis. Thyroid. 2010;20:1145–50. 21. Azizi G, Keller JM, Mayo ML, et al. Thyroid nodules and shear wave elastography: a new tool in thyroid cancer detection. Ultrasound Med Biol. 2015;41:2855–65. 22. Trimboli P, Guglielmi R, Monti S, et al. Ultrasound sensitivity for thyroid malignancy is increased by real-time elastography: a prospective multicenter study. J Clin Endocrinol Metab. 2012;97:4524–30. 23. Cantisani V, Grazhdani H, Drakonaki E, et al. Strain US elastography for the characterization of thyroid nodules: advantages and limitation. Int J Endocrinol. 2015;2015:908575. 24. Cantisani V, Lodise P, Grazhdani H, et al. Ultrasound elastography in the evaluation of thyroid pathology. Current status. Eur J Radiol. 2014;83:420–8. 25. Zhan J, Jin JM, Diao XH, et al. Acoustic radiation force impulse imaging (ARFI) for differentiation of benign and malignant thyroid nodules—a meta-analysis. Eur J Radiol. 2015;84:2181–6. 26. Liu BJ, Li DD, Xu HX, et al. Quantitative shear wave velocity measurement on acoustic radiation force impulse elastography for differential diagnosis between benign and malignant thyroid nodules: a meta-analysis. Ultrasound Med Biol. 2015;41:3035–43. 27. Lin P, Chen M, Liu B, et al. Diagnostic performance of shear wave elastography in the identification of malignant thyroid nodules: a meta-analysis. Eur Radiol. 2014;24:2729–38. 28. Dong FJ, Li M, Jiao Y, et al. Acoustic radiation force impulse imaging for detecting thyroid nodules: a systematic review and pooled meta-analysis. Med Ultrason. 2015;17:192–9. 29. Hang J, Xue HY, Deng HY, et al. Investigation of the maximum Young''s modulus of thyroid nodules using two-dimensional shear wave elastography in thyroid nodules. Biomed Res. 2017;28:3537–44. 30. Sebag F, Vaillant-Lombard J, Berbis J, et al. Shear wave elastography: a new ultrasound imaging mode for the differential diagnosis of benign and malignant thyroid nodules. J Clin Endocrinol Metab. 2010;95:5281–8. 31. Veyrieres JB, Albarel F, Lombard JV, et al. A threshold value in shear wave elastography to rule out malignant thyroid nodules: a reality? Eur J Radiol. 2012;81:3965–72. 32. Kim H, Kim JA, Son EJ, et al. Quantitative assessment of shear-wave ultrasound elastography in thyroid nodules: diagnostic performance for predicting malignancy. Eur Radiol. 2013;23:2532–7. 33. Kyriakidou G, Friedrich-Rust M, Bon D, et al. Comparison of strain elastography, point shear wave elastography using acoustic radiation force impulse imaging and 2D-shear wave elastography for the differentiation of thyroid nodules. PLoS One. 2018;13:e0204095. 34. Park SH, Kim SJ, Kim EK, et al. Interobserver agreement in assessing the sonographic and elastographic features of malignant thyroid nodules. AJR Am J Roentgenol. 2009;193:W416–23. 1. Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil; https://orcid.org/0000-0003-0650-8342 2. Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil; https://orcid.org/0000-0002-5780-4136 3. Instituto da Criança do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (ICr/HC-FMUSP), São Paulo, SP, Brasil; https://orcid.org/0000-0001-9489-2844 4. Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil; https://orcid.org/0000-0003-3509-883X 5. Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil; https://orcid.org/0000-0001-7041-3079 Correspondência: Dr. Pedro Henrique de Marqui Moraes InCor/HC-FMUSP Rua Doutor Ovídio Pires de Campos, 75, Cerqueira César São Paulo, SP, Brasil, 05403-010 E-mail: pedrohenrique.mmoraes@gmail.com Recebido para publicação em 23/7/2018. Aceito, após revisão, em 9/11/2018. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554