Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 52 nº 4 - Jul. / Ago. of 2019
Vol. 52 nº 4 - Jul. / Ago. of 2019
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Luciana Karla Lira França1; Almir Galvão Vieira Bitencourt2; Fabiana Baroni Alves Makdissi3; Carla Curi4; Juliana Alves de Souza5; Elvira Ferreira Marques6 |
|
|
Descritores: Neoplasias de mama; Ressonância magnética; Estadiamento de neoplasias; Mama/diagnóstico por imagem. |
|
|
Resumo: INTRODUÇÃO
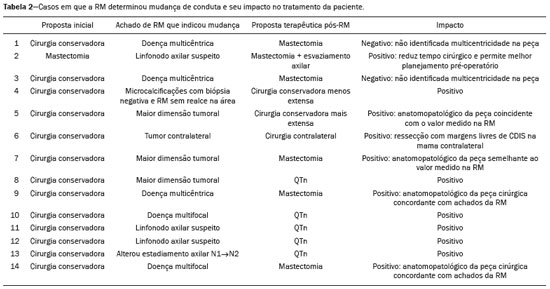
Câncer de mama é a principal causa de morte por neoplasia em mulheres no Brasil, atingindo, em 2013, taxa de mortalidade ajustada pela população mundial de 12,66/100.000 mulheres, e sua magnitude justifica crescentes esforços em aprimorar os métodos de diagnóstico e tratamento(1). A propedêutica básica das pacientes inclui exame clínico, mamografia e ultrassonografia (US) para definir a extensão da doença(2). Atualmente, a cirurgia conservadora é a conduta padrão no câncer de mama inicial, pois, associada a radioterapia, proporciona taxa de sobrevida semelhante à da mastectomia, desde que haja adequada seleção das pacientes. Neste cenário, a ressonância magnética (RM) das mamas ganha destaque, pois possui sensibilidade acima de 90% e é superior aos métodos de imagem convencionais na mensuração do tumor e identificação de lesões adicionais(3,4), permitindo, ainda, identificar focos adicionais em 12,0–31,2% das pacientes na mama ipsilateral e em 3–10% na contralateral, modificando o tratamento em até um terço das pacientes com câncer de mama(5–7). É importante salientar que o câncer de mama é uma entidade clínica heterogênea e não deve ser avaliado como uma doença única, já que diferentes subtipos histológicos e moleculares possuem diferenças quanto aos aspectos de imagem, prognóstico e resposta terapêutica, sendo conveniente que os estudos que avaliem a RM das mamas sejam individualizados para cada subtipo, a fim de se definir em quais cenários o método de imagem tem melhor desempenho. Por exemplo, o carcinoma lobular invasivo (CLI) é um tipo histológico que apresenta maiores taxas de multicentricidade e bilateralidade, de forma que sua extensão tem maior probabilidade de ser subestimada pelos métodos de imagem convencionais, favorecendo o uso da RM pré-operatória no estadiamento(8). Atualmente, além do tipo histológico, o subtipo molecular tem sido cada vez mais utilizado para definir a conduta nos pacientes com câncer de mama. Os subtipos moleculares determinam o comportamento biológico da doença, seja no aspecto de imagem, tendência à multicentricidade e bilateralidade ou prognóstico, devendo-se encorajar a pesquisa direcionada para os subgrupos(9). O objetivo do presente estudo foi avaliar o impacto do uso da RM quanto à mudança de conduta terapêutica no câncer de mama, correlacionando com tipo histológico e subtipo molecular dos tumores. MATERIAIS E MÉTODOS Estudo de corte transversal, com coleta prospectiva dos dados, unicêntrico, em que foram incluídas pacientes com diagnóstico de carcinoma mamário e RM de mamas para estadiamento locorregional no período de agosto de 2015 a abril de 2016. Nesse período, foram avaliadas 69 pacientes com neoplasia mamária submetidas a RM das mamas antes do tratamento. Destas, seis foram excluídas por terem realizado parte do tratamento em outro serviço, uma por não ter dados dos exames disponíveis no prontuário e uma por não apresentar lesão detectável aos métodos de imagem convencionais. Dessa forma, 61 pacientes foram incluídas no estudo, sendo avaliados dados sobre características demográficas, antecedentes pessoal e familiar de câncer, achados do exame físico, exames de imagem, dados histopatológicos e imuno-histoquímicos. As imagens de RM foram adquiridas em aparelho Signa HDxt de 1,5 tesla (GE Healthcare; Milwaukee, WI, USA) usando bobina dedicada. Foram realizadas sequência pré- contraste gradiente-eco em T1, tridimensional (3D), axial, com cortes de 2,5 mm de espessura, e sequência T2/STIR, pré-contraste, sagital, de ambas as mamas, com cortes de 4 mm de espessura. Para o estudo dinâmico foram obtidas cinco sequências gradiente-eco em T1, 3D, no plano axial, com supressão de gordura. A primeira foi adquirida antes da injeção do contraste, a segunda, após 20 segundos da injeção do contraste (20 mL do contraste paramagnético gadopentato dimeglumine, velocidade de 3 mL/s), e as demais, sucessivamente, nos minutos seguintes. Dessas imagens dinâmicas são geradas imagens pós-processamento, subtraindo-se a imagem pré-contraste das imagens pós-contraste para melhorar a visualização das áreas de realce. A última sequência são imagens gradiente-eco em T1, pós-contraste, 3D, no plano sagital, de ambas as mamas, com cortes de 1 mm de espessura e saturação de gordura. O diagnóstico histopatológico de câncer de mama foi confirmado por meio de biópsia percutânea antes do início do tratamento, sendo os dados referentes aos subtipos histológicos e moleculares obtidos dos relatórios do departamento de anatomia patológica da instituição. As RMs foram avaliadas por dois radiologistas com experiência em imagem da mama, para caracterização da lesão principal e pesquisa de lesões adicionais, de acordo com os critérios estabelecidos pelo Breast Imaging Reporting and Data System (BI-RADS)(10). Um mastologista revisou dados de exame clínico, mamografia, US e anatomopatológico da biópsia e foi questionado sobre qual o tratamento indicado, sem as informações da RM. Após a apresentação dos dados da RM, o mastologista foi novamente questionado sobre a conduta final proposta, baseada no manual de condutas da instituição. Em seguida, as condutas pré-RM e pós-RM foram confrontadas para determinar se houve mudança. Dois avaliadores revisaram os casos para definir se a RM determinou impacto, a seguir definido: • Sem impacto: achados de RM coincidentes com exame físico, mamografia e US, ou que não modificaram o tratamento indicado. • Impacto positivo: a RM detectou lesão adicional ou maior tamanho do tumor, determinando mudança na conduta que tenha se mostrado apropriada após estudo anatomopatológico final. • Impacto negativo: a RM induziu procedimento cirúrgico mais extenso, sendo encontrado falso-positivo ou lesão menor ao estudo anatomopatológico final. Os dados obtidos foram submetidos a análise estatística no programa SPSS versão 20.0 (IBM Corp., Armonk, NY, EUA). A análise descritiva das variáveis categóricas foi realizada com base no cálculo das frequências simples e relativas. As variáveis numéricas foram descritas como média, desvio-padrão, mínimo e máximo. Para avaliação do tamanho do tumor principal, foi considerada a medida do maior eixo avaliado pela RM e exames convencionais, e essa medida foi comparada à maior medida do tamanho do tumor descrito no laudo anatomopatológico da peça cirúrgica. Foi realizada análise multivariada para pesquisa dos fatores relacionados à mudança de conduta. Foi considerada estatisticamente significante a probabilidade de erro tipo I menor ou igual a 5% (p ≤ 0,05). RESULTADOS A média de idade das pacientes foi 50,8 anos, com variação entre 30 e 74 anos (desvio-padrão: 12,0). Na amostra, 27 (44,3%) pacientes tinham idade < 50 anos no momento do diagnóstico. O carcinoma mamário invasor do tipo não especial foi o subtipo histológico mais frequente (n = 42; 68,9%), seguido pelo CLI (n = 6; 9,8%), carcinoma ductal in situ (CDIS) (n = 4; 6,6%) e outros tipos especiais (n = 9; 14,8%). O subtipo molecular dos carcinomas invasivos com maior frequência foi luminal B (n = 28; 45,9%), seguido pelos luminal A (n = 12; 19,7%), triplo negativo (n = 10; 16,4%) e HER-2 (n = 7; 11,5%). A lesão índex se apresentou na RM como nódulo em 50 (82%) pacientes, realce não nodular em 10 (16,4%) e negativa em 1 (1,6%), sendo esta lesão identificada na mamografia (calcificações) e com anatomopatológico de CDIS. O tamanho médio das lesões na RM foi 29,9 mm (variação: 5–102 mm). A RM identificou lesão adicional ipsilateral em 13 (21,3%) dos 61 casos e linfonodo não habitual não previamente caracterizado em 5 (8,2%). Na mama contralateral, a RM demonstrou alteração suspeita em 5 (8,2%) casos. Do total de lesões adicionais identificadas na RM e submetidas a estudo anatomopatológico antes da instituição da terapêutica (7 lesões), 2 (28,5%) foram confirmadas como neoplásicas, sendo 1 caso de CDIS e 1 caso de linfonodo axilar com citologia positiva para malignidade. Das 5 pacientes com achado suspeito contralateral (BI-RADS 4), 4 (80%) foram submetidas a US second look e em apenas 1 delas não houve achado correspondente (Tabela 1). Em uma (20%) lesão contralateral suspeita identificada, o diagnóstico histológico foi CDIS (Figura 1). A paciente com second look negativo recebeu tratamento da mama índex e está em seguimento, constatando-se desaparecimento da lesão contralateral, sem recrudescimento, após dois anos de acompanhamento. A paciente cuja lesão contralateral não foi investigada foi submetida a quimioterapia neoadjuvante (QTn) e, embora tenha obtido resposta parcial na mama índex, o achado contralateral não foi observado nos controles de acompanhamento de dois anos. 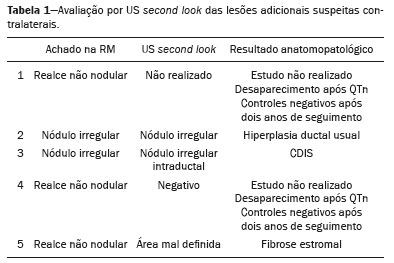 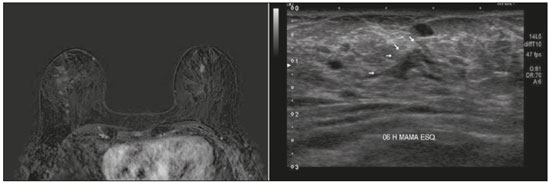 Figura 1. RM Ponderação T1 com saturação de gordura e subtração mostrando realce não nodular na mama direita, com diagnóstico estabelecido (CLI), e nódulo irregular à esquerda, não caracterizado nos exames de imagem convencionais mas que, na US second look foi identificado nódulo irregular intraductal, com correspondência com o achado da RM. Diagnóstico histológico de CDIS. A RM determinou mudança de conduta em 14 pacientes (23%), sendo 5 (8,2%) indicadas para mastectomia, 5 (8,2%) para QTn, 1 (1,6%) para cirurgia conservadora mais extensa, 1 (1,6%) para cirurgia contralateral e 1 (1,6%) para esvaziamento axilar. Em um (1,6%) caso a RM permitiu a realização de cirurgia conservadora de menor extensão, pois se tratava de paciente com nódulo < 1,0 cm, diagnóstico maligno estabelecido e área de microcalcificações BI-RADS 4 na mesma mama, previamente submetida a estudo histológico com resultado benigno, porém, que gerava insegurança em razão de sua extensão e risco de subestimação. Não foi observado realce anômalo na região e a cirurgia direcionada para a ressecção do nódulo com margens livres foi possível. Nos casos em que ocorreu mudança de conduta terapêutica (14 casos), houve impacto positivo determinado pela RM em 12 (85,7%) e impacto negativo em 2 (14,3%) (Tabela 2). Essas duas pacientes tiveram achados de RM que sugeriam multicentricidade e foram submetidas a mastectomia, não havendo confirmação da multicentricidade na peça cirúrgica. Em relação ao tipo histológico, a RM determinou mudança de conduta em 50% das pacientes com diagnóstico de CLI (33% adicionaram cirurgia contralateral; 66% de cirurgia conservadora para mastectomia), em 19% dos carcinomas invasivos tipo não especial (37,5% de cirurgia conservadora para mastectomia; 62,5% de cirurgia conservadora para QTn) e em 25% dos CDIS (100% de cirurgia conservadora mais extensa), no entanto, esta diferença não foi estatisticamente significante (p = 0,414). Analisando os subtipos moleculares dos carcinomas invasivos, os que apresentaram maiores taxas de mudança de conduta foram os luminais B (30% de casos em que a RM determinou mudança de conduta, sendo 75% de cirurgia conservadora para QTn e 25% de cirurgia conservadora para mastectomia) e os tumores HER-2 (20% de mudança de conduta após a RM, sendo todos os casos de cirurgia conservadora para mastectomia (p = 0,283)). DISCUSSÃO A RM das mamas é importante no estadiamento locorregional das neoplasias mamárias, pois, além da capacidade de prover informações acerca da morfologia e dimensões tumorais, possui alta sensibilidade, permitindo detecção de lesões adicionais ocultas nos exames convencionais(4,11–16). No presente estudo foi identificada lesão adicional suspeita na mama ipsilateral em 21,3% dos casos e na mama contralateral em 8,2%, valores próximos aos encontrados na literatura. Em metanálise que avaliou 40 artigos quanto à detecção de lesões adicionais ipsilaterais na RM em pacientes com neoplasia mamária, Piana et al. encontraram média de 20% (variando de 6–70%), com valor preditivo positivo de 67%. Analisaram 30 estudos acerca da identificação de lesões adicionais contralaterais, identificando média de 5,5% (variando entre 2,3–22%), com valor preditivo positivo de 37%(17). Embora tenha alta sensibilidade, a RM das mamas apresenta relativa baixa especificidade e não possui acurácia suficiente para que seus achados sejam encarados como diagnóstico definitivo(18), sendo necessária comprovação histológica para definir conduta(19). Como a biópsia guiada por RM tem alto custo e baixa disponibilidade, a US direcionada para caracterização dessas lesões e posterior biópsia é uma solução viável. Ao investigar com US second look lesões identificadas inicialmente apenas na RM, Aracava et al. demonstraram que 100% dos achados BI-RADS 5 e 90% dos achados BI-RADS 4 foram caracterizados pelo second look, indicando que lesões suspeitas têm grande probabilidade de serem identificadas na US(20). No presente estudo, 4 (80%) dos 5 achados suspeitos contralaterais foram submetidos a US second look. Embora seja amostra pequena, 3 (75%) das lesões suspeitas na RM foram identificadas na US, das quais 1 (33,3%) teve anatomopatológico positivo para malignidade. Esses achados são comparáveis ao estudo de Hong et al., que, avaliando por second look 121 lesões suspeitas na RM, encontraram correspondente ultrassonográfico em 105 (86,8%), e destas, 29 (27,9%) foram comprovadas como malignas(21). No presente estudo, a RM determinou mudança de conduta em 23% das pacientes submetidas a RM das mamas e em 35,7% esta mudança ocorreu de cirurgia conservadora para mastectomia. Em estudo retrospectivo prévio com 160 pacientes, França et al. identificaram a RM como fator determinante para mudança de conduta terapêutica em 14,4% dos casos(4), taxa esta inferior à encontrada no nosso estudo atual. Entretanto, trata-se de um estudo retrospectivo sem relato de homogeneização de conduta por um mesmo avaliador e sem menção ao status axilar. Gonzalez et al., ao avaliarem 220 pacientes submetidas a RM pré- tratamento de câncer de mama, observaram alteração na indicação de tratamento em 40 (18%) pacientes(22). A mudança de conduta observada no estudo de Mukherjee et al. foi superior à encontrada em nossa amostra, sendo 66% para o primeiro avaliador e 41% para o segundo avaliador, e a alteração mais comum foi de cirurgia conservadora para mastectomia(23). Piana et al., em revisão sistemática da literatura, avaliaram o impacto da RM no planejamento cirúrgico do câncer de mama e encontraram taxa de conversão apropriada para mastectomia em 8,3% dos casos e inapropriada em 1,7%, considerando a análise histopatológica subsequente(17). Em nosso estudo, a taxa de conversão apropriada para mastectomia foi 4,9% e a inapropriada foi 3,3%. Em ambas as situações em que a mastectomia foi considerada inapropriada, a RM sugeriu doença multicêntrica, que não foi investigada no pré-operatório, ratificando que, diante dos valores atuais de sensibilidade e especificidade, a RM não é capaz de substituir o anatomopatológico para comprovação diagnóstica da lesão adicional, sendo recomendável que achados adicionais de RM sejam confirmados por biópsia, evitando abordagens cirúrgicas mais agressivas. Por outro lado, esta avaliação não incluiu fatores como risco familiar, vontade da paciente ou outras condições inerentes à paciente que possam ter justificado a mudança de conduta nesses casos específicos. O emprego da RM na propedêutica permitiu a realização de cirurgia conservadora menos extensa em uma paciente (1,6%), pois possuía área extensa de microcalcificações agrupadas ipsilateral, submetidas a biópsia prévia com resultado benigno, porém, que gerava insegurança por sua distribuição e extensão. Antes da realização da RM, o mastologista consultado considerou opção por cirurgia que incluísse a área de microcalcificações, e após, não observando realce anômalo na região, direcionou o procedimento cirúrgico apenas para a lesão com diagnóstico estabelecido. Não houve correlação estatisticamente significante entre os tipos histológicos e subtipos moleculares com alteração da conduta terapêutica na nossa amostra. As pacientes com CLI tiveram maior porcentual de mudança de conduta (50%) em nossa avaliação, porém, não estatisticamente significante, provavelmente em função da amostra pequena. Os resultados deste trabalho devem ser considerados no contexto de algumas limitações. O crescente uso da QTn na prática clínica é percebido na amostra estudada (34,4%), inviabilizando a confirmação de multifocalidade/multicentricidade dos casos não investigados antes da instituição da terapêutica. Outras limitações do estudo foram: número reduzido de pacientes incluídas no estudo, dificultando a obtenção de valores estatisticamente significantes; ausência de seguimento de longo prazo, impedindo a avaliação de desfechos como recidivas e/ou sobrevida; ausência de investigação adicional de algumas lesões identificadas na RM, em razão de o avaliador precisar dessas informações para definir melhor a conduta após a RM. Ainda existe grande controvérsia na literatura relacionada ao uso rotineiro da RM das mamas para estadiamento e planejamento terapêutico em pacientes com câncer de mama. Apesar de a RM ter maior acurácia que os métodos convencionais na avaliação da extensão da doença e diversos estudos retrospectivos terem mostrado benefício dessa modalidade, os primeiros estudos prospectivos realizados (MONET e COMICE trials) não demonstraram benefício da RM em termos de redução nas taxas de reoperação, margens positivas, sobrevida ou recorrência local(24–27). Isto se deve, principalmente, a problemas metodológicos desses trabalhos, notadamente relacionados à inclusão de centros com pouca experiência com o método e à ausência de investigação pré-operatória dos achados da RM. Além disso, existem muitos fatores relacionados ao tratamento e à técnica cirúrgica que podem influenciar esses resultados. Por exemplo, McCahill et al. demonstraram que existe variação substancial nas taxas de reoperação após cirurgias conservadoras entre diferentes cirurgiões e diferentes instituições, o que poderia prejudicar a análise do impacto da RM utilizando este tipo de desfecho(28). O presente estudo demonstra que a RM tem papel importante no estadiamento pré-operatório em nosso meio, modificando o planejamento terapêutico em cerca de 25% dos casos, com impacto positivo na grande maioria deles. A tendência atual é que a RM seja indicada para grupos específicos que possam apresentar maior benefício. Algumas considerações devem ser lembradas quando a RM for solicitada para o planejamento terapêutico: os achados da RM com impacto no tratamento devem ser preferencialmente confirmados histologicamente antes da definição terapêutica; deve haver possibilidade de realizar biópsia ou localização pré-operatória guiada por RM para as lesões identificadas apenas por este método; a investigação dos achados da RM não deve atrasar o tratamento; e as alterações no tratamento devem ser discutidas com uma equipe multidisciplinar, incluindo radiologistas, patologistas, mastologistas, oncologistas e radioterapeutas. REFERÊNCIAS 1. Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Controle do câncer de mama. Conceito e magnitude do câncer de mama. [cited 2016 Nov 18]. Available from: http://www2.inca.gov.br/wps/wcm/connect/acoes_programas/site/home/nobrasil/programa_controle_cancer_mama/conceito_magnitude. 2. Kuhl C, Kuhn W, Braun M, et al. Pre-operative staging of breast cancer with breast MRI: one step forward, two steps back? Breast. 2007;16 Suppl 2:S34–44. 3. Knuttel FM, Menezes GL, van den Bosch MA, et al. Current clinical indications for magnetic resonance imaging of the breast. J Surg Oncol. 2014;110:26–31. 4. França LKL, Bitencourt AGV, Paiva HLS, et al. Role of magnetic resonance imaging in the planning of breast cancer treatment strategies: comparison with conventional imaging techniques. Radiol Bras. 2017;50:76–81. 5. Berg WA, Gutierrez L, NessAiver MS, et al. Diagnostic accuracy of mammography, clinical examination, US, and MR imaging in preoperative assessment of breast cancer. Radiology. 2004;233:830–49. 6. Tsina G, Simon P. Breast magnetic resonance imaging and its impact on the surgical treatment of breast cancer. Obstet Gynecol Int. 2014;2014:632074. 7. Debald M, Abramian A, Nemes L, et al. Who may benefit from preoperative breast MRI? A single-center analysis of 1102 consecutive patients with primary breast cancer. Breast Cancer Res Treat. 2015;153:531–7. 8. Mann RM, Hoogeveen YL, Blickman JG, et al. MRI compared to conventional diagnostic work-up in the detection and evaluation of invasive lobular carcinoma of the breast: a review of existing literature. Breast Cancer Res Treat. 2008;107:1–14. 9. Grimm LJ, Johnson KS, Marcom PK, et al. Can breast cancer molecular subtype help to select patients for preoperative MR imaging? Radiology. 2015;274:352–8. 10. American College of Radiology. Breast imaging reporting and data system (BI-RADS®). 5th ed. Reston, VA: American College of Radiology; 2013. 11. Fischer U, Kopka L, Grabbe E. Breast carcinoma: effect of preoperative contrast-enhanced MR imaging on the therapeutic approach. Radiology. 1999;213:881–8. 12. Della Corte GA, Rocco N, Sabatino V, et al. Increase of mastectomy rates after preoperative MRI in women with breast cancer is not influenced by patients age. Int J Surg. 2014;12 Suppl 2:S44–S46. 13. Guatelli CS, Bitencourt AGV, Osório CABT, et al. Can diffusion-weighted imaging add information in the evaluation of breast lesions considered suspicious on magnetic resonance imaging? Radiol Bras. 2017;50:291–8. 14. Santucci D, Lee SS, Hartman H, et al. Comparison of Cartesian and radial acquisition on short-tau inversion recovery (STIR) sequences in breast MRI. Radiol Bras. 2017;50:216–23. 15. Almeida JRM, Gomes AB, Barros TP, et al. Diffusion-weighted imaging of suspicious (BI-RADS 4) breast lesions: stratification based on histopathology. Radiol Bras. 2017;50:154–61. 16. Galvão CN. Magnetic resonance imaging in the preoperative evaluation of breast cancer patients. Radiol Bras. 2017;50(2):vii–viii. 17. Piana MN, Carreira C, Muriel A, et al. Magnetic resonance imaging in the preoperative assessment of patients with primary breast cancer: review of diagnostic accuracy and meta-analysis. Eur Radiol. 2012;22:26–38. 18. Mann RM, Kuhl CK, Kinkel K, et al. Breast MRI: guidelines from the European Society of Breast Imaging. Eur Radiol. 2008; 18:1307–18. 19. Brennan ME, Houssami N, Lord S, et al. Magnetic resonance imaging screening of the contralateral breast in women with newly diagnosed breast cancer: systematic review and meta-analysis of incremental cancer detection and impact on surgical management. J Clin Oncol. 2009;27:5640–9. 20. Aracava MM, Chjoniak R, Souza JA, et al. Identification of occult breast lesions detected by magnetic resonance imaging with targeted ultrasound: a prospective study. Eur J Radiol. 2014;83:516–9. 21. Hong MJ, Cha JH, Kim HH, et al. Second-look ultrasonography for MRI-detected suspicious breast lesions in patients with breast cancer. Ultrasonography. 2015;34:125–32. 22. Gonzalez V, Sandelin K, Karlsson A, et al. Preoperative MRI of the breast (POMB) influences primary treatment in breast cancer: a prospective, randomized, multicenter study. World J Surg. 2014;38:1685–93. 23. Mukherjee SD, Hodgson N, Lovrics PJ, et al. A retrospective study evaluating the impact of preoperative breast MRI on surgical decision-making in young patients (≤50 years) with invasive breast cancer. Breast Cancer (Auckl). 2016;10:53–60. 24. Turnbull L, Brown S, Harvey I, et al. Comparative effectiveness of MRI in breast cancer (COMICE) trial: a randomised controlled trial. Lancet. 2010;375:563–71. 25. Peters NHGM, van Esser S, van den Bosch MA, et al. Preoperative MRI and surgical management in patients with nonpalpable breast cancer: the MONET – randomised controlled trial. Eur J Cancer. 2011;47:879–86. 26. Obdeijn IM, Tilanus-Linthorst MM, Spronk S, et al, Preoperative breast MRI can reduce the rate of tumor-positive resection margins and reoperations in patients undergoing breast-conserving surgery. AJR Am J Roentgenol. 2013;200:304–10. 27. Sung JS, Li J, Da Costa G, et al. Preoperative breast MRI for early-stage breast cancer: effect on surgical and long-term outcomes. AJR Am J Roentgenol. 2014;202:1376–82. 28. McCahill LE, Single RM, Aiello Bowles EJ, et al. Variability in reexcision following breast conservation surgery. JAMA. 2012;307:467–75. 1. Hospital Memorial Arthur Ramos, Maceió, AL, Brasil; https://orcid.org/0000-0002-0173-0326 2. A.C.Camargo Cancer Center, São Paulo, SP, Brasil; https://orcid.org/0000-0003-0192-9885 3. A.C.Camargo Cancer Center, São Paulo, SP, Brasil; https://orcid.org/0000-0002-4442-0870 4. A.C.Camargo Cancer Center, São Paulo, SP, Brasil; https://orcid.org/0000-0001-8220-555X 5. A.C.Camargo Cancer Center, São Paulo, SP, Brasil; https://orcid.org/0000-0003-1239-2112 6. A.C.Camargo Cancer Center, São Paulo, SP, Brasil; https://orcid.org/0000-0001-7572-9371 Correspondência: Dra. Luciana Karla Lira França A.C.Camargo Cancer Center – Departamento de Imagem Rua Professor Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 01509-010 E-mail: lucianaklfg@gmail.com Recebido para publicação em 31/5/2018. Aceito, após revisão, em 8/10/2018. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554