Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 52 nº 3 - Maio / Jun. of 2019
Vol. 52 nº 3 - Maio / Jun. of 2019
|
CARTAS AO EDITOR
|
|
|
|
|
Autho(rs): Isa Félix Adôrno1; Rômulo Florêncio Tristão Santos1; Bernardo Bacelar de Faria2; Edson Marchiori3; Thiago Franchi Nunes1 |
|
|
Sr. Editor,
Paciente feminina, dois anos de idade, previamente hígida, encaminhada à unidade de pronto-atendimento com quadro de dispneia súbita e dor torácica à direita. No exame físico foram constatadas taquipneia, ausência de murmúrio vesicular à direita e turgência jugular ipsilateral. Testes laboratoriais de rotina não apresentaram anormalidades. Radiografia de tórax demonstrou pneumotórax hipertensivo à direita. Tomografia computadorizada (TC) do tórax mostrou, além do volumoso pneumotórax, uma formação expansiva escavada, com atelectasia associada do pulmão direito (Figura 1A-C). A cirurgia torácica optou por drenagem do pneumotórax no primeiro momento e, na mesma internação, ressecção cirúrgica da lesão pulmonar. A análise patológica macroscópica revelou lesão nodular subpleural circunscrita, sólido-cística e friável, medindo 1,4 cm de diâmetro, associada a ruptura pleural. Histologicamente, observou-se neoplasia com padrões foliáceo, sólido e áreas císticas, revestidas por epitélio respiratório normal adjacente (Figura 1D). As células neoplásicas apresentavam dois padrões predominantes distintos: um componente imaturo indiferenciado (blastematoso), principalmente na região subepitelial, e um componente fusocelular com diferenciação rabdomioblástica, com raras células anaplásicas e numerosas mitoses atípicas. Não foram observadas diferenciação condral ou necrose. O diagnóstico final foi de blastoma pleuropulmonar (BPP) tipo II. O estadiamento subsequente não revelou disseminação metastática da doença até aquele momento. Após a cirurgia, a criança se recuperou rapidamente, sem sintomas respiratórios. Nova radiografia do tórax demonstrou expansão total de todo o pulmão acometido. Não houve necessidade de radioterapia pós-operatória. 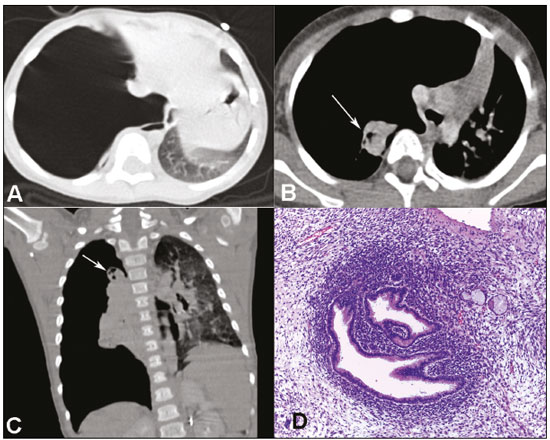 Figura 1. TC do tórax demonstrando volumoso pneumotórax à direita (A), formação expansiva escavada (setas) e atelectasia do pulmão correspondente (B,C). D: Corte histológico mostrando componente bifásico da neoplasia, identificando a área sólida com componente imaturo denso ao redor do epitélio pulmonar normal (cambium layer) e o componente fusiforme adjacente, onde foram observadas as estriações citoplasmáticas características (não observadas na foto). Coloração hematoxilina-eosina, aumento de 200 ×. BPP é uma neoplasia maligna intratorácica agressiva que acomete principalmente crianças menores de cinco anos e, embora rara, é considerada a neoplasia maligna primária pulmonar mais comum da infância(1). Sua origem se remete às células embrionárias primitivas que se iniciam durante o desenvolvimento do órgão acometido, de forma análoga ao observado em outras neoplasias da infância. Essas células primitivas estão associadas a outras malformações císticas congênitas pulmonares, e alguns desses casos evoluem para uma neoplasia agressiva, com possível transformação sarcomatosa, evidenciando o potencial de diferenciação celular multidirecional(2). Em geral, o BPP se apresenta como massa intrapulmonar subpleural e é caracterizado histologicamente por uma diferenciação primitiva, blastematosa e sarcomatosa com elementos epiteliais pulmonares não neoplásicos aprisionados. Com o desenvolvimento de novas tecnologias, os estudos por imagem vêm adquirindo crescente importância em pediatria(3-7). Contudo, são escassos os artigos na literatura que descrevem os achados por imagem do BPP(8). Pneumotórax é uma apresentação frequente nas formas císticas do BPP tipos I e II(9,10). O BPP é altamente agressivo em sua forma sólida de tipo III, com recorrência e metástases. As metástases mais frequentes ocorrem no pulmão e pleura, sistema nervoso central e sistema musculoesquelético. A TC é a técnica mais utilizada, porém a ressonância magnética de tórax é útil para demonstrar melhor a origem da massa, suas relações anatômicas e o envolvimento de estruturas adjacentes. Os achados radiológicos, em geral, não são suficientes para um diagnóstico definitivo, sendo a biópsia pulmonar fundamental para o diagnóstico final. REFERÊNCIAS 1. Orazi C, Inserra A, Schingo PM, et al. Pleuropulmonary blastoma, a distinctive neoplasm of childhood: report of three cases. Pediatr Radiol. 2007;37:337-44. 2. Messinger YH, Stewart DR, Priest JR, et al. Pleuropulmonary blastoma: a report on 350 central pathology-confirmed pleuropulmonary blastoma cases by the International Pleuropulmonary Blastoma Registry. Cancer. 2015;121:276-85. 3. Vilela VM, Ribeiro VM, Paiva JC, et al. Clinical and radiological characterization of fibrous hamartoma of infancy. Radiol Bras. 2017;50:204-5. 4. Moreira FP, Aihara AY, Lederman HM, et al. Cognitive map to support the diagnosis of solitary bone tumors in pediatric patients. Radiol Bras. 2018;51:297-302. 5. Peçanha AS, Monteiro AM, Gazolla FM, et al. Ultrasound as a method to evaluate the distribution of abdominal fat in obese prepubertal children and the relationship between abdominal fat and metabolic alterations. Radiol Bras. 2018;51:293-6. 6. Figueiras FN, Duarte ML, Duarte ER, et al. Giant ovarian teratoma: an important differential diagnosis of pelvic masses in children. Radiol Bras. 2017;50:342-3. 7. Togni Filho PH, Casagrande JLM, Lederman HM. Utility of the inspiratory phase in high-resolution computed tomography evaluations of pediatric patients with bronchiolitis obliterans after allogeneic bone marrow transplant: reducing patient radiation exposure. Radiol Bras. 2017;50:90-6. 8. Naffaa LN, Donnelly LF. Imaging findings in pleuropulmonary blastoma. Pediatr Radiol. 2005;35:387-91. 9. Kuzucu A, Soysal O, Yakinci C, et al. Pleuropulmonary blastoma: report of a case presenting with spontaneous pneumothorax. Eur J Cardiothorac Surg. 2001;19:229-30. 10. Piastra M, Ruggiero A, Caresta E, et al. Critical presentation of pleuropulmonary blastoma. Pediatr Surg Int. 2005;21:223-6. 1. Hospital Universitário Maria Aparecida Pedrossian da Universidade Federal de Mato Grosso do Sul (HUMAP-UFMS), Campo Grande, MS, Brasil; https://orcid.org/0000-0002-2106-1211 2. Hospital Universitário Maria Aparecida Pedrossian da Universidade Federal de Mato Grosso do Sul (HUMAP-UFMS), Campo Grande, MS, Brasil; https://orcid.org/0000-0002-8679-7369 3. Screenlab, Campo Grande, MS, Brasil; https://orcid.org/0000-0002-4258-2198 4. Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil; https://orcid.org/0000-0001-8797-7380 5. Hospital Universitário Maria Aparecida Pedrossian da Universidade Federal de Mato Grosso do Sul (HUMAP-UFMS), Campo Grande, MS, Brasil; https://orcid.org/0000-0003-0006-3725 Correspondência: Dr. Edson Marchiori Rua Thomaz Cameron, 438, Valparaiso Petrópolis, RJ, Brasil, 25685-120 E-mail: edmarchiori@gmail.com Recebido para publicação em 17/10/2017 Aceito, após revisão, em 8/11/2017 |
|
GN1© Copyright 2024 - All rights reserved to Colégio Brasileiro de Radiologia e Diagnóstico por Imagem
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554