Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 6 - Nov. / Dez. of 2018
Vol. 51 nº 6 - Nov. / Dez. of 2018
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Gracy de Almeida Coutinho Carneiro1,a; Fernanda Philadelpho Arantes Pereira2,b; Flávia Paiva Proença Lobo Lopes3,c; Maria Julia Gregorio Calas4,d |
|
|
Descritores: Biópsia guiada por imagem/métodos; Mama; Ressonância magnética; Neoplasias da mama/diagnóstico. |
|
|
Resumo: INTRODUÇÃO
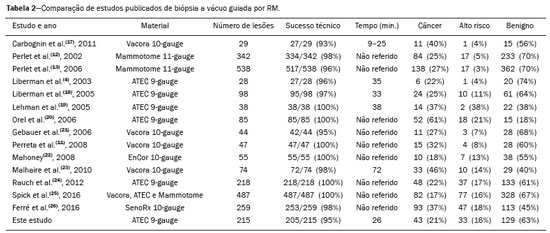
A ressonância magnética (RM) das mamas é uma técnica de imagem cada vez mais utilizada na prática clínica, com um papel estabelecido no diagnóstico, estadiamento e acompanhamento do tratamento do câncer de mama(1-3). Em pacientes com câncer, a RM detecta sítio adicional de câncer na mama ipsilateral em 6-34% e na contralateral em 4-24%(4). Além disso, é capaz de detectar lesões que não são visíveis no exame físico, na mamografia e na ultrassonografia(4,5). Segundo Liberman et al., em pacientes de alto risco, a RM detecta 2-8% de câncer de mama em pacientes com mamografia e exame físico normais(4). A RM da mama apresenta alta sensibilidade (90-94%) e especificidade variável (37-72%), sendo necessária, portanto, a confirmação de malignidade de uma lesão quando existe suspeição(4,6,7). Não sendo a lesão identificada em outros métodos, o procedimento ocorre por meio da RM, tanto pela marcação pré-cirúrgica, seguida de excisão cirúrgica, quanto pela biópsia percutânea(8,9). A biópsia a vácuo é uma técnica segura e efetiva no manuseio de lesões detectáveis somente pela RM e tem excelente acurácia, mesmo em lesões pequenas(10-12). Além disso, por ser um método minimamente invasivo, é uma alternativa à biópsia cirúrgica, evitando as complicações e o alto custo de uma cirurgia, principalmente em casos de lesões benignas(5,13). Ela permite, ainda, a colocação de um clipe de titânio (identificado nos demais métodos de imagem), com o objetivo de marcar a região abordada, facilitando o seguimento ou a abordagem posterior(5). A biópsia a vácuo guiada por RM tem resultados estabelecidos na literatura e consensos internacionais, porém, dados nacionais ainda são pouco conhecidos. O objetivo deste estudo foi avaliar os resultados histopatológicos e o porcentual de malignidade encontrados na amostragem das lesões biopsiadas guiadas por RM em nossa instituição. MATERIAIS E MÉTODOS Foi realizado estudo retrospectivo de 190 mulheres, com 215 solicitações de biópsias das mamas guiadas por RM. Destas, 205 lesões observadas apenas na RM foram submetidas ao procedimento em uma clínica particular. Utilizou-se um banco de dados de pacientes submetidas a biópsia a vácuo guiada por RM no período de abril de 2008 a dezembro de 2016 em nosso serviço. As variáveis analisadas se referem a dados clinicoepidemiológicos, histopatológicos e a informações da RM da mama. Todas as RMs eram categorizadas de acordo com o Breast Imaging Reporting and Data System (BI-RADS)(14), classificadas como BI-RADS 4, 5 ou, ainda, BI-RADS 3 em pacientes de alto risco familiar/genético ou com história pessoal atual de câncer de mama. As pacientes foram orientadas quanto à realização do procedimento, seguimento pós-intervenção, bem como possíveis complicações, e assinaram termo de consentimento livre e esclarecido. Para o gerenciamento das informações, um novo banco de dados dessas pacientes foi criado, por meio do software Microsoft Excel 2000, seguindo o método utilizado nos protocolos de pesquisa. A coleta de dados foi iniciada após aprovação pelo comitê de ética em pesquisa da instituição e foram inseridos em uma ficha eletrônica específica. Os procedimentos de biópsia a vácuo guiada por RM foram realizados por duas radiologistas especialistas em imagem da mama diagnóstica e intervencionista. Os procedimentos foram realizados em aparelho de RM de 1,5 T (Signa Excite HD; GE Healthcare, Milwaukee, WI, EUA), com a paciente posicionada em decúbito ventral em uma bobina dedicada de 8 canais, a qual permite acessos lateral e medial à mama (Figura 1). A mama alvo da biópsia foi comprimida e imobilizada. Uma cápsula de vitamina, utilizada como marcador, foi colocada junto à pele, na região onde a lesão supostamente se localizava, com base na revisão das imagens do exame prévio de RM, e sua localização foi marcada em um esquema para orientação do procedimento (Figura 2). 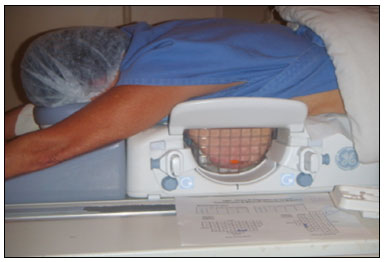 Figura 1. Paciente posicionada para o procedimento, com cápsula de vitamina e grade e esquema de orientação de biópsia. 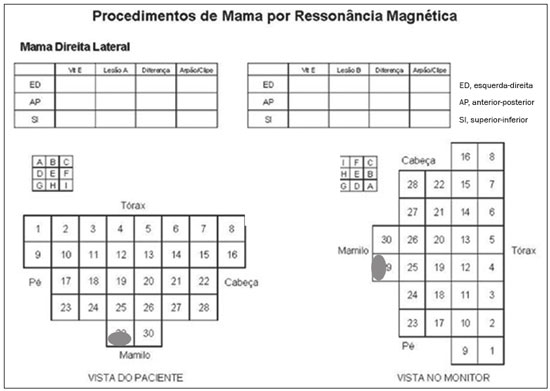 Figura 2. Esquema de orientação da biópsia. Neste caso, será uma abordagem na mama direita, acesso lateral. Primeiramente, foi adquirida uma sequência localizadora e o volume de interesse foi selecionado para incluir todo o sistema de compressão e a cápsula de vitamina. A seguir, foi realizada sequência gradiente tridimensional pesada em T1 com supressão de gordura no plano sagital (flip angle, 15°; banda, 41,67 MHz; matriz, 220 × 220; FOV, 220 mm; NEX, 1; espessura de corte, 2 mm; intervalo, 0 mm) antes e após injeção rápida em bomba infusora de 0,1 mmol/L de gadoterate meglumine (Dotarem; Guerbet, Roissy, França) por quilograma de peso corporal, seguida de 20 mL de solução salina, até que o realce da lesão alvo fosse observado. Um cursor foi posicionado no monitor sobre a lesão e sua relação com a superfície cutânea e com a cápsula de vitamina foi determinada por meio da passagem sequencial das imagens obtidas no plano sagital. A grade de compressão foi evidenciada com base em linhas com sinal hipointenso na superfície cutânea, secundárias à pressão da grade na pele. A cápsula de vitamina foi identificada como uma imagem oval com sinal hiperintenso junto à superfície cutânea. O sítio de entrada da agulha na pele foi determinado com base na análise da relação da lesão com as linhas da grade, utilizando a cápsula de vitamina como guia e o cursor posicionado; o sítio de entrada na pele foi anotado no esquema (Figura 2). A profundidade da lesão foi calculada pela diferença entre a posição do corte que mostra a superfície cutânea e a posição do corte que continha a lesão. Realizou-se assepsia cutânea com álcool a 70% e anestesia com 5 mL de cloridrato de lidocaína a 1% sem vasoconstritor, priorizando a superfície cutânea e o trajeto da agulha. Utilizou-se um kit de biópsia Suros ATEC (Hologic; Marlborough, MA, EUA) contendo guia da agulha, bainha coaxial, estilete e obturador. A guia da agulha foi colocada na grade. A seguir, uma bainha coaxial de plástico estéril com um estilete de titânio foi inserida até atingir a profundidade calculada. O estilete foi então retirado e substituído por um obturador visível na RM. Uma nova sequência pesada em T1 com supressão de gordura no plano sagital, acompanhada ou não de reconstrução no plano axial, foi então obtida para documentar a localização do obturador. O obturador apareceu como uma estrutura com sinal hipointenso, às vezes com artefato de suscetibilidade magnética adjacente, este último podendo comprometer a identificação da lesão alvo, especialmente no caso de lesões pequenas. Nesses casos, referências anatômicas adjacentes frequentemente eram úteis na confirmação da relação da lesão com o obturador (Figura 3). 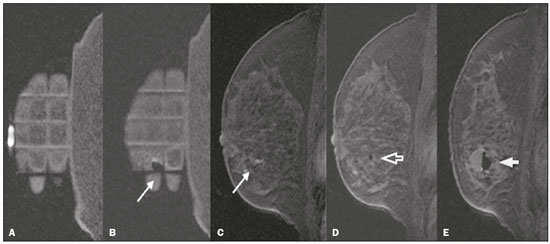 Figura 3. RM, sagital T1 com supressão de gordura, de mulher com 53 anos submetida a biópsia a vácuo (abordagem: mama esquerda, lateral). A: Imagem da cápsula de vitamina e grade. B: Imagem da grade e da agulha posicionada para o procedimento (seta). C: Imagem da lesão (seta). D: Imagem do obturador na lesão (seta). E: Controle pós-biópsia, com formação de hematoma (seta). Uma vez estando o obturador posicionado corretamente em relação à lesão, a paciente foi retirada do aparelho e amostras de tecido foram colhidas com o dispositivo ATEC 9-gauge (Hologic) pela bainha coaxial. Após a amostragem de tecido ter sido colhida, foi inserido um marcador de titânio e uma nova sequência T1 com supressão de gordura no plano sagital foi realizada, a fim de verificar a relação entre o marcador de titânio e a região biopsiada. Ao final da biópsia, foi realizada compressão manual para hemostasia. Posteriormente, foi feito curativo compressivo estéril e realizada mamografia unilateral com duas incidências (craniocaudal e perfil) para confirmar a colocação bem sucedida do clipe. O tempo de duração do procedimento leva em consideração o intervalo entre a sequência localizadora da mama e a última sequência de RM obtida, pós-colocação do marcador de titânio. O material foi analisado por patologistas com experiência em doenças mamárias. O relatório do procedimento com as imagens do exame, assim como o resultado histopatológico, foram entregues para as pacientes após 15 dias do procedimento. Nesse relatório constou, também, a correlação feita pelo radiologista entre a imagem biopsiada e o resultado encontrado. A análise estatística foi exploratória, comparativa e realizada utilizando o aplicativo Statistical Package for Social Sciences, versão 20.0 (IBM Corp.; Armonk, NY, EUA). As variáveis categóricas serão apresentadas como frequências absolutas e porcentagens, e as variáveis contínuas, representadas por suas médias e desvios-padrão. A comparação entre os nódulos e os realces não nodulares e a presença de malignidade foi realizada utilizando o teste de qui-quadrado de Pearson, com nível de significância de 5% (p = 0,05). RESULTADOS De um total de 215 casos de indicação de biópsia a vácuo guiada por RM, 10 procedimentos foram contraindicados: 6 por não identificação da lesão no momento do procedimento, 2 por proximidade com o implante mamário, 1 por proximidade com o mamilo e 1 por posicionamento posterior à grade de biópsia. Foi realizado, portanto, o procedimento de biópsia a vácuo guiada por RM em 205 lesões, em 190 mulheres com idades entre 26 e 85 anos (média de 52 anos). A taxa de biópsias tecnicamente viáveis foi 95%. A complicação mais comum do procedimento foi a formação de hematoma (n = 6; 2,93%), sendo ainda observadas lesão cutânea (n = 1; 0,49%) e reação vasovagal (n = 2; 0,98%). Todas as complicações foram consideradas leves e autolimitadas, não sendo necessária nenhuma intervenção ou internação das pacientes. Das 205 lesões, 135 (66%) eram realces não nodulares e 70 (34%) eram nódulos. Os realces não nodulares mediam 0,5-9,6 cm (média de 2,2 cm) e os nódulos mediam 0,5-2,2 cm (média de 0,97 cm). Dessas 205 lesões, 129 (63%) eram benignas, 43 (21%) eram malignas e 33 (16%) eram de alto risco, distribuídas entre os nódulos e realces não nodulares. Não houve diferenças estatisticamente significantes entre os nódulos e os realces não nodulares em relação a malignidade (p = 0,725). O léxico BI-RADS de ressonância realizada previamente à biópsia foi utilizado, encontrando BI-RADS 5 para 7 lesões (4 malignas e 3 benignas), BI-RADS 4 para 190 lesões (39 malignas, 119 benignas e 32 de alto risco) e BI- RADS 3 para 8 lesões (7 benignas e 1 de alto risco). O procedimento durou, em média, 26 minutos, variando de 15 a 61 minutos, de acordo com o número de lesões abordadas e a dificuldade de realização do procedimento. Foram obtidos de 7 a 20 fragmentos durante os procedimentos. O número de fragmentos retirados variou de acordo com o tamanho da mama, o tamanho da lesão, o número de lesões, a localização da lesão, a dificuldade da realização da técnica e a presença de complicações, como sangramento e resposta vasovagal. Os tipos histológicos das 205 lesões estão detalhados na Tabela 1. Os resultados benignos mais comuns foram as alterações fibrocísticas, seguidas dos fibroadenomas, e os resultados malignos foram os carcinomas ductais, incluindo os invasivos e in situ. Quanto às lesões de alto risco, os resultados mais frequentes foram as neoplasias lobulares.  DISCUSSÃO A biópsia a vácuo guiada por RM é um procedimento relativamente novo em comparação com as biópsias realizadas por guias estereotáxicas e ultrassonográficas. Está indicada nas imagens (nódulos e realces não nodulares) identificadas somente na RM, ou seja, não vistas em outros métodos de imagem como a mamografia, a tomossíntese e a ultrassonografia(1,5,8,15,16). Conforme descrito na literatura, a taxa de detecção de câncer pela biópsia a vácuo por RM tem variado de 17% a 61%, com a maioria dos estudos referindo variação entre 20% e 40%, comparável com essa técnica realizada por outras guias de localização da imagem(4,11-13,17-26). A taxa de biópsias tecnicamente viáveis do nosso estudo (95%), considerado satisfatório, está em concordância com o observado em outro estudos, que relatam variação entre 93% e 100%(4,11-13,17-26). Do total de 10 pacientes que não realizaram o procedimento no presente estudo, o principal motivo de contraindicação da biópsia por RM foi a não visualização da lesão no momento da realização da biópsia, que ocorreu em 2,8% dos casos (6/215 lesões). Outras limitações para o procedimento neste estudo foram lesões com proximidade com implantes mamários (dois casos), proximidade com o mamilo (um caso) e um caso devido ao posicionamento posterior à grade de biópsia. São descritos, na literatura, de 2% a 16% de casos de contraindicação desse tipo de procedimento(25,27). Isso geralmente ocorre em razão das diferenças no posicionamento, com mudança da localização da lesão, da compressão da mama com redução do fluxo sanguíneo à lesão, e da fase do ciclo menstrual. Esses efeitos podem ser minimizados realizando o procedimento na segunda ou terceira semanas do ciclo menstrual, diminuindo a compressão e, algumas vezes, realizando aquisição de imagem mais tardia(4,5,8,27). No nosso estudo, a decisão da conduta nesses 10 casos, após a contraindicação do exame, foi determinada pelo médico assistente. No entanto, houve recomendação de biópsia cirúrgica, quando em concordância com o BI-RADS, nos casos de impossibilidade de abordar a lesão, e de seguimento por RM em curto intervalo de tempo, nos casos de lesões não vistas no dia do procedimento, conforme é descrito na literatura(27,28). Por se tratar de uma clínica particular, associada a convênios, temos uma limitação no seguimento dessas pacientes, que nem sempre retornam com o resultado da cirurgia ou para um exame de acompanhamento, dificultando a verificação da taxa de subestimação das lesões submetidas a biópsia a vácuo por RM, assim como a acurácia do método. O passo a seguir do nosso estudo será buscar dados de seguimento e o resultado da biópsia cirúrgica nos casos das pacientes operadas. Os nossos resultados (205 casos) estão comparados com os resultados publicados em 14 artigos selecionados, no período de 2001 a 2016, com uma casuística variando de 29 a 538 lesões, agrupados na Tabela 2 (4,11-13,17 - 26). Observamos que o tempo de realização da biópsia a vácuo por RM (média de 26 minutos) e o número de fragmentos retirados (7 a 20) foram semelhantes aos observados nos demais estudos, principalmente nos que utilizaram o mesmo equipamento e tamanho de sonda (ATEC 9-gauge) e está de acordo com o consenso internacional(16), sem complicações. Este tempo é comparável com a biópsia a vácuo por estereotaxia ou ultrassonografia, variando, independentemente do método de localização, de acordo com o número de lesões abordadas e a dificuldade técnica de realização do procedimento(20-26). Dessa forma, pode-se concluir que a biópsia a vácuo é uma técnica segura e efetiva no manuseio de lesões detectáveis somente pela RM. Com relação aos resultados benignos (63%) do nosso estudo, taxas entre 38% e 74% foram descritas, com apenas um trabalho descrevendo 18%(20). Nesse mesmo estudo foi encontrada a taxa mais alta de resultados malignos (61%), muito provavelmente em razão do número pequeno (85 casos) e selecionado de casos. Encontramos 16% de casos de lesões de alto risco (na literatura variando entre 3% e 21%), mais frequente nos achados de realces não nodulares, com apenas um estudo mostrando taxa de 38% de lesões de alto risco(19). A taxa de malignidade encontrada no nosso estudo foi 21%, tendo sido mais frequente entre os realces não nodulares (22,2%). Nossos dados são bastante semelhantes aos encontrados por Liberman et al.(18), Rauch et al.(24), Mahoney(22) e Spick et al.(25), apesar de esses trabalhos terem casuísticas diferentes. Dos casos malignos, detectamos 17 pacientes com carcinoma ductal in situ (8%), de acordo com a literatura (3-28%), e assim como nas lesões malignas, o achado é mais frequente nos realces não nodulares (14 casos) do que nos nódulos (3 casos)(24,29). Com relação à classificação BI-RADS, observamos que das oito lesões classificadas como provavelmente benignas (BI-RADS 3), apenas uma apresentou resultado histopatológico de alto risco (hiperplasia lobular atípica focal), sendo as demais benignas. Das 190 lesões BI-RADS 4, 39 foram malignas (20%), 32 de alto risco (17%) e 119 benignas (63%), e das 7 lesões BI-RADS 5, 4 foram malignas, conforme o esperado, e 3 foram benignas (um nódulo com diagnóstico de fibroadenoma e um nódulo e um realce não nodular com resultado de hiperplasia ductal usual e alterações de células colunares sem atipias). O sistema BI-RADS trouxe maior clareza e uniformização da nomenclatura de RM, com novos conceitos e terminologia. Sabe-se que quase sempre há informações suficientes no exame de RM das mamas para subsidiar uma recomendação de conduta(14). As imagens BI-RADS 3 apresentam um porcentual de malignidade menor que 3% e podem ser investigadas em situações específicas, sendo a principal a história pessoal de câncer de mama ou ovário e alto risco. As imagens BI-RADS 4 são todas indicativas de investigação histológica, com probabilidade de malignidade muito ampla, variando de 3% a 94%, uma vez que a classificação 4 na RM não é dividida em subcategorias 4A (baixo grau de suspeição), 4B (grau intermediário) e 4C (alto grau de suspeição), como nos outros métodos. As lesões BI-RADS 5 apresentam mais de 95% de probabilidade de malignidade e também devem ser investigadas(14). Os resultados encontrados, notadamente no BI-RADS 5, com taxa de malignidade de 57%, nos fazem questionar a classificação BI-RADS empregada nos exames selecionados neste estudo, uma vez que não houve reavaliação da classificação BI-RADS pelo médico que realizou o procedimento. Isto demonstra cada vez mais a necessidade de uma curva de aprendizado na utilização da classificação BI-RADS em RM, assim como este exame deve ser realizado por radiologista dedicado a radiologia mamária. Além disso, deve-se também ser levado em consideração a possibilidade de resultados falso-negativos nas biópsias guiadas por RM, principalmente nas lesões não nodulares, visto que não temos dados de acompanhamento ou cirurgia dessas pacientes. De modo geral, dos 205 casos submetidos ao procedimento, 76 com resultados malignos e de lesões de alto risco foram adequadamente indicados para cirurgia, possibilitando um tratamento apropriado. Da mesma forma, se julgarmos que todas as pacientes restantes, com resultados benignos, não foram submetidas a cirurgias, podemos avaliar o impacto desse procedimento na vida dessas mulheres, poupando pouco mais de metade das pacientes de um procedimento cirúrgico desnecessário, de alto custo, com impacto psicológico e físico na vida delas. CONCLUSÃO A biópsia a vácuo guiada por RM é um método bem tolerado, simples, seguro, útil e reprodutível. No entanto, verificamos que a identificação e a correta classificação de uma lesão detectada apenas na RM são fundamentais para a indicação adequada de uma biópsia. Encontramos, no nosso serviço, 21% de resultados malignos, em concordância com os achados descritos na literatura. Este é um estudo preliminar, sendo necessários correlação com os dados cirúrgicos e seguimento posterior, por um período maior, para melhor avaliação da acurácia do nosso método. Não há dados semelhantes na literatura nacional, sendo este trabalho um dos pioneiros nessa área. REFERÊNCIAS 1. Shetty MK. The basic of breast MRI. In: Shetty MK, editor. Breast cancer screening and diagnosis: a synopsis. 1st ed. New York, NY: Springer Science; 2015. p. 165-7. 2. Sardanelli F, Boetes C, Borisch B, et al. Magnetic resonance imaging of the breast: recommendations from the EUSOMA working group. Eur J Cancer. 2010;46:1296-316. 3. Schnall M, Orel S. Breast MR imaging in the diagnostic setting. Magn Reson Imaging Clin N Am. 2006;14:329-37, vi. 4. Liberman L, Morris EA, Dershaw DD, et al. Fast MRI-guided vacuum-assisted breast biopsy: initial experience. AJR Am J Roentgenol. 2003;181:1283-93. 5. Eby PR, Lehman CD. Magnetic resonance imaging-guided breast interventions. Top Magn Reson Imaging. 2008;19:151-62. 6. Peters NHGM, Rinkes IHMB, Zuithoff NPA, et al. Meta-analysis of MR imaging in the diagnosis of breast lesions. Radiology. 2008; 246:116-24. 7. Orel SG, Schnall MD, Newman RW, et al. MR imaging-guided localization and biopsy of breast lesion: initial experience. Radiology. 1994;193:97-102. 8. Kuhl CK, Elevelt A, Leutner CC, et al. Interventional breast MR imaging: clinical use of a stereotactic localization and biopsy device. Radiology. 1997;204:667-75. 9. Arantes Pereira FP, Martins G, Calas MJG, et al. Magnetic resonance imaging-radioguided occult lesion localization (ROLL) in breast cancer using Tc-99m macro-aggregated albumin and distilled water control. BMC Med Imaging. 2013;13:33. 10. Arantes Pereira FP. Biópsia a vácuo de mama orientada por ressonância magnética. In: Franco JM, organizador. Cirurgia da mama - diagnóstico, tratamento, reconstrução, estética. 1ª ed. Rio de Janeiro, RJ: Revinter; 2012. p. 3-11. 11. Perretta T, Pistolese CA, Bolacchi F, et al. MR imaging-guided 10-gauge vacuum-assisted breast biopsy: histological characterisation. Radiol Med. 2008;113:830-40. 12. Perlet C, Heinig A, Prat X, et al. Multicenter study for the evaluation of a dedicated biopsy device for MR-guided vacuum biopsy of the breast. Eur Radiol. 2002;12:1463-70. 13. Perlet C, Heywang-Kobrunner SH, Heinig A, et al. Magnetic resonance-guided, vacuum-assisted breast biopsy: results from a European multicenter study of 538 lesions. Cancer. 2006;106:982-90. 14. American College of Radiology. ACR BI-RADS - magnetic resonance imaging. In: ACR BI-RADS atlas: breast imaging reporting and data system. 2nd ed. Reston, VA: American College of Radiology; 2013. 15. Eby PR, Lehman C. MRI-guided breast interventions. Semin Ultrasound CT MR. 2006;27:339-50. 16. Heywang-Köbrunner SH, Sinnatamby R, Lebeau A, et al. Interdisciplinary consensus on the uses and technique of MR-guided vacuum-assisted breast biopsy (VAB): results of a European consensus meeting. Eur J Radiol. 2009;72:289-94. 17. Carbognin G, Girardi V, Brandalise A, et al. MR-guided vacuum-assisted breast biopsy in the management of incidental enhancing lesions detected by breast MR imaging. Radiol Med. 2011;116:876-85. 18. Liberman L, Bracero N, Morris E, et al. MRI-guided 9-gauge vacuum-assisted breast biopsy: initial clinical experience. AJR Am J Roentgenol. 2005;185:183-93. 19. Lehman CD, Deperi ER, Peacock S, et al. Clinical experience with MRI-guided vacuum-assisted breast biopsy. AJR Am J Roentgenol. 2005;184:1782-7. 20. Orel SG, Rosen M, Mies C, et al. MR imaging-guided 9-gauge vacuum-assisted core-needle breast biopsy: initial experience. Radiology. 2006;238:54-61. 21. Gebauer B, Bostanjoglo M, Moesta KT, et al. Magnetic resonance-guided biopsy of suspicious breast lesions with a handheld vacuum biopsy device. Acta Radiol. 2006;47:907-13. 22. Mahoney MC. Initial clinical experience with a new MRI vacuum-assisted breast biopsy device. J Magn Reson Imaging. 2008;28:900-5. 23. Malhaire C, El Khoury C, Thibault F, et al. Vacuum-assisted biopsies under MR guidance: results of 72 procedures. Eur Radiol. 2010;20:1554-62. 24. Rauch GM, Dogan BE, Smith TB, et al. Outcome analysis of 9-gauge MRI-guided vacuum-assisted core needle breast biopsies. AJR Am J Roentgenol. 2012;198:292-9. 25. Spick C, Schernthaner M, Pinker K, et al. MR-guided vacuum-assisted breast biopsy of MRI-only lesions: a single center experience. Eur Radiol. 2016;26:3908-16. 26. Ferré R, Ianculescu V, Ciolovan L, et al. Diagnostic performance of MR-guided vacuum-assisted breast biopsy: 8 years of experience. Breast J. 2016;22:83-9. 27. Brennan SB, Sung JS, Dershaw DD, et al. Cancellation of MR imaging-guided breast biopsy due to lesion nonvisualization: frequency and follow-up. Radiology. 2011;261:92-9. 28. Meeuwis C, Veltman J, Hall HNV, et al. MR-guided breast biopsy at 3T: diagnostic yield of large core needle biopsy compared with vacuum-assisted biopsy. Eur Radiol. 2012;22:341-9. 29. Verheyden C, Pages-Bouic E, Balleyguier C, et al. Underestimation rate at MR imaging-guided vacuum assisted breast biopsy: a multi-institutional retrospective study of 1509 breast biopsies. Radiology. 2016;281:708-19. 1. Clínica de Diagnóstico Por Imagem (CDPI), Rio de Janeiro, RJ, Brasil; a. https://orcid.org/0000-0002-3884-7667 2. Clínica de Diagnóstico Por Imagem (CDPI), Rio de Janeiro, RJ, Brasil; b. https://orcid.org/0000-0003-4855-8065 3. Clínica de Diagnóstico Por Imagem (CDPI), Rio de Janeiro, RJ, Brasil; c. https://orcid.org/0000-0002-6713-4041 4. Clínica de Diagnóstico Por Imagem (CDPI), Rio de Janeiro, RJ, Brasil; d. https://orcid.org/0000-0002-7029-8530 Correspondência: Dra. Gracy de Almeida Coutinho Carneiro Rua Senador Vergueiro, 232/1103, Flamengo Rio de Janeiro, RJ, Brasil, 22230-001 E-mail: gracyacoutinho@gmail.com Received August 08, 2017 Accepted after revision December 07, 2017 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554