Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 6 - Nov. / Dez. of 2018
Vol. 51 nº 6 - Nov. / Dez. of 2018
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Micaela Maciel dos Santos Mota1,a; Regis Otaviano França Bezerra2,b; Marcio Ricardo Taveira Garcia3,c |
|
|
Descritores: Espaço retroperitonial/anatomia e histologia; Neoplasias retroperitoniais/diagnóstico; Tomografia computadorizada; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
As massas retroperitoniais constituem um grupo heterogêneo de lesões com origem nos espaços retroperitoniais que representam um desafio diagnóstico para os radiologistas(1). A maioria dos casos é de tumores malignos, dos quais, aproximadamente 75% possuem origem mesenquimal(2–4). Esses tumores são mais prevalentes em adultos, mas podem ser encontrados em qualquer idade(2). Quando não se originam de órgãos como os rins, glândulas adrenais, pâncreas ou alças intestinais retroperitoniais, são classificadas como primárias e divididas, de maneira prática, em lesões sólidas ou císticas, conforme o aspecto da imagem(5,6) (Tabela 1). As lesões sólidas podem ser divididas em quatro grupos: tumores de origem mesenquimal, neural, germinativa e linfoproliferativa(3). Dentre as lesões císticas, destacam-se o linfangioma e o mesotelioma cístico(3,7,8). Existem, ainda, os processos não neoplásicos, com destaque para a fibrose retroperitonial, a histiocitose não Langerhans (doença de Erdheim-Chester) e a hematopoese extramedular. 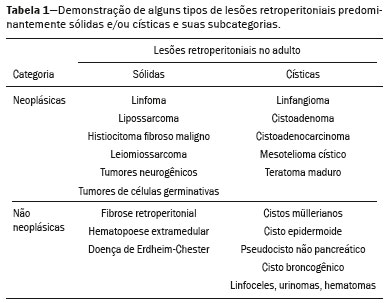 As manifestações clínicas são inespecíficas e dependem da localização e relação com as estruturas adjacentes(9). Os principais métodos de imagem para avaliação dessas lesões são a tomografia computadorizada (TC) e a ressonância magnética (RM), e as características de imagem auxiliam no diagnóstico diferencial, estadiamento, definição da estratégia cirúrgica ou para guiar eventual sítio de biópsia(1,5,10,11). Embora haja significativa interposição dos achados de imagem e o diagnóstico final seja definido por análise histopatológica, existem características específicas a determinadas lesões que podem orientar a conduta clínica. O tratamento é desafiador, principalmente pela localização anatômica, dimensões, comprometimento vascular ou de órgãos adjacentes(12,13). No presente artigo apresentamos uma revisão da anatomia retroperitonial, com uma abordagem prática das características de imagem a serem avaliadas nas principais massas retroperitoniais primárias no adulto, e seu manejo clínico. ANATOMIA RETROPERITONIAL O espaço retroperitonial se estende desde o diafragma até a pelve e é delimitado pela fáscia transversal posteriormente e pelo peritônio parietal posterior anteriormente, sendo dividido em compartimentos(11,14,15) (Figura 1). O espaço pararrenal anterior é delimitado anteriormente pelo peritônio parietal posterior, pela fáscia renal anterior posteriormente e pela fáscia lateroconal lateralmente e, inclui o pâncreas, a segunda porção duodenal e os cólons ascendente e descendente. O espaço pararrenal posterior é delimitado pela fáscia renal posterior anteriormente e pela fáscia transversal posteriormente, e contém gordura. O espaço perirrenal localiza-se entre as fáscias renais anterior e posterior e contém os rins e as adrenais. O retroperitônio ainda inclui uma região central contendo a aorta e a veia cava inferior, assim como cadeias linfáticas e os plexos nervosos. 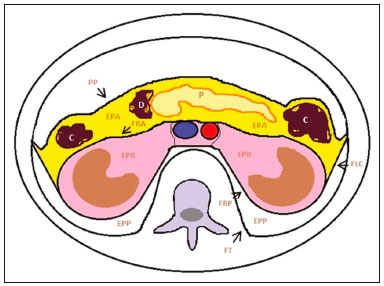 Figura 1. Anatomia retroperitonial. Espaço pararrenal anterior – É delimitado anteriormente pelo peritônio parietal posterior, pela fáscia renal anterior posteriormente e pela fáscia lateroconal lateralmente. Inclui o pâncreas (P), segunda porção duodenal (D) e os cólons ascendente e descendente (C). Espaço pararrenal posterior – É delimitado pela fáscia renal posterior anteriormente e a fáscia transversal posteriormente. Contém gordura. Espaço perirrenal – Localiza-se entre as fáscias renais anterior e posterior. Contém os rins e as adrenais. Região central – Inclui a aorta e a veia cava inferior, assim como cadeias linfáticas e estruturas nervosas. EPA, espaço pararrenal anterior; EPR, espaço perirrenal; EPP, espaço pararrenal posterior; PP, peritônio parietal posterior; FRA, fáscia renal anterior; FRP, fáscia renal posterior; FLC, fáscia lateroconal; FT, fáscia transversal. AVALIAÇÃO RADIOLÓGICA DAS MASSAS RETROPERITONIAIS Na avaliação inicial de uma massa retroperitonial deve-se confirmar a localização nesse espaço e identificar o compartimento acometido (por exemplo: pararrenal anterior)(3). Achados de deslocamento anterior de estruturas abdominais, como a aorta ou o cólon, ou de órgãos retroperitoniais, como os rins, auxiliam na identificação do sítio da lesão. Contudo, existem situações em que a localização exata é difícil, em razão da distorção anatômica promovida pela lesão(1,3,5,16). Nesse caso, o comprometimento retroperitonial deve ser pormenorizado pela descrição dos espaços envolvidos. As próximas etapas devem excluir origem em órgão retroperitonial maior, com a finalidade de agrupá-la como lesão retroperitonial primária, classificá-la como lesão sólida ou cística, analisar as principais características de imagem (gordura macroscópica, calcificações, estroma mixoide, necrose/áreas císticas e vascularização) e explicitar sua relação com estruturas adjacentes. Existem sinais radiológicos (“sinal do crescente”, “sinal do órgão embutido”, “sinal do órgão invisível”) que auxiliam na propedêutica e, quando negativos, podem confirmar o acometimento retroperitonial primário(1). A avaliação conjunta desses achados visa estreitar os possíveis diagnósticos diferenciais e orientar a melhor conduta terapêutica(1,3,5,14). Gordura A gordura intralesional reduz significativamente a lista de diagnósticos diferenciais e engloba lesões com comportamento biológico distinto, como lipossarcoma, teratoma e hematopoese extramedular(17). Lipossarcoma – É o sarcoma retroperitonial mais comum, acomete indivíduos na 5ª e 6ª décadas de vida e representa cerca de 30% dos sarcomas retroperitoniais. Pode ser classificado em bem diferenciado com ou sem componente de desdiferenciação, mixoide, células redondas e pleomórfico, os quais apresentam características clinicorradiológicas distintas. É frequente a localização no espaço perirrenal. O lipossarcoma bem diferenciado é o subtipo mais comum, contém tecido adiposo maduro e se caracteriza por massa infiltrativa em relação às estruturas adjacentes(3,4,14,18). Entre as características de imagem que favorecem esse diagnóstico, em detrimento de uma lesão benigna, está o tamanho da lesão superior a 10 cm e a presença de septos espessos (> 0,2 cm) e de focos de realce nodular(3,19,20). Entretanto, a análise histopatológica com pesquisa de marcadores moleculares (anticorpos anti-CDK4 e anti-MDM2) auxilia nessa distinção. A ampla ressecção cirúrgica é o tratamento de escolha quando tecnicamente factível, com o objetivo de margens negativas para evitar recorrência local(21,22). Atualmente, algumas terapias-alvo para oncogenes amplificados têm se tornado promissoras no tratamento de alguns lipossarcomas, destacando-se os subtipos bem diferenciado e desdiferenciado(23,24). Teratoma retroperitonial – É um tumor de células germinativas derivado das camadas embrionárias e pode apresentar marcadores séricos elevados (alfafetoproteína, CEA, CA 19-9, β-HCG)(6,25,26). Caracteriza-se por gordura macroscópica, áreas císticas, calcificações, nível líquido-gordura, além de realce heterogêneo pelos meios de contraste(26,27) (Figura 2). A remoção cirúrgica do tumor é o principal tratamento(6,25). Deve-se considerar a possibilidade de lesão retroperitonial secundária de origem gonadal em pacientes do sexo masculino, e os testículos sempre devem ser investigados(5). 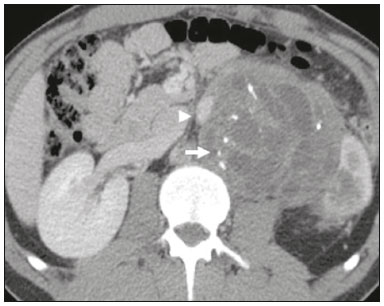 Figura 2. Teratoma maduro em mulher de 23 anos. A imagem de TC demonstra massa retroperitonial com componentes de gordura, áreas císticas e calcificações de permeio (seta). Estes achados em conjunto, com destaque para componente adiposo, sugerem a possibilidade de lesão de origem germinativa. Observa-se deslocamento anterior da aorta em relação ao corpo vertebral – sinal indireto de localização retroperitonial (cabeça de seta). A confirmação diagnóstica foi por biópsia percutânea. Hematopoese extramedular – É um mecanismo compensatório relacionado à redução da hematopoese na medula óssea e caracteriza-se por depósitos de tecido hematopoético em órgãos de origem mesenquimal (baço, fígado) e nos tecidos paravertebrais(16). Na imagem, observam-se massas múltiplas e bilaterais, homogêneas e com discreto realce pelos meios de contraste, podendo conter gordura macroscópica(5). Os achados secundários de anemia crônica, incluindo dados clínicos e laboratoriais, contribuem para o diagnóstico. Mielolipoma extra-adrenal – É uma lesão mesenquimal benigna rara, mais comumente unilateral, que contém tecido adiposo e hematopoético e que pode ocorrer no retroperitônio, mais comumente na região pré-sacral. Acomete mais frequentemente mulheres entre os 50–70 anos de idade. Geralmente são assintomáticos e descobertos incidentalmente em exames de imagem, mas podem cursar com dor abdominal decorrente de hemorragia, infarto tumoral ou compressão extrínseca. Os principais diagnósticos diferenciais são o teratoma retroperitonial, a hematopoese extramedular e o lipossarcoma, sendo praticamente indistinguível nos estudos de imagem deste último. A biópsia é frequentemente necessária para essa distinção e a presença de componentes hematopoéticos confirma o diagnóstico. As opções de tratamento variam desde controle por imagem das lesões assintomáticas e pequenas, até cirurgia para os casos sintomáticos, volumosos e com crescimento progressivo ou para os casos cuja natureza da lesão permanece indeterminada(21,28–30). O linfangioma cístico pode representar conteúdo lipídico nos estudos de imagem pela presença de material quiloso(8). Ponto chave: Existe um grupo específico de lesões retroperitoniais com comportamento biológico distinto que contém gordura. A pesquisa de conteúdo adiposo durante a avaliação por imagem reduz a lista de possíveis diagnósticos diferenciais. Calcificação Entre as lesões sólidas que podem conter calcificações estão os tumores neurogênicos, os lipossarcomas desdiferenciados, o teratoma e o sarcoma pleomórfico indiferenciado(5,18). Lipossarcoma desdiferenciado – Apresenta calcificações em cerca de 30% dos casos, e quando essas calcificações estão associadas a nódulos com realce heterogêneo, sugerem áreas de desdiferenciação tumoral e pior prognóstico(2,18,31,32) (Figura 3). Na investigação dos lipossarcomas, a 18F-FDG PET/CT pode auxiliar na avaliação do grau tumoral, assim como no estadiamento e no seguimento pós-cirúrgico, por meio da captação dos componentes sólidos da lesão, sobretudo nos subtipos desdiferenciado e pleomórfico(18,22,32). Alguns estudos apontam que o grau tumoral se correlaciona com o metabolismo glicolítico(22). 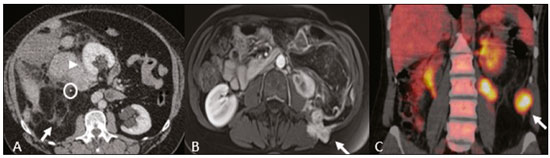 Figura 3. Lipossarcoma desdiferenciado. A: Homem, 58 anos. A imagem de TC demonstra lesão infiltrativa com componentes sólidos e adiposos (seta). Observa- se deslocamento do rim direito (cabeça da seta), inferindo localização no espaço pararrenal posterior e foco de calcificação sugerindo desdiferenciação tumoral (círculo). B,C: Mulher, 44 anos. A imagem de RM ponderada em T1 com saturação de gordura e após injeção de contraste (B) demonstra lesão infiltrativa contendo gordura (perda de sinal) e nódulos infiltrando a parede abdominal (seta). Foi realizada biópsia percutânea dos nódulos por ultrassonografia e a 18F-FDG PET/CT demonstrou hipermetabolismo (seta em C), correspondendo aos focos de desdiferenciação. Teratoma retroperitonial – Caracteriza-se por lesão predominantemente cística contendo gordura e calcificações, sendo este achado sugestivo de teratoma maduro (Figura 2). Os teratomas imaturos, por outro lado, são incomuns e indistinguíveis da variante benigna apenas pelas características de imagem(3,5,33). Tumor estromal extragastrintestinal – Neoplasia mesenquimal originária das células intersticiais de Cajal, localiza-se fora do trato gastrintestinal, sendo o retroperitônio raramente acometido. Caracteriza-se por mutações no gene c-kit, sendo histologicamente semelhante ao tumor estromal gastrintestinal. Manifestam-se como massas homogêneas ou heterogêneas, com necrose central e calcificações. O principal diagnóstico diferencial inclui os sarcomas(18). Ponto chave: Calcificação é um achado comum na maior parte das lesões retroperitoniais e deve ser associada a outras características de imagem, como gordura, para estreitar o diagnóstico diferencial. Em relação ao lipossarcoma, a presença de calcificação, nódulos com realce e captação no estudo de 18F-FDG PET/CT sugerem componente tumoral desdiferenciado. Estroma mixoide O estroma mixoide corresponde a uma matriz mucoide rica em mucopolissacarídeos e é caracterizado pelo típico hipersinal nas imagens ponderadas em T2 na RM e pelo realce tardio pós-contraste(1). As principais lesões que contêm matriz mixoide são os tumores neurogênicos, o lipossarcoma mixoide e o mixofibrossarcoma(2,31). Destacamos o lipossarcoma mixoide e os tumores neurogênicos, que podem se originar da bainha neural, do sistema paraganglionar ou dos gânglios simpáticos(3). Tumores neurogênicos – São originários da bainha neural e englobam os schwannomas e os neurofibromas. Os schwannomas são os tumores benignos de bainha neural mais frequentes, comuns em adultos jovens, e podem estar associados a neurofibromatoses(1,10,11,34). Nos exames de imagem, manifestam-se como massas de morfologia oval ou esférica, circunscritas, com realce heterogêneo e frequentemente localizadas na região paravertebral(3,11). Na RM, a intensidade de sinal varia dependendo do tipo de tecido predominante, por exemplo, o característico hipersinal em T2 relacionado à maior quantidade de estroma mixoide(1,10). Além disso, podem comprimir estruturas adjacentes, dependendo da localização e do tamanho(10,34). O tratamento de escolha consiste em cirurgia, principalmente se as lesões são grandes ou sintomáticas, ou no seguimento dos casos assintomáticos ou com alta morbidade cirúrgica(3,4,13). Os neurofibromas caracterizam-se pela proliferação de todos os elementos da estrutura nervosa e tendem a determinar expansão difusa do nervo(10). Manifestam-se como massas com atenuação de partes moles, hipointensas nas imagens ponderadas em T1 e com sinal variável em T2 na RM(3). Outras características incluem a presença de degeneração mixoide, aspecto em alvo e realce variável pelo contraste(3,27). Geralmente, apresentam morfologia fusiforme, com orientação longitudinal em relação ao trajeto do nervo acometido, ou podem cursar com alargamento de forame neural quando se originam das raízes nervosas espinais(3). Os neurofibromas plexiformes retroperitoniais são tipicamente bilaterais e simétricos e seguem a distribuição do plexo lombossacral, sendo quase exclusivos da neurofibromatose tipo I(3,11). É importante ressaltar que os tumores malignos da bainha do nervo periférico correspondem a 10% dos sarcomas de tecidos moles e atualmente representam um grupo de neoplasias originárias de qualquer célula da bainha neural, incluindo o schwannoma maligno e os neurofibrossarcomas. Acometem uma faixa etária em torno dos 20–50 anos e estão fortemente associados à neurofibromatose tipo I(35,36). Em relação aos tumores neurogênicos originários do sistema paraganglionar, destacam-se os paragangliomas retroperitoniais, que são oriundos de células cromafins remanescentes em sítios extra-adrenais. O retroperitônio é a localização extra-adrenal mais comum dos paragangliomas, originando-se mais frequentemente nos corpos de Zuckerkandl (localizados na região para-aórtica próximos à origem da artéria mesentérica inferior)(3,11,14). São caracterizados por massas heterogêneas, com hemorragia, necrose central (40%), calcificações puntiformes e nível líquido-líquido. Na RM, apresentam hipersinal ou sinal heterogêneo em T2 e intenso realce pelo contraste(3,5,11). Alguns casos podem cursar com hipersecreção de catecolaminas(2,3,33). Aproximadamente 40% dos paragangliomas retroperitoniais são malignos, geralmente apresentando-se com necrose e metástases a distância(27,33,37). Os estudos de imagem funcionais são úteis para a localização do tumor e das metástases a distância, destacando-se a cintilografia com MIBG, a 18F-FDG PET/CT e a 68Ga-dotatate PET/CT, esta última superior para detecção de lesões(38,39) (Figura 4). A ressecção cirúrgica é o tratamento de escolha e mesmo nos casos metastáticos, pois se associa com a melhora da sobrevida(3,37). 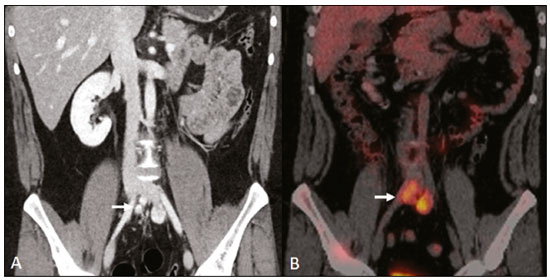 Figura 4. Paraganglioma retroperitonial em homem de 24 anos. As imagens de TC (A) e 18F-FDG PET/CT (B) demonstram lesões nodulares hipervascularizadas e com hipermetabolismo glicolítico adjacentes à bifurcação aortoilíaca. O grupo dos tumores neurogênicos derivados de gânglios simpáticos compreende os ganglioneuromas, neuroblastomas e ganglioneuroblastomas, sendo esses dois últimos mais comuns na faixa etária pediátrica(27). Os ganglioneuromas são tumores benignos de crescimento lento localizados ao longo do plexo simpático paravertebral, geralmente no mediastino posterior e no retroperitônio. Manifestam-se como massa bem definida, com atenuação inferior à do músculo, e podem conter estroma mixoide e calcificações puntiformes(1,3) (Figura 5). Na RM, apresentam hipossinal homogêneo em T1 e sinal variável em T2. Na metade dos casos, podem ser funcionantes (produção de catecolaminas e hormônios androgênicos)(2,11). O diagnóstico baseia-se no estudo anatomopatológico e a ressecção cirúrgica completa é o tratamento de escolha, principalmente quando sintomáticos(40). Entretanto, existem especialistas que preconizam o controle por imagem, que deve ser realizado com cautela pela possibilidade de coexistência de componentes pouco diferenciados(40,41). 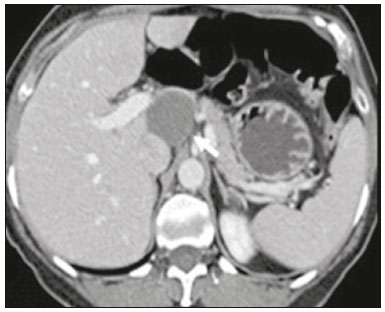 Figura 5. Ganglioneuroma em mulher de 31 anos. A imagem de TC demonstra lesão retroperitonial com aspecto pseudocístico (seta). Lipossarcoma mixoide – Acomete indivíduos numa faixa etária entre os 40–60 anos e é mais comum nas extremidades, principalmente nos planos profundos da coxa, mas podem se originar ocasionalmente no retroperitônio(11,31). Contém componentes não adiposos e adiposos mixoides, os quais determinam o aspecto pseudocístico nos estudos de imagem, assim como realce lento e progressivo pelo meio de contraste(3,11,18). O conteúdo adiposo corresponde, geralmente, a menos de 10% do volume tumoral(31). Mixofibrossarcoma – Previamente denominado histiocitoma fibroso maligno mixoide, acomete indivíduos com idade média de 65 anos e se origina no retroperitônio em cerca de 8% dos casos. Os achados de imagem são inespecíficos, com padrão variável devido à presença de estroma mixoide, tecido fibroso e celular, hemorragia e necrose associados ou não a presença de nível líquido ou pseudocápsula(31). Ponto chave: Estroma mixoide é um achado comum a um grande grupo de tumores retroperitoniais e é caracterizado pelo aspecto pseudocístico e característico hipersinal nas imagens ponderadas em T2 na RM. As relações anatômicas da lesão, como estruturas nervosas ou corpos de Zuckerkandl, assim como presença de síndromes genéticas, ajuda a estreitar o diagnóstico diferencial. Necrose A necrose é um achado característico de neoplasias de alto grau, geralmente indicando mau prognóstico e sendo encontrado nos tumores retroperitoniais malignos mais frequentes, descritos a seguir(1,3). Leiomiossarcoma – Corresponde ao segundo tumor retroperitonial primário mais comum em adultos entre 50–60 anos e se origina de tecido muscular liso retroperitonial, da parede vascular ou de remanescentes embrionários dos ductos de Wolff(11,14,18). Na imagem, caracteriza-se por massa volumosa com necrose, hemorragia ocasional e com envolvimento contíguo de estrutura vascular, sendo as calcificações e a gordura intralesional incomuns(3,18,32) (Figura 6). São descritos três padrões de crescimento nos estudos de imagem, os quais compreendem o extravascular, o intravascular e o combinado(11,19). O tratamento é difícil, pela complexidade cirúrgica, em razão do tamanho e da extensão tumoral, entretanto, a cirurgia permanece como o tratamento de escolha. A recorrência tumoral é frequente(19,42). A quimioterapia também é uma opção terapêutica, mesmo com finalidade paliativa(13,22,43). 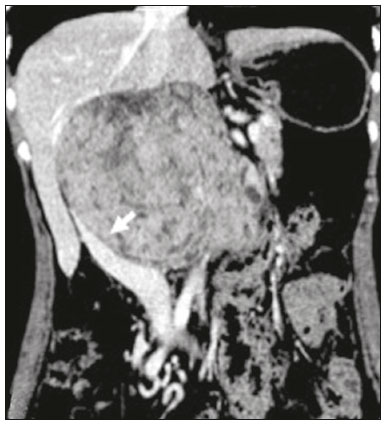 Figura 6. Leiomiossarcoma retroperitonial em mulher de 56 anos. A imagem de TC demostra volumosa lesão retroperitonial com realce heterogêneo e com focos de necrose. Observa-se amplo contato com a veia cava inferior (seta). Sarcoma pleomórfico indiferenciado – Anteriormente conhecido por histiocitoma fibroso maligno, foi reclassificado pela Organização Mundial da Saúde em 2013(31). O sarcoma pleomórfico indiferenciado é considerado o terceiro tumor retroperitonial mais comum e geralmente surge entre os 50–70 anos de idade(11,31). Os achados de imagem caracterizam-se por massas volumosas e infiltrativas, com realce heterogêneo e áreas de necrose, hemorragia, fibrose, calcificações (20%) com ou sem pseudocápsula(4,5,18,31). O tratamento de escolha é a ressecção cirúrgica e o prognóstico é diretamente relacionado ao grau tumoral, tamanho da lesão e presença de metástases(19). Lipossarcoma pleomórfico – É um tumor agressivo e heterogêneo, sendo o subtipo menos comum dentre os lipossarcomas, caracterizados por áreas de necrose e ausência de componente adiposo evidente nos estudos de imagem, sendo indistinguíveis de outros tumores sólidos retroperitoniais(3,14,18). Ponto chave: Lipossarcoma, leiomiossarcoma e sarcoma pleomórfico indiferenciado são os tumores mesenquimais malignos mais frequentes do retroperitônio, sendo a necrose uma característica comum a este grupo e que denota agressividade. Aspecto cístico Alguns tumores retroperitoniais possuem aspecto cístico e o linfangioma é a principal lesão a ser considerada no diagnóstico diferencial. Linfangioma cístico – É uma malformação linfática, benigna e de crescimento lento, causada por uma falha na comunicação dos canais linfáticos retroperitoniais com o sistema linfático principal(33). Pode apresentar conteúdo seroso, quiloso, hemorrágico ou misto e caracteriza-se por massa cística uni ou multilocular, de paredes finas e com atenuação variável, dependendo do conteúdo intralesional (Figura 7). O tratamento de escolha é a ressecção cirúrgica no caso de lesões volumosas, de crescimento rápido ou de pacientes sintomáticos. Para os demais pacientes, a conduta conservadora e o seguimento por imagem devem ser considerados(3,4,8). 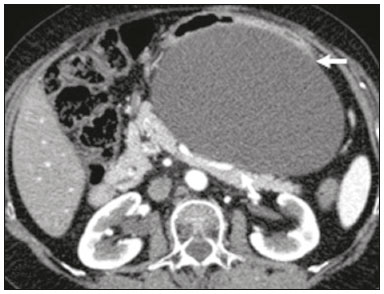 Figura 7. Linfangioma cístico retroperitonial em homem de 37 anos. A imagem de TC demonstra lesão cística retroperitonial (seta), que desloca as alças intestinais anteriormente e apresenta contato com o pâncreas. Foi realizada ressecção cirúrgica e o anatomopatológico demonstrou proliferação de vasos linfáticos dilatados, sem atipias, compatível com linfangioma. Mesotelioma cístico – É uma neoplasia benigna rara, de origem mesotelial, e caracteriza-se por lesão cística, de dimensões variadas, com paredes finas e indistintas de outras massas císticas do retroperitônio(14,33). Embora casos de transformação maligna já tenham sido descritos, alguns autores defendem que não existe potencial maligno para essas lesões(44). Dessa forma, recomenda-se controle periódico por imagem para pacientes não candidatos a cirurgia. Outras lesões císticas menos comuns incluem os cistos müllerianos, cistos epidermoides, pseudocistos não pancreáticos, cistoadenoma/cistoadenocarcinoma(1,14,33). Ainda merece destaque que alguns schwannomas e paragangliomas podem ser completamente císticos e devem ser incluídos no diagnóstico diferencial(33,34). Ponto chave: O manejo das lesões retroperitoniais císticas é um dilema clínico, em que as principais opções são a investigação por biópsia percutânea, seguimento clínico ou mesmo a excisão cirúrgica caso sejam sintomáticas(33). Vascularização A vascularização tumoral auxilia na caracterização das massas retroperitoniais. Dentre as lesões hipervasculares, destacamos os paragangliomas. Os tumores moderadamente hipervasculares incluem os leiomiossarcomas, mixofibrossarcoma e outros sarcomas. Por outro lado, os tumores hipovasculares compreendem os lipossarcomas de baixo grau, linfomas e a maioria dos tumores benignos(1). Lesões com “padrão em manto” O comportamento da lesão auxilia no diagnóstico diferencial, principalmente pelos padrões de crescimento, extensão e relação com as estruturas adjacentes. O termo “padrão em manto” é utilizado para as lesões que envolvem as estruturas adjacentes, sem sinais evidentes de infiltração. Linfoma – É a neoplasia maligna retroperitonial mais comum e corresponde ao principal tumor composto por células pequenas e redondas e tipicamente se apresenta como massa para-aórtica ou pélvica, que envolve as estruturas ao redor, de aspecto homogêneo e hipovascular(1,3–5). A necrose e as calcificações são incomuns antes do tratamento(3). Em relação ao diagnóstico, estadiamento e avaliação durante o tratamento, a 18F-FDG PET/CT é o exame padrão. No entanto, a avidez pela FDG depende de fatores como características histológicas, grau e proliferação tumoral(45,46). Alguns estudos demonstraram que linfomas de baixo grau ou indolentes apresentam menor avidez pela FDG, quando comparados aos de alto grau ou agressivos (por exemplo: linfoma de grandes células B, linfoma de Hodgkin tipo esclerose nodular)(45,47). O tratamento baseia-se na quimioterapia aliada a radioterapia consolidativa ou imunoterapia, conforme o subtipo histológico(46). Um diagnóstico diferencial importante é a linfonodomegalia metastática, que apresenta aspecto similar nos estudos de imagem(4,5). Doença de Erdheim-Chester – É uma histiocitose de células não Langerhans, rara e de origem desconhecida, que representa inflamação multissistêmica por histiócitos e comumente acomete indivíduos do sexo masculino com idade entre os 40–60 anos. Há acometimento retroperitonial em 29% dos casos, que se caracteriza por tecido de partes moles com atenuação homogênea na TC, hipossinal a isossinal em T1 e hipersinal em T2 na RM(3,5,48,49). O envolvimento circunferencial da aorta e do espaço perirrenal bilateral e simétrico é característico. Os ureteres também podem estar envolvidos(3,48,49) (Figura 8). O diagnóstico baseia-se na identificação de achados histopatológicos específicos em um contexto clinicorradiológico apropriado. São frequentes as alterações ósseas, e mesmo nos casos de elevada suspeita clínica a biópsia é usualmente necessária para confirmar o diagnóstico(48). Em razão da raridade da doença e dos escassos estudos randomizados, há pouco conhecimento sobre o tratamento específico, que se baseia em corticoterapia, uso de imunomoduladores e agentes citotóxicos, entre outros(48,49). 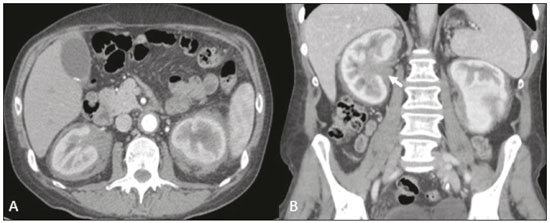 Figura 8. Padrão em manto. Doença de Erdheim-Chester em homem de 62 anos. As imagens de TC (A,B) demostram tecido sólido perirrenal (padrão em manto) envolvendo o hilo renal (seta em B). Não foi observada hidronefrose bilateral. Fibrose retroperitonial – É uma condição rara, mais comum no sexo masculino, e classificada nos subtipos idiopático ou secundário(3,4,50). A forma idiopática representa dois terços dos casos e a secundária está relacionada a neoplasias, infecções, traumas e outras condições. Nos exames de imagem, caracteriza-se por tecido com atenuação de partes moles e homogêneo, que circunda a aorta abdominal e as artérias ilíacas e que pode envolver estruturas adjacentes, como os ureteres e a veia cava inferior, determinando obstrução ureteral e trombose venosa(4,50). Na RM, apresenta intensidade de sinal em T2 e padrão de realce variáveis, conforme a atividade da doença(3). O tratamento da forma idiopática consiste em corticoterapia, e em alguns casos o tamoxifeno tem sido bem efetivo. Nos casos secundários, o tratamento baseia-se no manejo da causa primária(3,4,50). Ponto chave: Lesões retroperitoniais com padrão em manto englobam desde lesões benignas até malignas (por exemplo: linfoma), geralmente de tratamento medicamentoso/quimioterápico, sugerindo que a biópsia percutânea pode ser importante ferramenta no manejo clínico inicial. ALGORITMO DIAGNÓSTICO E MANEJO CLÍNICO Apresentamos um algoritmo com o objetivo de auxiliar no diagnóstico diferencial das principais massas retroperitoniais primárias por meio da análise das características de imagem citadas anteriormente (Figura 9). Na Figura 10 são abordadas as principais condutas no manejo das lesões retroperitoniais primárias. 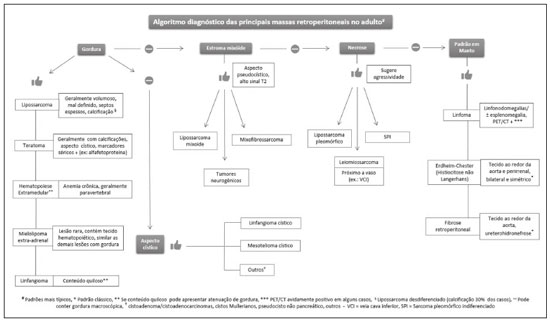 Figura 9. Algoritmo demonstrando avaliação prática das massas retroperitoniais com base nas principais características de imagem (gordura, aspecto cístico, estroma mixoide, necrose e padrão em manto). 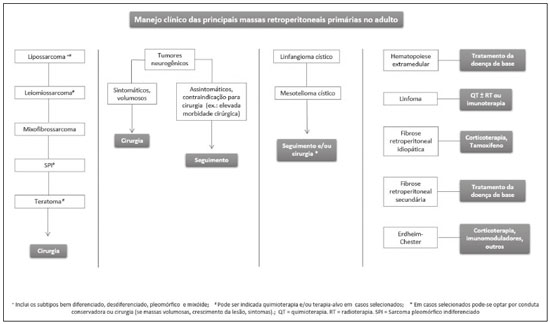 Figura 10. Manejo clínico das principais massas retroperitoniais. CONCLUSÃO As lesões retroperitoniais primárias são raras e representam um desafio diagnóstico, devido à superposição dos achados de imagem. O conhecimento das características de imagem ajuda a estreitar o diagnóstico diferencial e orientar a decisão clínica. REFERÊNCIAS 1. Nishino M, Hayakawa K, Minami M, et al. Primary retroperitoneal neoplasms: CT and MR imaging findings with anatomic and pathologic diagnostic clues. Radiographics. 2003;23:45–57. 2. Goenka AH, Shah SN, Remer EM. Imaging of the retroperitoneum. Radiol Clin North Am. 2012;50:333–55. 3. Chaudhari A, Desai PD, Vadel MK, et al. Evaluation of primary retroperitoneal masses by computed tomography scan. Int J Med Sci Public Health. 2016;5:1423–9. 4. Elsayes KM, Staveteig PT, Narra VR, et al. Retroperitoneal masses: magnetic resonance imaging findings with pathologic correlation. Curr Probl Diagn Radiol. 2007;36:97–106. 5. Scali EP, Chandler TM, Heffernan EJ, et al. Primary retroperitoneal masses: what is the differential diagnosis? Abdom Imaging. 2015;40:1887–903. 6. Tiu A, Sovani V, Khan N, et al. Primary retroperitoneal mature cystic teratoma (dermoid cyst) in a 51-year-old male: case report and historical literature review. SAGE Open Med Case Rep. 2017;5: 2050313X17700745. 7. Malgras B, Souraud JB, Chapuis O. Retroperitoneal gastric duplication cyst. J Visc Surg. 2014;151:479–80. 8. Ayyappan AP, Jhaveri KS, Haider MA. Radiological assessment of mesenteric and retroperitoneal cysts in adults: is there a role for chemical shift MRI? Clin Imaging. 2011;35:127–32. 9. Gâtita CE, Georgescu I, Nemes R. Difficulties in diagnosis of primitive retroperitoneal tumors. Current Health Sciences Journal. 2010;36:132–5. 10. Hoarau N, Slim K, Da Ines D. CT and MR imaging of retroperitoneal schwannoma. Diagn Interv Imaging. 2013;94:1133–9. 11. Brennan C, Kajal D, Khalili K, et al. Solid malignant retroperitoneal masses–a pictorial review. Insights Imaging. 2014;5:53–65. 12. Lee F, Huang TS, Ng XY, et al. Surgical management of primary retroperitoneal tumors – analysis of a single center experience. Journal of Cancer Research and Practice. 2017;4:49–52. 13. Strauss DC, Hayes AJ, Thomas JM. Retroperitoneal tumours: review of management. Ann R Coll Surg Engl. 2011;93:275–80. 14. Osman S, Lehnert BE, Elojeimy S, et al. A comprehensive review of the retroperitoneal anatomy, neoplasms, and pattern of disease spread. Curr Probl Diagn Radiol. 2013;42:191–208. 15. Coffin A, Boulay-Coletta I, Sebbag-Sfez D, et al. Radioanatomy of the retroperitoneal space. Diagn Interv Imaging. 2015;96:171–86. 16. Messiou C, Moskovic E, Vanel D, et al. Primary retroperitoneal soft tissue sarcoma: imaging appearances, pitfalls and diagnostic algorithm. Eur J Surg Oncol. 2017;43:1191–8. 17. Craig W, Fanburg-Smith JC, Henry LR, et al. Fat-containing lesions of the retroperitoneum: radiologic-pathologic correlation. Radiographics. 2009;29:261–90. 18. Sangster GP, Migliaro M, Heldmann MG, et al. The gamut of primary retroperitoneal masses: multimodality evaluation with pathologic correlation. Abdom Radiol (NY). 2016;41:1411–30. 19. Lubner MG, Hinshaw JL, Pickhardt PJ. Primary malignant tumors of peritoneal and retroperitoneal origin: clinical and imaging features. Surg Oncol Clin N Am. 2014;23:821–45. 20. van der Byl G, Cerica A, Sala MG. Retroperitoneal lipomas: a case report. J Ultrasound. 2012;15:257–9. 21. Butori N, Guy F, Collin F, et al. Retroperitoneal extra-adrenal myelolipoma: appearance in CT and MRI. Diagn Interv Imaging. 2012;93:e204–7. 22. Matthyssens LE, Creytens D, Ceelen WP. Retroperitoneal liposarcoma: current insights in diagnosis and treatment. Front Surg. 2015;2:4. 23. Nassif NA, Tseng W, Borges C, et al. Recent advances in the management of liposarcoma. F1000Res. 2016;5:2907. 24. Bill KL, Casadei L, Prudner BC, et al. Liposarcoma: molecular targets and therapeutic implications. Cell Mol Life Sci. 2016;73: 3711–8. 25. Peyvandi H, Arsan F, Alipour-Faz A, et al. Primary retroperitoneal mature cystic teratoma in an adult: a case report. Int J Surg Case Rep. 2016;28:285–8. 26. Kataoka M, Fukushima H, Nakanishi Y, et al. Retroperitoneal teratoma in an adult: a potential pitfall in the differential diagnosis of adrenal myelolipoma. Case Rep Urol. 2016;2016:5141769. 27. Xu Y, Wang J, Peng Y, et al. CT characteristics of primary retroperitoneal neoplasms in children. Eur J Radiol. 2010;75:321–8. 28. Hajiran A, Morley C, Jansen R, et al. Perirenal extra-adrenal myelolipoma. World J Clin Cases. 2014;2:279–83. 29. Temizoz O, Genchellac H, Demir MK, et al. Bilateral extra-adrenal perirenal myelolipomas: CT features. Br J Radiol. 2010;83:e198–9. 30. Hakim A, Rozeik C. Adrenal and extra-adrenal myelolipomas – a comparative case report. J Radiol Case Rep. 2014;8:1–12. 31. Jagannathan JP, Tirumani SH, Ramaiya NH. Imaging in soft tissue sarcomas: current updates. Surg Oncol Clin N Am. 2016;25:645–75. 32. Francis IR, Cohan RH, Varma DG, et al. Retroperitoneal sarcomas. Cancer Imaging. 2005;5:89–94. 33. Morotti A, Busso M, Consiglio-Barozzino M, et al. Detection and management of retroperitoneal cystic lesions: a case report and review of the literature. Oncol Lett. 2017;14:1602–8. 34. Hughes MJ, Thomas JM, Fisher C, et al. Imaging features of retroperitoneal and pelvic schwannomas. Clin Radiol. 2005;60:886–93. 35. Marçal NS, Teixeira E, Sotto-Mayor R, et al. Tumor maligno da bainha dos nervos periféricos do pulmão: a propósito de um caso clínico. Rev Port Pneumol. 2010;XVI:483–92. 36. Diogo CJ, Formigo A, Florova E, et al. Tumor maligno da bainha do nervo periférico. Relato de caso. Rev Bras Clin Med. 2012;10:69–72. 37. Ji XK, Zheng XW, Wu XL, et al. Diagnosis and surgical treatment of retroperitoneal paraganglioma: a single-institution experience of 34 cases. Oncol Lett. 2017;14:2268–80. 38. Bellamy J, Ittah A, Perez N. Unexpected finding at 18-FDG PET-CT: abdominal paraganglioma. Ann Clin Case Rep. 2016;1:1071. 39. Mojtahedi A, Thamake S, Tworowska I, et al. The value of (68)Ga-DOTATATE PET/CT in diagnosis and management of neuroendocrine tumors compared to current FDA approved imaging modalities: a review of literature. Am J Nucl Med Mol Imaging. 2014;4:426–34. 40. Martinho D, Pereira S, Formoso R, et al. Ganglioneuroma retroperitoneal: envolvimento do pedículo vascular do rim esquerdo. Acta Urológica. 2008;25:63–6. 41. Kumar S, Singh S, Chandna A. Organ preservation in a case of retroperitoneal ganglioneuroma: a case report and review of literature. Case Rep Surg. 2016;2016:6597374. 42. Shindo S, Matsumoto H, Ogata K, et al. Surgical treatment of retroperitoneal leiomyosarcoma invading the inferior vena cava: report of three cases. Surg Today. 2002;32:929–33. 43. Gemici K, Buldu I, Acar T, et al. Management of patients with retroperitoneal tumors and a review of the literature. World J Surg Oncol. 2015;13:143. 44. Park JY, Kim KW, Kwon HJ, et al. Peritoneal mesotheliomas: clinicopathologic features, CT findings, and differential diagnosis. AJR Am J Roentgenol. 2008;191:814–25. 45. Paes FM, Kalkanis DG, Sideras PA, et al. FDG PET/CT of extranodal involvement in non-Hodgkin lymphoma and Hodgkin disease. Radiographics. 2010;30:269–91. 46. Johnson SA, Kumar A, Matasar MJ, et al. Imaging for staging and response assessment in lymphoma. Radiology. 2015;276:323–38. 47. Bodet-Milin C, Eugène T, Gastinne T, et al. The role of FDG-PET scanning in assessing lymphoma in 2012. Diagn Interv Imaging. 2013;94:158–68. 48. Diamond EL, Dagna L, Hyman DM, et al. Consensus guidelines for the diagnosis and clinical management of Erdheim-Chester disease. Blood. 2014;124:483–92. 49. Matzumura M Arias-Stella J 3rd, Novak JE. Erdheim-Chester disease: a rare presentation of a rare disease. J Investig Med High Impact Case Rep. 2016;4:2324709616663233. 50. Vaglio A, Salvarani C, Buzio C. Retroperitoneal fibrosis. Lancet. 2006; 367:241–51. 1. Serviço de Radiologia do Instituto do Câncer do Estado de São Paulo Octavio Frias de Oliveira (Icesp), São Paulo, SP, Brasil; a. https://orcid.org/0000-0001-9003-4017 2. Serviço de Radiologia do Instituto do Câncer do Estado de São Paulo Octavio Frias de Oliveira (Icesp), São Paulo, SP, Brasil; b. https://orcid.org/0000-0002-9318-5272 3. Serviço de Radiologia do Instituto do Câncer do Estado de São Paulo Octavio Frias de Oliveira (Icesp), São Paulo, SP, Brasil; c. https://orcid.org/0000-0002-9097-6546 Correspondência: Dr. Regis O. F. Bezerra Avenida Doutor Arnaldo, 251, Cerqueira César São Paulo, SP, Brasil, 01246-000 E-mail: regisfranca@gmail.com Recebido para publicação em 6/10/2017 Aceito, após revisão, em 15/2/2018 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554